NEJM 重磅:ibrutinib 联合 venetoclax 一线治疗 CLL 显著优于单药及化疗,无可测量残留病灶监测指导个体化疗程成关键
6小时前 MedSci原创 MedSci原创 发表于上海
本研究首次大规模、高质量地证实在前期未治疗的CLL患者中,基于MRD动态监测指导的ibrutinib联合venetoclax治疗能够显著提高深度分子缓解率,实现高比例骨髓MRD阴性。
编辑推荐
- ibrutinib联合venetoclax相较于ibrutinib单药治疗,在2年内实现骨髓中无可测量残留病灶(MRD)的患者比例显著增加(66.2% vs. 0%)
- ibrutinib加venetoclax治疗组5年无进展生存率达到93.9%,明显优于ibrutinib单药(79.0%)及传统化疗FCR方案(58.1%)
- 总体生存率方面,联合方案同样显示优越性,尤其在IGHV未突变亚组更为明显
慢性淋巴细胞白血病(CLL)作为一种常见的成年白血病,病理特征为异常B细胞克隆性增殖,受B细胞受体(BCR)的信号通路调控,其中Bruton酪氨酸激酶(BTK)为关键分子。ibrutinib作为口服BTK抑制剂,阻断BCR信号传导,有效抑制CLL细胞的增殖与迁移。venetoclax靶向抗凋亡蛋白BCL2,促进CLL细胞凋亡。单药BTK抑制剂治疗虽改进生存率,但长期用药弊端明显,包括耐药风险和毒副作用。鉴于两药作用机制互补,联合方案成为近年来研究热点。然而,联合治疗是否优于ibrutinib单药尚缺乏明确对比证据。此外,通过MRD水平指导治疗持续时间,个体化调整疗程,可能优化疗效与安全性,减少不必要的暴露,但临床实践尚处探索阶段。

近期发表在《新英格兰医学杂志》(NEJM)中的FLAIR三期多中心随机对照试验为CLL一线治疗提供了重要循证依据。研究对比了联合靶向药物ibrutinib与venetoclax(BTK抑制剂与BCL2抑制剂)组合、ibrutinib单药及传统化疗方案FCR(氟达拉滨-环磷酰胺-利妥昔单抗)的疗效与安全性。通过骨髓及外周血中MRD监测指导用药疗程,最终结果显示联合治疗不仅极大提高MRD阴性率,还显著延长无进展生存及总体生存,为临床决策提供精确的分子标志物支持。
FLAIR为开放标签、平行3臂的多中心三期随机对照试验,于99家英国医院纳入786名前未治疗CLL患者。患者随机分配为:ibrutinib–venetoclax联合治疗组(n=260)、ibrutinib单药组(n=263)、FCR化疗组(n=263)。联合组先行ibrutinib 8周预处理后加入venetoclax,疗程最长可达6年,具体停药依据MRD结果。联合组和单药组治疗期间每6个月进行MRD检测,MRD阴性达到预设标准时可提前停止治疗。FCR组则为传统6个28天周期。主要终点包括联合组与ibrutinib单药组骨髓中2年内无可测量MRD的比例,以及联合组与FCR组的无进展生存;重点次要终点涵盖联合组与ibrutinib单药组无进展生存及总体生存。
纳入786例患者,三组基线特征均衡,中央値年龄62岁。
(一)MRD阴性率:
- 联合组:66.2%患者在2年内骨髓MRD检测为阴性
- 单药组:0%实现骨髓MRD阴性(P<0.001)
- FCR组:48.3%实现骨髓MRD阴性
(二)无进展生存(PFS):
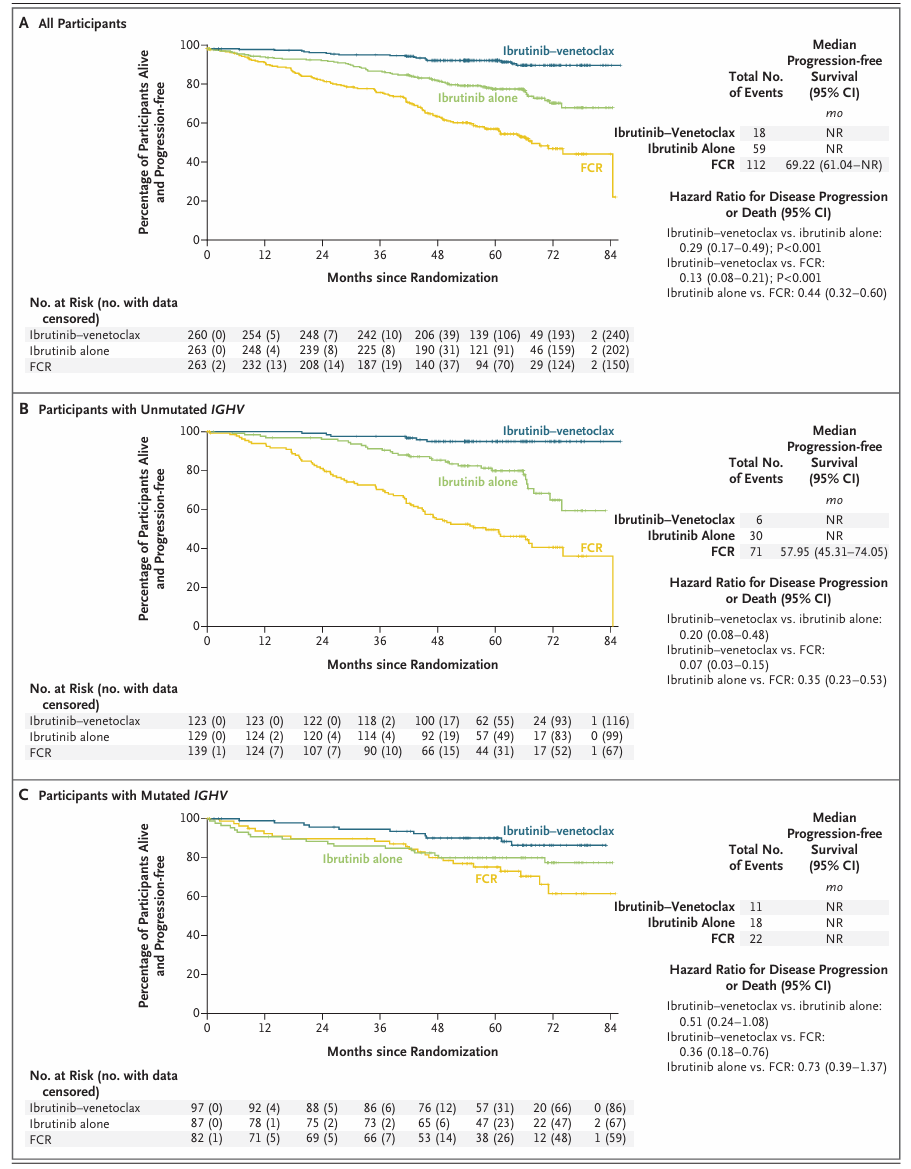
- 随访中位62.2个月,联合组无进展生存显著优于单药组(风险比0.29,95%CI 0.17-0.49;P<0.001)及FCR组(风险比0.13,95%CI 0.08-0.21;P<0.001)
- 5年PFS率:联合组93.9%、单药组79.0%、FCR组58.1%
- IGHV未突变亚组中联合组获益尤为显著,PFS风险比联合vs单药:0.20;联合vs FCR: 0.07
- IGHV突变亚组中,联合组与单药组PFS相近,但联合组较FCR组显著优越
(三)总体生存(OS):
- 5年OS率:联合组95.9%、单药组90.5%、FCR组86.5%
- 联合组较单药组病死风险降低59%(风险比0.41, 95%CI 0.20-0.83)
- IGHV未突变亚组联合组显示显著生存优势
(四)安全性:
- 联合组最常见3级及以上不良事件为中性粒细胞减少(27.2%),低于FCR组(47.3%)
- ibrutinib相关的心脏毒性(心律失常、房颤、血压升高)在联合及单药组相似,较FCR组高
- 继发肿瘤发生率联合组低于FCR组(2.8 vs 5.5/100患者-年)
- 突发死亡事件联合组较单药组及FCR组少
- 严重肿瘤溶解综合征发生少见且均可控
综上,本研究首次大规模、高质量地证实在前期未治疗的CLL患者中,基于MRD动态监测指导的ibrutinib联合venetoclax治疗能够显著提高深度分子缓解率,实现高比例骨髓MRD阴性。这不仅预示着疗效上的超越,更实质性地延长了无进展及总体生存时间,尤其是IGHV未突变患者获益显著。相较于传统化疗和单药BTK抑制剂,联合靶向治疗表现出明确的疗效优势和可控的安全性,体现出靶向联合治疗与治疗个体化的完美结合。此策略有效规避了长期BTK抑制剂单药治疗的耐药及毒副作用风险,同时也超越了传统化疗的耐受性局限,标志着CLL治疗进入精准深度缓解并以分子标志物为导向的新时代。
研究还提示,在突变IGHV患者群体中,联合治疗优势尚不明显,提示今后个体化治疗方案需要进一步细化。MRD监测不仅作为疗效评价指标,更成为治疗决策的重要依据,推动临床向动态精准管理转型。未来长期随访将揭示该策略是否能实现持久治愈,及其与传统固定疗程方案的成本-效益对比。该研究为靶向治疗联合策略,以及MRD动态指导下的治疗优化提供了坚实的循证基础,同时为新一代CLL诊疗体系构筑重要里程碑。
原始出处
Munir T, Girvan S, Cairns DA, et al. Measurable Residual Disease–Guided Therapy for Chronic Lymphocytic Leukemia. N Engl J Med. Published June 15

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














前往app查看评论内容
0 0
前往app查看评论内容
4 0