ATVB 东南大学附属中大医院刘乃丰教授团队发现PARP1介导的POLG PARylation加速铁死亡诱导的血管钙化
2025-05-27 论道心血管 论道心血管 发表于上海
该研究发现PARP1介导的POLG的PARylation修饰通过激活Adora2a-Rap1信号通路,加速铁死亡诱导的血管钙化。
血管钙化与心脏疾病、卒中、动脉粥样硬化斑块破裂的发生风险增加相关。然而,其具体机制尚未完全明确,探索血管钙化的发病机制具有重要价值。
铁死亡是一种铁依赖性脂质过氧化介导的程序性细胞死亡,其特征是线粒体结构异常,铁超载和脂质过氧化物水平升高,但目前铁死亡参与血管钙化的具体机制仍未完全明确。因此,研究者推测:钙化刺激可诱导血管平滑肌细胞(VSMCs)铁死亡,释放促钙化因子,加速VSMC钙化。
聚(ADP-核糖)聚合酶1 (PARP1, (poly (ADP-ribose) polymerase 1)定位于细胞核,可同时调控衰老、炎症和死亡这三种钙化VSMCs所具有的病理特征。ADP-核糖基化(PARylation)是一种可逆的蛋白翻译后修饰形式。PARP1通过直接结合作用或PARylation增强子和启动子,发挥转录共激活的作用,调节自身和其他基因的表达。PARP1介导的PARylation修饰在血管钙化中的确切作用尚不清楚,有待进一步探索。
东南大学附属中大医院心血管内科刘乃丰教授团队长期从事代谢性心血管病和糖尿病血管并发症等方面的基础与临床研究,在该领域研究中有一定积累,发表了系列研究论文。本团队近年来在线粒体微环境层面,以线粒体稳态在血管钙化中的作用机制为主线,围绕线粒体膜蛋白FUNDC1、糖代谢关键酶丙酮酸脱氢酶激酶4 (PDK4)、线粒体DNA损伤(mitochondrial DNA stress)、线粒体ROS、线粒体自噬等热点,探索其对血管钙化的作用及机制。
2025年5月22日,刘乃丰教授团队在Arteriosclerosis, Thrombosis, and Vascular Biology 在线发表了题为“PARylation of POLG Mediated by PARP1 Accelerates Ferroptosis-Induced Vascular Calcification via Activating Adora2a/Rap1 Signaling”的研究论文,发现PARP1介导的POLG的PARylation修饰通过激活Adora2a-Rap1信号通路,加速铁死亡诱导的血管钙化。
ATVB在心血管病学期刊中属于细分领域的权威期刊,在外周血管病、血栓形成等方向的学术影响力突出。快速审稿、低自引率、严格的稿件筛选机制以及AHA(美国心脏协会)的学术背书,使其成为血管生物学领域高质量研究的优选平台。对于专注于血管疾病机制或转化医学的研究者,ATVB的学术价值可与部分高IF综合期刊相媲美。

本研究发现,PARP1在β-甘油磷酸诱导的VSMC钙化中表达增加(原文图1)。构建PARP1稳定敲减的细胞系,结果表明,敲低PARP1可减轻血管钙化(原文图2),抑制VSMCs铁死亡(原文图3),部分恢复线粒体功能(原文图4)。
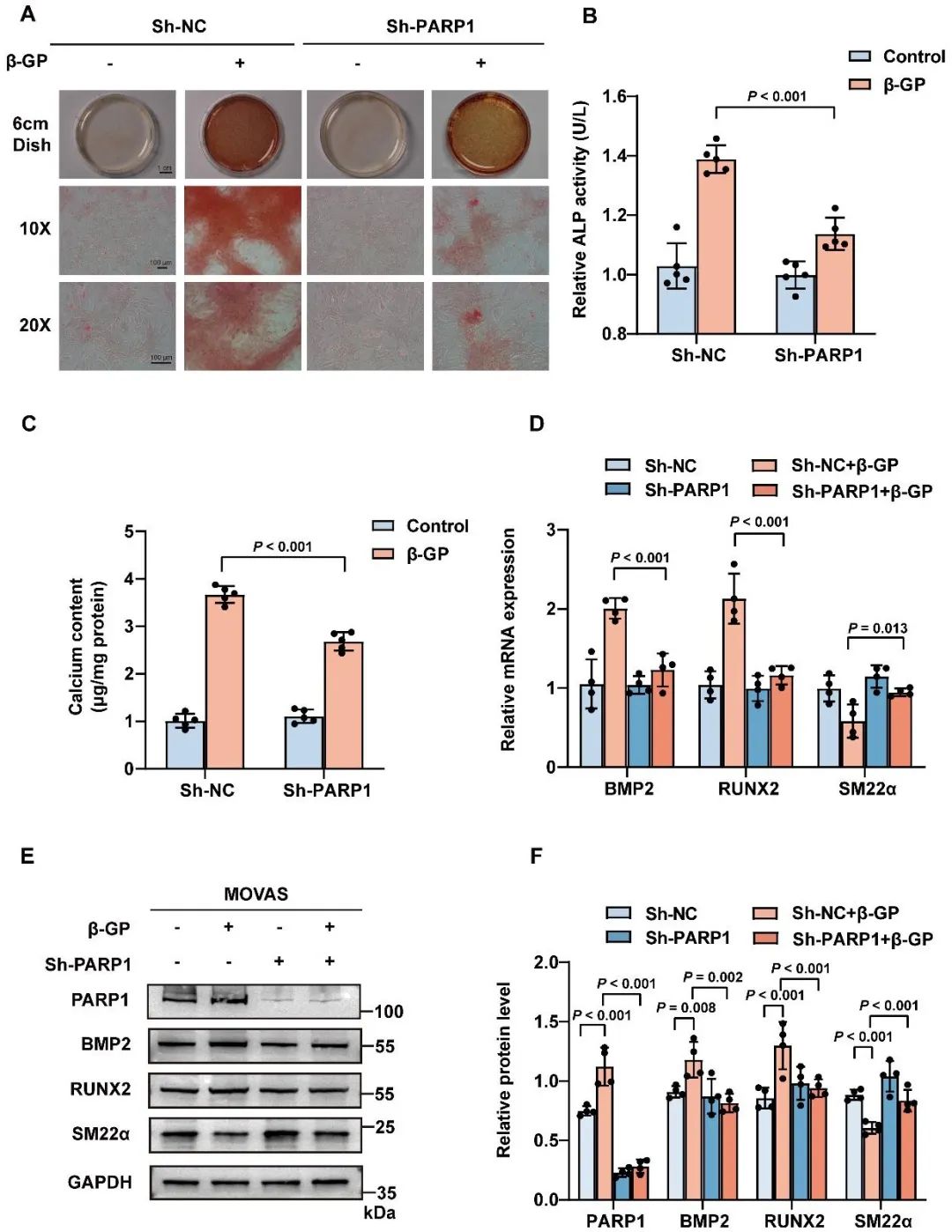
敲减PARP1可减轻β-GP诱导的VSMC钙化
PARP1是PARylation过程中的关键催化酶。机制研究表明:在β-GP刺激下,PARP1从细胞核迁移到线粒体,在线粒体中与POLG相互作用并催化POLG的PARylation。敲减PARP1可能通过抑制POLG的PARylation来改善线粒体功能,从而增加POLG蛋白的表达水平。进一步地,研究者发现POLG的下调受PARylation依赖的泛素化的影响(原文图5)。
接下来,通过一系列的挽救实验(rescue experiments)发现,PARP1对线粒体功能和血管钙化的影响依赖于其对POLG的调控(原文图6)。
基于RNA-seq和生物信息学分析,过表达POLG抑制Adora2a/Rap1信号通路。在过表达POLG的VSMCs中,上调Adora2a表达水平可加重铁死亡;而使用Rap1抑制剂ESI-09可部分逆转这一现象(原文图7)。
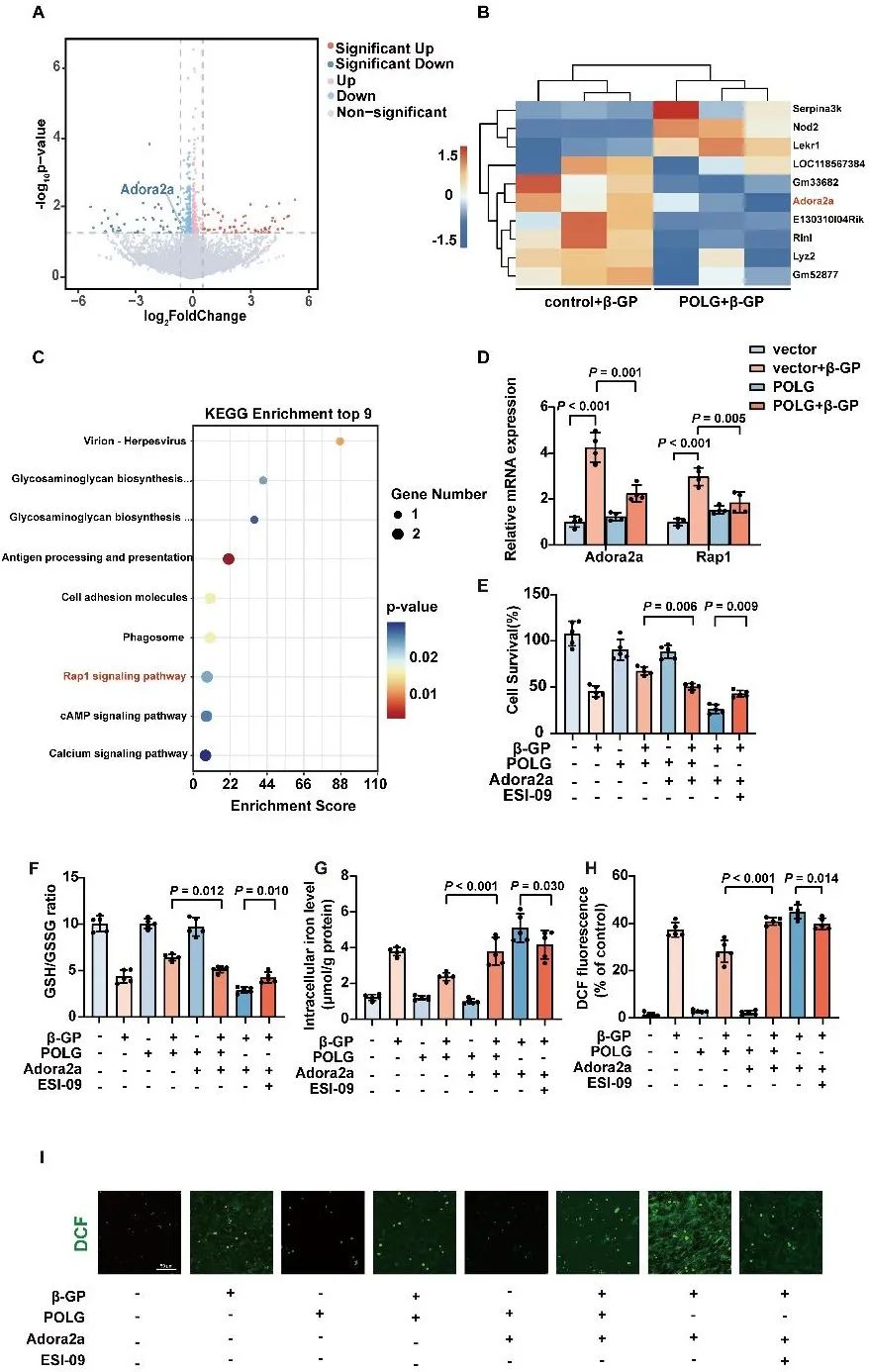
POLG通过抑制Adora2a/Rap1信号通路减轻VSMC铁死亡
最后,研究者使用PARP1血管平滑肌细胞条件性敲除小鼠(PARP1flox/flox Tagln Cre+)构建了两种在体的血管钙化模型,并使用AAV9敲低POLG来研究体内PARP1和POLG的调控关系。第一种是维生素D3诱导的小鼠血管钙化模型。与对照组相比,PARP1flox/flox Tagln Cre+小鼠血管钙化程度减轻。然而,在PARP1flox/flox Tagln Cre+小鼠中敲减POLG则会显著抑制线粒体功能,增加铁死亡,进一步加重钙化(原文图8)。此外,本研究通过腺嘌呤饮食诱导慢性肾脏病(CKD)小鼠血管钙化模型中,再次验证了上述结果(原文图9)。
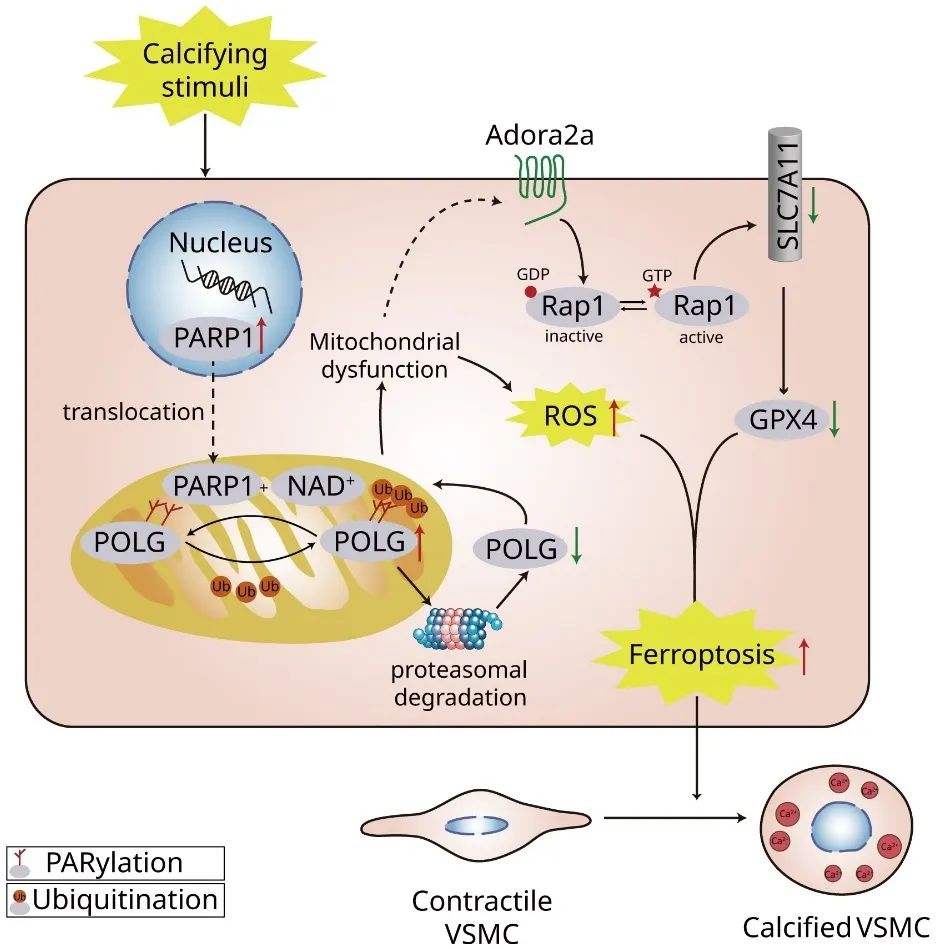
图表摘要:在β-GP刺激下,PARP1从细胞核迁移到线粒体,并在线粒体中与POLG相互作用并催化POLG PARylation。这触发了POLG PARylation依赖性泛素化,导致POLG表达下调,破坏线粒体功能,激活Adora2a/Rap1信号通路诱导VSMC铁死亡,最终加重血管钙化。
东南大学附属中大医院心血管内科刘乃丰教授为本文的通讯作者。东南大学附属中大医院心血管内科博士生杨艺清为该论文的第一作者。
原文链接:
https://www.ahajournals.org/doi/10.1161/ATVBAHA.124.321682
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#血管钙化# #铁死亡#
9