JHO:巨核细胞 C3G 特异性表达通过促进骨髓脂肪细胞分化,开辟造血恢复治疗新路径
10小时前 吾乃喵大人 MedSci原创 发表于上海
本研究旨在揭示C3G在巨核细胞中的表达变化如何影响骨髓脂肪细胞扩张及造血干细胞的再生,进而调节骨髓微环境的功能,并探讨其在化疗及骨髓移植中的治疗潜力。
研究亮点
- C3G在巨核细胞中特异性表达,推动其成熟和骨髓脂肪细胞(BMA)扩张,促进化疗诱导骨髓耗竭后的造血恢复。
- C3G通过调控巨核细胞分泌因子,尤其是FGF1,增强脂肪细胞的分化与功能,从而优化造血干细胞的微环境。
- C3G表达水平影响造血干/祖细胞的分化走向,促进骨髓造血再生中髓系-巨核细胞谱系偏移,同时改善化疗及骨髓移植患者的生存率,表现出其潜在治疗靶点价值。
4月1日,发表于Journal of Hematology & Oncology杂志的一项最新研究,聚焦于调节骨髓巨核细胞(MK)功能的关键分子C3G(encoded by RAPGEF1),揭示其促进骨髓脂肪细胞(BMA)扩张及造血干细胞(HSC)再生的作用机制。该研究以转基因及敲除小鼠模型为基础,重点阐明了C3G对巨核细胞成熟、骨髓脂肪细胞诱导以及化疗(5-氟尿嘧啶,5-FU)和全身放疗后骨髓恢复的影响,为造血系统损伤的修复提供了新的分子靶点与理论依据。

骨髓微环境在维持正常及应激状态下的造血稳态中发挥关键作用。巨核细胞被公认为调控造血干细胞(HSC)静止与活化的骨髓“生态位”细胞之一。巨核细胞通过分泌TGFβ1、PF4(即CXCL4)及IL-6等因子,维持HSC的静止状态和自我更新能力。而在应激状态,如化疗药物5-FU诱导的骨髓抑制后,巨核细胞数量及活性增加,分泌成纤维细胞生长因子1(FGF1)促进造血干细胞的扩增。
另一方面,骨髓脂肪细胞(BMA)作为骨髓微环境的重要组成部分,既通过TNFα和脂联素等分泌物负反馈调控HSC数量,又能通过干细胞因子(SCF)促进造血恢复。尽管已有研究揭示巨核细胞与脂肪细胞之间存在复杂的相互作用,但其分子调控机制尚未明确。此外,C3G作为Rap1的鸟嘌呤核苷交换因子(GEF),已知参与巨核细胞分化、血小板功能及肿瘤转移过程,但其在骨髓巨核细胞-脂肪细胞-造血干细胞相互关系中的作用尚未系统研究。
本研究旨在揭示C3G在巨核细胞中的表达变化如何影响骨髓脂肪细胞扩张及造血干细胞的再生,进而调节骨髓微环境的功能,并探讨其在化疗及骨髓移植中的治疗潜力。
研究结果
1. C3G促进巨核细胞成熟加速造血恢复
在5-FU诱导的骨髓抑制模型中,巨核细胞专一性C3G过表达小鼠(tgC3GPf4)展现出加速的血小板恢复,伴随白细胞和红细胞数量的升高,显示造血恢复整体加强(见图1B-F)。相反,C3G缺失(C3GPf4-KO)小鼠其恢复受阻,回升迟缓。组织学分析显示,5-FU处理后tgC3GPf4骨髓巨核细胞数量下降,但成熟度显著提高,体积增大;而C3G KO组巨核细胞数量增加但成熟延迟(见图1J-Q)。此外,巨核细胞在骨髓远端的富集趋势更明显,提示C3G影响巨核细胞的定位及功能(见图1R,S)。
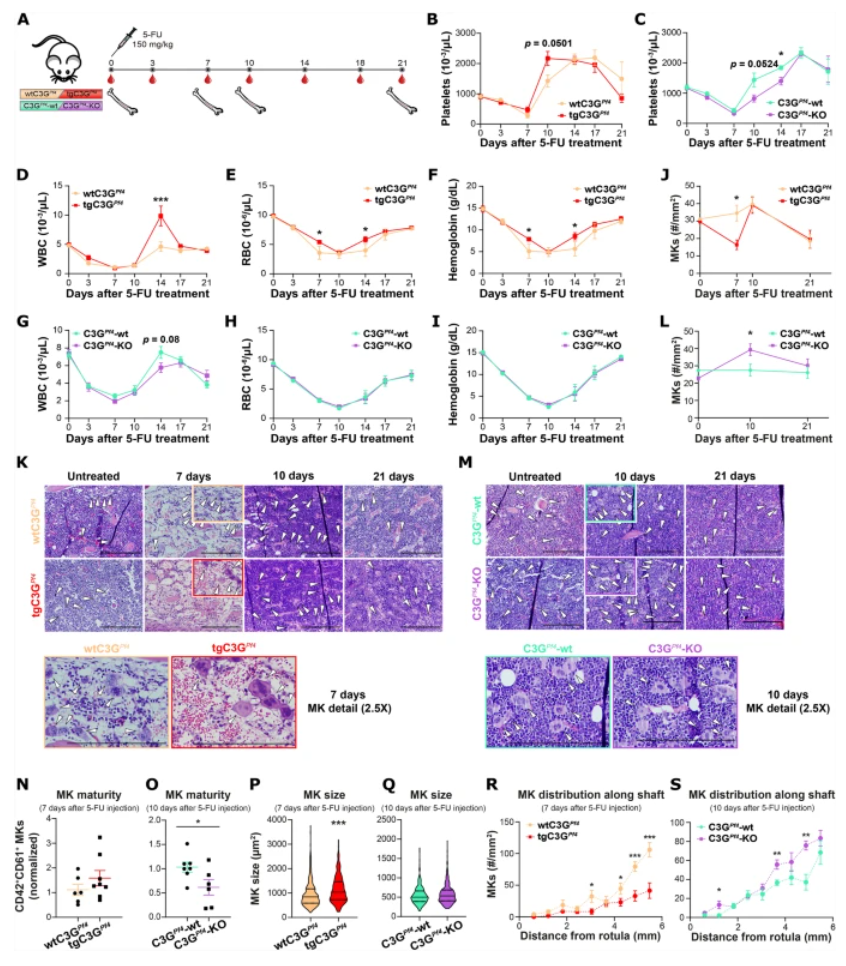
图1 巨核细胞C3G促进5-FU诱导骨髓抑制后的造血恢复(包含巨核细胞成熟与血液学参数恢复)
2. C3G驱动骨髓脂肪细胞扩张
5-FU处理中,tgC3GPf4小鼠骨髓脂肪细胞(BMA)数量显著增加,伴随脂肪细胞直径扩大,而其前体细胞(APC)数量下降,表明促进了脂肪细胞分化与成熟;C3G KO组则表现相反(见图2A-H)。骨髓液中的脂肪因子谱改变,IL-6减少(抑制脂肪细胞分化),而与炎症相关的RAGE和RANTES则在缺失组升高(见图2I)。体外3T3-L1脂肪前体细胞与TPO刺激的巨核细胞谱系HSPCs间的非接触共培养实验证实,MK来源的C3G促进脂肪细胞脂质积累和成熟(见图2J-N)。该促进作用可被非特异生长因子抑制剂suramin和FGF受体抑制剂infgratinib显著阻断,表明FGF1是C3G调控脂肪细胞分化的重要因子(见图2S-U)。
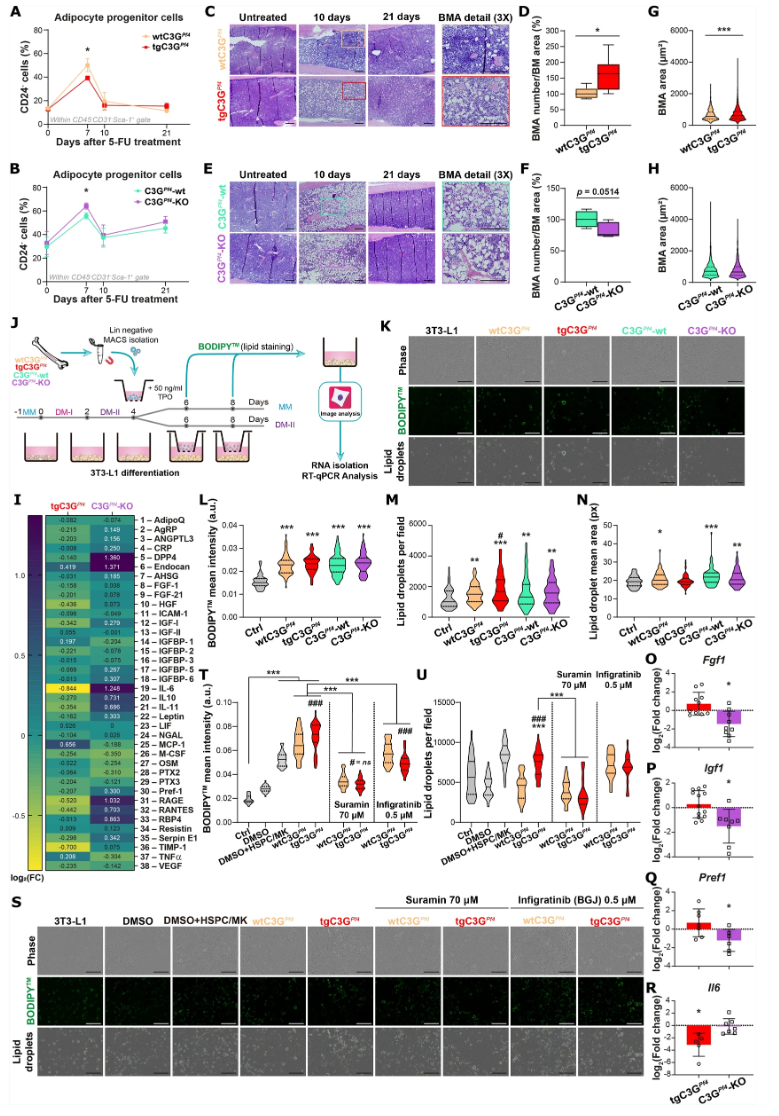
图2 巨核细胞C3G调控骨髓脂肪细胞扩张及分泌因子谱分析;体外巨核细胞-脂肪前体非接触共培养脂质滴定量结果
RT-qPCR分析揭示,C3G调节巨核细胞中Fgf1、Igf1、Pref1等脂肪分化因子的表达,同时抑制Il6表达,为脂肪细胞的分化提供分子基础(见图2O-R)。在Sipa1-KO(Rap1 GAP缺失模型)巨核细胞中观察到相反的Il6表达升高,提示Rap1信号通路负调控Il6。
3. 巨核细胞C3G调节造血干/祖细胞谱系分化及成熟细胞比例
5-FU后期(第7天),tgC3GPf4小鼠HSPCs中LKS细胞比例下降,伴随髓系祖细胞(CMP、MEP)指数改变,促进向巨核细胞-红细胞谱系分化,而淋巴系祖细胞(CLP)减少;C3G缺失则导致淋巴系祖细胞升高,LT-HSC降低,增强调向淋巴系分化阻断。Lin-细胞增殖趋势也显示C3G调节HSC动员和扩增。
成熟细胞方面,C3G表达与中性粒细胞比例变化相关,表明其调控骨髓恢复后髓系成熟细胞的比例和免疫平衡。此外,C3G缺失抑制5-FU诱导的脾脏肿大(造血外发生,EMH),反映其参与骨髓微环境支持造血。
4. C3G促进女性小鼠5-FU长期耐受
多次5-FU周期刺激下,C3G过表达显著延长女性小鼠存活时间,而缺失缩短。提示C3G通过促进巨核细胞功能和骨髓脂肪细胞支持改善长期造血恢复。
5. 巨核细胞C3G调节影响HSC静止的基因表达
C3G敲除显著降低巨核细胞中Tpo、Tgfb1及趋化因子Sdf1的表达,均为维持HSC静止及迁移关键分子,进一步揭示C3G通过调控巨核细胞功能维持骨髓造血平衡。Sipa1-KO模型支持C3G-Rap1路径负向调控IL-6等信号。
6. 骨髓移植模型证实C3G调节造血再生及巨核细胞前体动员
全身放疗结合同系骨髓移植后,tgC3GPf4小鼠表现出巨核细胞前体(CD41+)及髓系祖细胞动员增强,骨髓内移植细胞比例降低,提示本体巨核细胞及微环境对造血具有重要保护作用。C3G缺失表现出祖细胞积累但巨核细胞成熟受限,表明C3G促进骨髓微环境对造血干细胞复苏和分化的支持。
研究价值与意义
本研究首次明确揭示C3G作为骨髓巨核细胞内调节因子,在调控骨髓脂肪细胞扩张及造血微环境再生中的核心地位。通过促进巨核细胞成熟及分泌FGF1等因子,C3G驱动脂肪细胞分化与扩增,进而塑造有利于骨髓造血干细胞激活的微环境,实现造血功能的有效恢复。该过程通过调节骨髓多谱系祖细胞分化方向,促进髓系、特别是巨核细胞-红细胞血统的偏向,强化血小板、白细胞及红细胞再生。
临床视角下,C3G的这一定向作用显著改善了化疗及骨髓移植动物模型的生存概率,尤其在女性中效果明显。该发现为针对骨髓造血再生障碍的治疗策略提供了潜在靶点,尤其是在优化骨髓微环境、激活内源性造血系统及支持造血功能恢复方面具备长远临床应用价值。此外,揭示C3G介导的巨核细胞对脂肪细胞分化的促进作用,拓宽了我们对骨髓脂肪组织功能及其与造血系统互作的认识,为干预骨髓脂肪组织相关骨髓病理状态提供新思路。
未来研究可重点聚焦于C3G调节巨核细胞因子分泌的分子机制,探索其在不同骨髓损伤模型及人类疾病中的作用,同时结合细胞代谢及信号通路解析,推动C3G相关靶向药物的开发与转化。
梅斯编辑点评
梅斯编辑:本研究从转基因和敲除小鼠模型出发,系统性揭示了C3G在骨髓巨核细胞中介导脂肪细胞扩增及促进造血恢复的关键角色,填补了骨髓巨核细胞与脂肪细胞双向调控的空白。研究不仅深化了我们对骨髓微环境动态平衡的理解,还指向了C3G作为化疗及骨髓移植辅助治疗的新型分子靶点。未来可结合单细胞转录组学和空间组学,精准描绘C3G调控下骨髓多细胞群的相互作用,评估该策略在临床移植及恶性血液病治疗中的转化潜力。
原始出处:
Herranz O, Berrocal P, Sicilia-Navarro C, et al. "C3G promotes bone marrow adipocyte expansion and hematopoietic regeneration after myeloablation by enhancing megakaryocyte niche function." Journal of Hematology & Oncology. 2025;18:38.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








前往app查看评论内容
0 0 举报
前往app查看评论内容
0 0 举报
#C3G# #髓脂肪细胞#
7 举报