Adv Sci:澳门大学谢瑞瑜研究发现TET3/GATA6轴驱动胰腺导管腺癌的脂质代谢和治疗弱点
2025-06-29 iNature iNature 发表于上海
该研究发现DNA去甲基化酶TET3是胰腺导管腺癌(PDAC)中脂肪生成代谢的关键调节因子。
代谢重编程是癌症的一个标志,脂质代谢失调会导致肿瘤进展和治疗耐药性。
2025 年 6 月 26 日,澳门大学谢瑞瑜团队在Advanced Science 在线发表题为“The TET3/GATA6 Axis Drives Lipid Metabolism and Therapeutic Vulnerabilities in Pancreatic Ductal Adenocarcinoma”的研究论文。该研究发现DNA去甲基化酶TET3是胰腺导管腺癌(PDAC)中脂肪生成代谢的关键调节因子。
TET3在脂肪生成PDAC亚型中表达升高,并与患者不良预后相关。TET3的基因敲除会破坏脂质稳态,改变饱和脂肪酸与单不饱和脂肪酸的比例,并降低增殖能力。从机制上讲,TET3通过募集组蛋白去乙酰化酶(HDAC)至其启动子处,导致H3K27去乙酰化,从而抑制GATA6的表达,这与TET3的催化活性无关。 TET3 的缺失会解除 GATA6 的抑制,进而抑制脂肪生成酶,例如硬脂酰辅酶 A 去饱和酶 (SCD) 和酰基辅酶 A 合成酶长链家族成员 3 (ACSL3),并使细胞对铁死亡 (ferroptosis) 敏感。值得注意的是,HDAC 抑制剂 SAHA 和铁死亡诱导剂 Erastin 联合治疗可显著增强吉西他滨诱导的脂肪生成性胰腺癌 (PDAC) 细胞的细胞毒性。这些发现揭示了 TET3 在维持 PDAC 脂质代谢重编程方面先前未被认识的非催化功能。靶向 TET3/GATA6 轴,结合铁死亡和表观遗传调控因子,为克服侵袭性胰腺癌的治疗耐药性提供了一种有希望的策略。

胰腺导管腺癌 (PDAC) 是一种高度侵袭性的恶性肿瘤,5 年生存率约为 13%。由于发现较晚,仅有 15% 至 20% 的患者在确诊时已处于可切除阶段。以吉西他滨为基础的化疗仍然是标准治疗方案,尽管生存率略有提高。基于基因组和转录组分析,PDAC 被分为两种主要的分子亚型:基底样亚型(或鳞状亚型)和经典亚型(或祖细胞亚型)。此外,近期在整体代谢分析方面的进展已确定了三种不同的代谢表型:脂肪生成亚型、糖酵解亚型和慢增殖亚型,它们与不同的肿瘤行为和患者预后相关。脂肪生成亚型的特征是脂质代谢产物增多,对脂质生物合成抑制剂更敏感,而糖酵解亚型则富含糖酵解中间体和戊糖磷酸途径 (PPP) 的组分。另一方面,与脂肪生成亚型和糖酵解亚型相比,慢增殖亚型的氨基酸和碳水化合物水平降低,导致细胞周期延长和肿瘤生长减慢。这些代谢分类强调了代谢重编程在PDAC发病机制中的重要性,并凸显了代谢靶向治疗的潜力。
癌症中最显著的代谢改变之一是脂质代谢的重编程,它通过提供膜形成所必需的大分子、维持膜流动性和促进能量产生来支持细胞的快速生长。脂肪生成重塑在各种癌症类型中均常见,包括增强的从头脂肪生成、脂肪酸摄取和改变的胆固醇代谢。该过程中的关键酶,包括ATP柠檬酸裂解酶(ACLY)、乙酰辅酶A合成酶(ACSS)、脂肪酸合酶(FASN)和硬脂酰辅酶A去饱和酶(SCD),通常在肿瘤中上调,以满足日益增长的生物合成需求。脂肪酸,尤其是单不饱和脂肪酸 (MUFA),支持肿瘤的生长、运动和存活,而饱和脂肪酸 (SFA) 则可诱导脂毒性。SCD 催化 SFA 去饱和生成 Δ9-MUFA,例如油酸和棕榈油酸,在维持脂质稳态和调节铁死亡敏感性方面发挥着核心作用。
癌症中的代谢重编程与表观遗传改变密切相关,例如 DNA 甲基化,它会调节基因表达和染色质结构。DNA 甲基化受 DNA 甲基转移酶 (DNMT) 调控,并由双加氧酶家族中的十-十一易位 (TET) 逆转。失调的 DNA 甲基化可沉默关键代谢基因,从而破坏糖酵解、氧化磷酸化和脂质代谢等途径。例如,脂肪酸转运蛋白SLC27A6的高甲基化会降低胆固醇的摄取,并削弱鼻咽癌的转移潜能。相反,SCD启动子的低甲基化与胰腺导管腺癌(PDAC)和其他癌症(如结直肠癌和胶质母细胞瘤)中的表达升高有关。
尽管越来越多的证据表明DNA甲基化参与了癌症代谢的调控,但特定表观遗传调控因子对PDAC脂质代谢表型的影响仍不清楚。在本研究中,我们确定TET3是PDAC脂质代谢的关键调节因子。我们发现TET3在脂肪生成的PDAC肿瘤中表达丰富,并与脂质生物合成活性的升高相关。TET3的基因敲除会损害脂滴的形成,破坏饱和脂肪酸/单不饱和脂肪酸(SFA/MUFA)的平衡,并使代谢程序转向缓慢增殖的表型。从机制上讲,TET3 通过组蛋白去乙酰化抑制 GATA6 的表达,这与 GATA6 的催化双加氧酶功能无关。TET3 的缺失会增加 GATA6 的水平,从而抑制脂肪生成酶(包括 SCD 和酰基辅酶 A 合成酶长链家族成员 3 (ACSL3))的表达,从而使细胞对铁死亡诱导剂敏感。此外,HDAC 抑制剂 SAHA 和铁死亡诱导剂 Erastin 的联合治疗可增强吉西他滨对脂肪生成性 PDAC 细胞的疗效。总之,这些发现揭示了一个此前未被认识的 TET3/GATA6 轴,该轴驱动 PDAC 中的脂质代谢重编程,并表明针对该通路可能为代谢侵袭性疾病提供一种新的治疗策略。
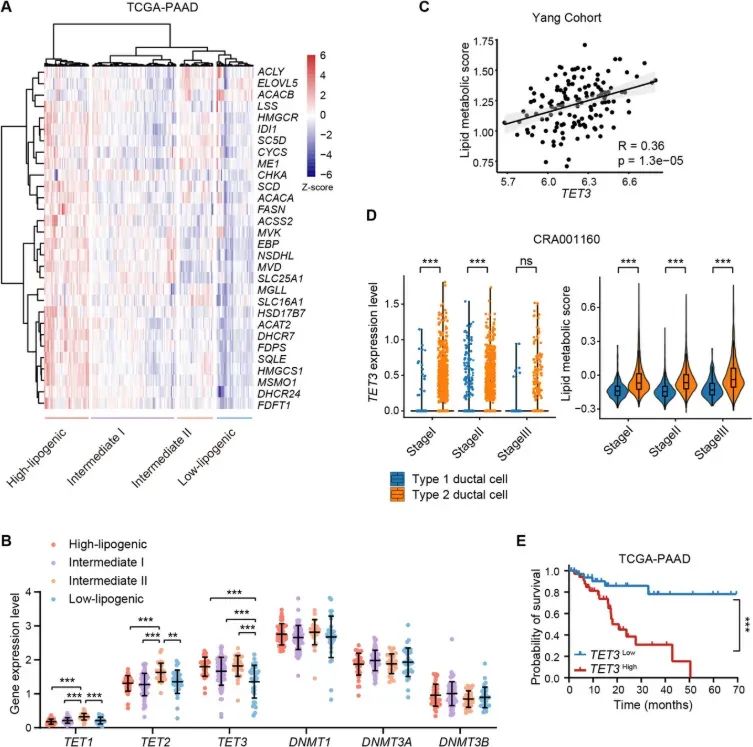
图1(图源自Advanced Science )
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202501774
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#胰腺导管腺癌# #TET3/GATA6#
6 举报