Cancer Cell:KMT2C缺失驱动前列腺癌转分化及耐药机制
2025-05-02 MedSci原创 MedSci原创 发表于陕西省
本文揭示了KMT2C缺失驱动前列腺癌从腺癌向双阴性前列腺癌(DNPC)转分化的分子机制,阐明了KMT2C通过维持ASPP2表达抑制ΔNp63依赖的转分化过程,同时指出靶向脂肪酸合成可抑制DNPC进展。
前列腺癌(Prostate Cancer, PCa)是一种常见的男性恶性肿瘤,其治疗策略之一是雄激素剥夺疗法(Androgen Deprivation Therapy, ADT)。然而,肿瘤在接受ADT后往往会复发,形成去势抵抗性前列腺癌(Castration-Resistant Prostate Cancer, CRPC)。在CRPC中,有一类特殊的肿瘤被称为双阴性前列腺癌(Double-Negative Prostate Cancer, DNPC),它们既缺乏雄激素受体(AR)的表达,也不表现出神经内分泌分化特征。DNPC的预后极差,且对AR靶向治疗产生耐药性,因此深入研究其发生机制和寻找新的治疗靶点具有重要意义。
近日,《Cancer Cell》上发表的研究揭示了组蛋白H3K4甲基转移酶KMT2C在前列腺癌中的重要作用。研究发现,KMT2C的缺失会驱动前列腺癌从腺癌向DNPC的转分化,并赋予肿瘤对AR靶向治疗的耐药性。研究团队通过多种实验手段,包括基因编辑、动物模型、单细胞测序和代谢组学分析等,阐明了KMT2C缺失导致DNPC发展的分子机制,并提出了靶向脂肪酸合成作为潜在的治疗策略。题目为“KMT2C deficiency drives transdifferentiation of double-negative prostate cancer and confer resistance to AR-targeted therapy”。

研究团队首先分析了前列腺癌患者的基因突变数据,发现KMT2C基因在CRPC中突变频率较高,尤其是在DNPC亚型中。通过CRISPR-Cas9技术敲除小鼠和人类前列腺癌类器官中的KMT2C基因,发现其缺失显著增强了对AR靶向药物恩杂鲁胺(Enzalutamide, ENZ)的耐药性。进一步的动物实验表明,KMT2C缺失的小鼠在接受ADT治疗后,肿瘤进展加速,且出现了类似人类DNPC的病理特征。
为了探究DNPC的起源,研究者利用谱系追踪技术,发现DNPC主要来源于腺泡细胞的转分化,而非基底细胞的恶性转化。单细胞RNA测序分析揭示了KMT2C缺失后肿瘤细胞的转录组变化,发现DNPC亚群表现出强烈的鳞状细胞特征和干细胞活性,同时AR信号通路相关基因表达下降。
研究还揭示了KMT2C在维持腺癌状态中的作用机制。在AR抑制后,KMT2C能够结合到AR调控基因的增强子区域,维持ASPP2基因的表达,而ASPP2的表达对于抑制ΔNp63至关重要。KMT2C缺失导致ASPP2表达下降,从而触发ΔNp63依赖的转分化过程。ΔNp63在DNPC中通过激活SREBP1c转录因子,维持脂肪酸合成,为肿瘤生长提供能量,并通过HRAS的棕榈酰化激活MAPK信号通路。
综上所述,该研究为理解DNPC的发生机制提供了新的视角,并强调了KMT2C在前列腺癌转分化中的关键作用。研究结果表明,靶向脂肪酸合成可能是治疗DNPC的有效策略。通过抑制脂肪酸合成,可以阻断HRAS的棕榈酰化,进而抑制MAPK信号通路的激活,从而抑制DNPC的生长。这一发现为开发新的治疗靶点和药物提供了理论基础,有望改善DNPC患者的预后。未来的研究可以进一步探索KMT2C在其他癌症中的作用,并验证靶向脂肪酸合成在临床治疗中的应用潜力。
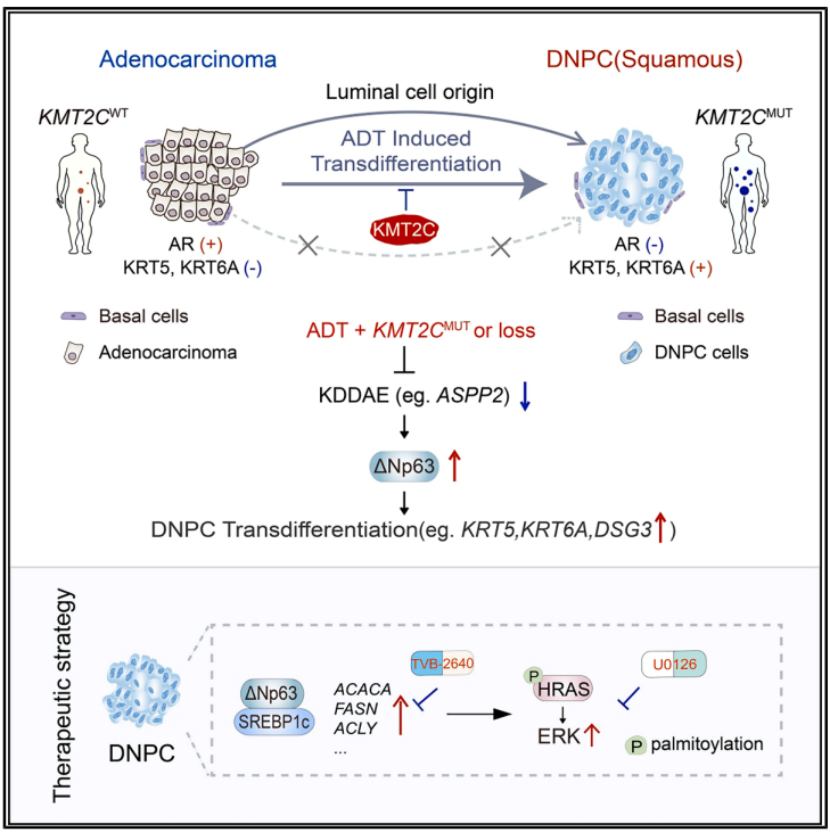
图 本研究模式图
原始出处:
KMT2C deficiency drives transdifferentiation of double-negative prostate cancer and confer resistance to AR-targeted therapy. Cancer Cell. 2025 Apr 22:S1535-6108(25)00139-4. doi: 10.1016/j.ccell.2025.04.002. Epub ahead of print. PMID: 40280125.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#前列腺癌# #耐药机制#
21