Nat Genet:桥粒突变通过影响肿瘤微环境促进黑色素瘤增殖
2025-04-25 MedSci原创 MedSci原创 发表于陕西省
该研究通过多组学分析和功能实验,揭示了桥粒突变在黑色素瘤中的重要性。研究结果强调了肿瘤微环境中非肿瘤细胞的遗传改变对肿瘤进展的影响,为黑色素瘤的治疗提供了新的潜在靶点。
黑色素瘤是一种恶性程度较高的皮肤肿瘤,其发生发展与肿瘤微环境密切相关。肿瘤微环境由多种细胞组成,其中角质形成细胞是表皮的主要细胞成分,与黑色素瘤细胞之间存在复杂的相互作用。桥粒是上皮细胞等组织中的跨膜蛋白复合体,负责细胞间的黏附。近年来研究表明,桥粒成分的改变会影响组织强度,并对细胞增殖和分化产生影响,但桥粒在癌症中的作用尚不明确。既往研究发现,桥粒在多种癌症中存在表观遗传或遗传改变,但在黑色素瘤中的突变频率和功能未被充分研究。
近日,国际权威期刊Nature Genetics上在线发表了题为“Desmosome mutations impact the tumor microenvironment to promote melanoma proliferation”的最新研究成果,该研究通过多组学分析和功能实验,揭示了桥粒突变在黑色素瘤中的重要性。研究结果强调了肿瘤微环境中非肿瘤细胞的遗传改变对肿瘤进展的影响,为黑色素瘤的治疗提供了新的潜在靶点。

研究团队从癌症基因组图谱(TCGA)数据库中收集了32种肿瘤类型的体细胞非同义突变数据,涵盖15个桥粒基因,发现皮肤黑色素瘤(SKCM)中桥粒基因突变频率最高,超过70%的肿瘤存在桥粒编码突变。通过MutSigCV等工具计算桥粒基因的突变负荷,发现桥粒基因在黑色素瘤中的突变频率显著高于其他肿瘤类型。此外,研究还分析了两个独立的黑色素瘤队列数据,证实了桥粒基因的高频突变。
研究发现,在皮肤黑色素瘤中,桥粒基因的突变频率超过70%,远高于其他类型的癌症。这表明桥粒系统可能是黑色素瘤发生发展中的关键因素。
两名人类原发性黑色素瘤患者的肿瘤活检样本进行scRNA-seq,每个肿瘤约1000个细胞。结果显示,桥粒基因主要在角质形成细胞中表达,而在黑色素瘤细胞中的表达较低。此外,对18例黑色素瘤患者的原发肿瘤活检样本进行空间转录组学和蛋白免疫荧光分析。结果显示,桥粒表达在角质形成细胞富集的区域较高,而在黑色素瘤细胞富集的区域较低。此外,与无桥粒突变的肿瘤相比,有桥粒突变的肿瘤中角质形成细胞的桥粒表达显著降低。这提示桥粒在黑色素瘤中的作用可能主要通过影响角质形成细胞来间接影响黑色素瘤的生长。
研究发现,原发性黑色素瘤中桥粒基因的突变与桥粒复合体表达的显著降低相关,且这种降低主要发生在角质形成细胞中。此外,桥粒突变的黑色素瘤表现出更高的细胞增殖基因表达水平,表明桥粒功能的丧失可能促进黑色素瘤细胞的增殖。
体外实验表明,桥粒蛋白敲低的角质形成细胞可显著增加相邻黑色素瘤细胞的增殖,且这种作用可通过条件培养基传递给黑色素瘤细胞。这表明桥粒缺失的角质形成细胞可能通过分泌因子来促进黑色素瘤的生长。
综上所述,本研究通过多组学分析和功能实验,揭示了桥粒突变在黑色素瘤中的重要性。研究结果强调了肿瘤微环境中非肿瘤细胞的遗传改变对肿瘤进展的影响,为黑色素瘤的治疗提供了新的潜在靶点。未来的研究可以进一步探索桥粒突变如何影响角质形成细胞与黑色素瘤细胞之间的信号交流,以及鉴定具体的介质分子,为开发针对性的治疗策略提供依据。
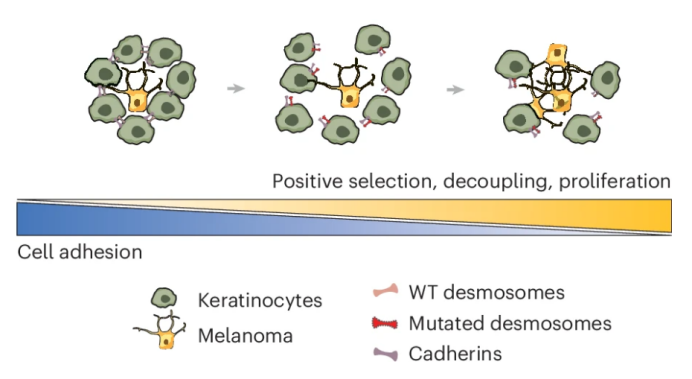
图 本研究模式图
原始出处:
Desmosome mutations impact the tumor microenvironment to promote melanoma proliferation. Nat Genet. 2025 Apr 16. doi: 10.1038/s41588-025-02163-9. Epub ahead of print. PMID: 40240879.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#黑色素瘤# #肿瘤微环境# #桥粒突变#
0