哈尔滨医科大学蔺聪聪/甘春丽团队联合四川大学高会乐团队《JCR》:智能肽纳米组装体协同增强铁死亡,破解紫杉醇耐药困局
2025-06-09 BioMed科技 BioMed科技 发表于上海
针对三阴性乳腺癌紫杉醇耐药难题,研究开发肽基纳米组装体 PTX@CPG,可靶向递送药物及光敏剂,经 MMP-2 响应释放并产生活性氧,协同激活铁死亡,下调 P-gp,有效克服耐药,具良好安全性。
化疗耐药性是当前癌症治疗面临的一个重大科学难题。以三阴性乳腺癌(TNBC)为典型代表的高度恶性肿瘤,其化疗疗效常因耐药性的产生而受到严重制约,致使患者预后显著恶化。作为一线化疗药物的紫杉醇(PTX),尽管在临床上广泛应用,但肿瘤细胞通过上调P-gp等外排泵蛋白的表达来产生逃逸药物作用的现象日趋普遍。铁死亡(Ferroptosis)这一新型细胞死亡机制的发现为克服耐药问题开辟了创新性治疗途径,然而在精准调控肿瘤组织铁死亡进程方面仍存在显著的技术挑战。
近期,哈尔滨医科大学与四川大学合作开发了一种新型肽基纳米组装体(PTX@CPG)共同递送光敏剂二氢卟吩e6(Ce6)和化疗药物PTX。该研究通过多机制协同激活铁死亡克服PTX耐药,为克服肿瘤耐药性提供了安全高效的创新性治疗策略。相关工作以“Peptide-based nanoassembly enhances ferroptosis in cancer to overcome paclitaxel resistance”为题发表在药剂学领域顶级期刊Journal of Controlled Release2025年第384期。

本研究中,PTX@CPG凭借小尺寸在肿瘤组织进行高效穿透,随后被肿瘤部位高表达的基质金属蛋白酶2(MMP-2)特异性切割,可控的释放PTX并转化为纳米纤维。形状的转化显著提升了PTX@CPG的肿瘤细胞摄取能力和滞留能力。此外,在激光照射下PTX@CPG可以产生大量活性氧(ROS),进而放大PTX诱导的铁死亡效应,此外,该纳米药物可以通过下调P-糖蛋白的表达,直接削弱肿瘤细胞的耐药防御机制(图1)。

图1. PTX@CPG 的制备及增强癌症铁死亡以克服耐药性的抗肿瘤机制示意图
研究人员成功合成了一种具有MMP-2酶响应性的两亲性载体材料CPG,并通过超声乳化的方式得到的纳米颗粒PTX@CPG,其平均粒径为83.47 nm,具有良好的稳定性和低溶血性。由于引入了可响应变形多肽片段,PTX@CPG能够在高表达MMP-2的肿瘤微环境中响应性的释放PTX,实现可控释放药物,同时成功由球形转变为纳米纤维有望增强药物在肿瘤细胞的内化和滞留(图2)。

图2. CPG及PTX@CPG的表征
随后,研究团队对PTX@CPG的细胞摄取能力和细胞毒性进行了考察。经PTX@CPG处理后的细胞荧光强度最强,表明其更容易被细胞内化。此外,构建了3D肿瘤模型以模拟在体肿瘤,PTX@CPG在120μm仍具有很强的荧光,表明其具有强渗透能力。CCK-8实验显示经激光照射后的PTX@CPG(PTX@CPG+L)表现出最强的细胞毒性。同时,钙黄绿素-AM/PI双染色结果显示,PTX@CPG+L组实现了接近100%的肿瘤细胞杀死效果(图3)。

图3. PTX@CPG的细胞摄取和细胞毒性
体外抗肿瘤机制表明,激光照射后的PTX@CPG能够通过产生大量的ROS,进而降低肿瘤细胞内GSH含量,线粒体膜电位降低,发生脂质过氧化,破坏细胞内抗氧化系统,显著增强铁死亡的发生,有效克服PTX耐药(图4)。

图4. PTX@CPG诱导铁死亡促进细胞死亡的机制
进一步的抗肿瘤机制研究显示,PTX@CPG+L还可以通过促进肿瘤细胞凋亡和抑制肿瘤细胞迁移实现抗肿瘤效果(图5)。
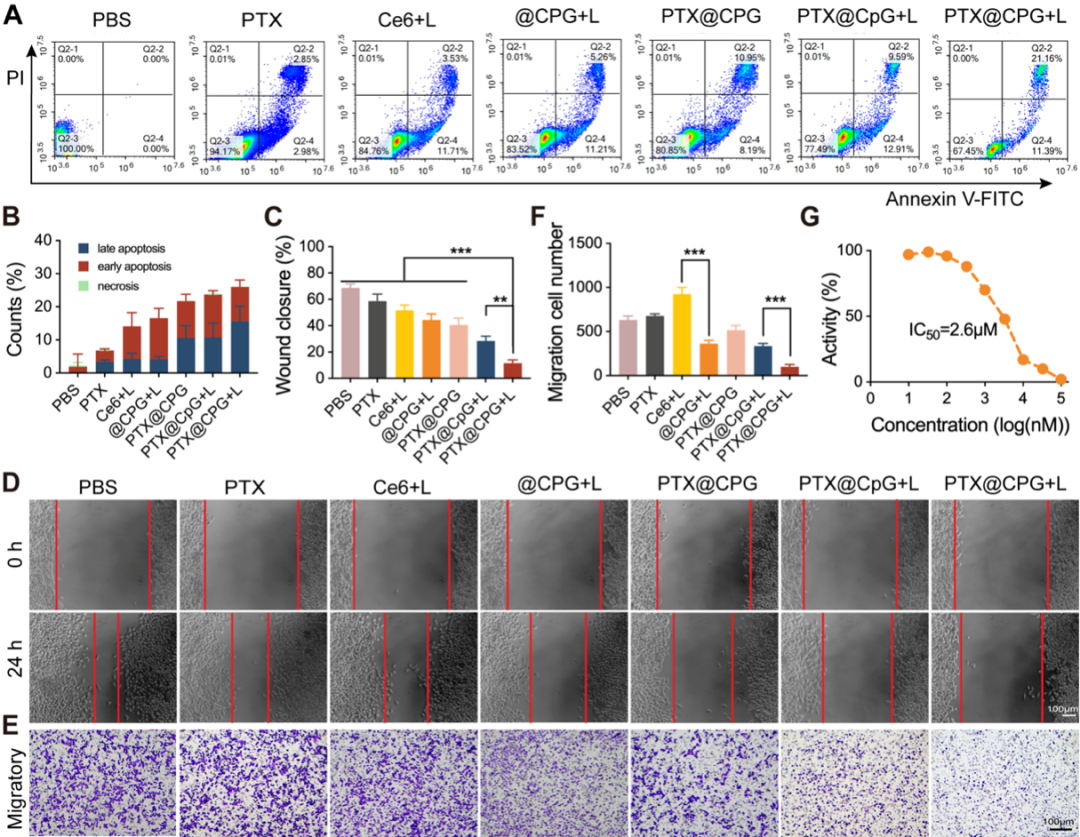
图5. 细胞凋亡和迁移抑制
小动物活体成像显示,在静脉注射36小时后PTX@CPG组仍然能在肿瘤部位检测到强烈的荧光信号,提示其具有优异的肿瘤部位特异性聚集能力。CD31染色结果证实了PTX@CPG能够成功的从血管外渗到肿瘤组织并保留。此外,通过瘤内注射的方式考察了PTX@CPG在肿瘤的滞留情况,发现PTX@CPG组表现出最慢的消除速率和最强的荧光信号。该纳米制剂在荷瘤小鼠体内具有良好的肿瘤靶向作用和肿瘤滞留能力(图6)。

图6. 体内肿瘤靶向和保留
体内抗肿瘤结果显示,PTX@CPG+L对荷瘤小鼠肿瘤生长具有显著的抑制作用。通过进一步的肿瘤组织切片染色,推断其是通过抑制肿瘤细胞增殖和促进肿瘤细胞凋亡实现出色的抗肿瘤作用(图7)。

图7. 体内抗肿瘤作用的评估
最后,在体内对克服耐药机制进行了考察,发现PTX@CPG+L可显著下调铁死亡的中心调节因子GPX4的表达,同时通过抑制P-gp表达来增强肿瘤细胞对PTX的敏感性,克服耐药问题。此外,小鼠全肺组织H&E染色结果显示PTX@CPG+L在对抗肺转移方面具有极大的潜力。同时,治疗后的小鼠脏器H&E染色和血生化指标显示,PTX@CPG具有良好的生物安全性(图8)。

图8.克服化疗耐药机制、抗肺转移效果和安全性的体内研究
综上,本研究创新性地构建了一种多模态协同作用的纳米平台,首次实现了化疗药物、光动力疗法与铁死亡激活策略协同整合,通过ROS爆发和耐药蛋白抑制的双重机制有效克服肿瘤耐药性。借助特异性响应多肽和肿瘤微环境过表达的MMP-2,成功实现了纳米制剂在肿瘤部位的智能形态转化和药物的精准释放,显著提升肿瘤靶向和滞留能力。该成果为临床突破化疗耐药困境提供了创新解决方案,尤其是对缺乏明确靶点的TNBC的治疗具有重要转化价值。在未来,通过优化光敏剂和多肽序列,该设计理念有望进一步拓展至其他耐药性恶性肿瘤的联合治疗。
哈尔滨大学药学院蔺聪聪副教授和硕士研究生孙家敏为论文共同第一作者,四川大学华西药学院高会乐教授、哈尔滨大学药学院蔺聪聪副教授和甘春丽副教授为论文共同通讯作者。本研究得到了国家自然科学基金、黑龙江省自然科学基金等多个项目的支持。
原文链接:
https://doi.org/10.1016/j.jconrel.2025.113895
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#铁死亡# #紫杉醇耐药#
11