JCR:利用纳米技术局部递送化疗药物治疗视网膜母细胞瘤
9小时前 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
WERI-Rb-1细胞膜包覆的纳米颗粒为眼内肿瘤治疗提供了一种高效且安全的新策略。本研究也推动了仿生药物递送系统在眼科疾病治疗中的发展。
视网膜母细胞瘤是一种起源于视网膜区域的恶性眼内肿瘤。通常确诊于婴幼儿时期。眼球摘除术和系统性化疗是常规治疗方案。眼球摘除术可以有效防止肿瘤细胞的潜在扩散。然而,摘除眼球会导致失明,尤其对双眼患病的患者而言影响尤为严重。系统性化疗为视网膜母细胞瘤提供了一种保守治疗方法,但其对非靶向组织的不良毒性和低效的递送效率是不可避免的问题。相比之下,局部化疗(如玻璃体内药物注射)可以避免系统毒性。然而,向玻璃体内注射的自由药物容易迅速泄漏并被清除。
近日,由香港大学 汪卫平 团队发表于 Journal of Controlled Release 题为 Intravitreal injection of cell membrane-coated nanoparticles for retinoblastoma treatment 的研究, 提出了一种简便而有效的视网膜母细胞瘤治疗策略。该团队设计了基于聚乳酸-羟基乙酸共聚物(PLGA)的聚合物纳米颗粒,并使用人视网膜母细胞瘤WERI-Rb-1细胞的质膜对其进行包覆。装载FDA批准的化疗药物依托泊苷后,这些纳米颗粒在体内单次玻璃体注射后展现出优异的抗肿瘤效果和良好的生物安全性。

作为一种公认具有良好生物相容性和可降解性的高分子材料,PLGA已被广泛用于构建药物递送的纳米载体。基于先前报道的单乳化方法,Weiping Wang团队将小分子化疗药物依托泊苷封装进PLGA纳米载体中,制备了PLGA-依托泊苷纳米颗粒(PE NPs)。WERI-Rb-1细胞膜则通过细胞收集、裂解和差速离心纯化的步骤提取得到。作为一种简便高效的方法,该团队采用超声水浴方式将WERI-Rb-1细胞膜包覆至PE NPs表面,从而获得视网膜母细胞瘤细胞膜包覆的PE NPs(RPE NPs)。
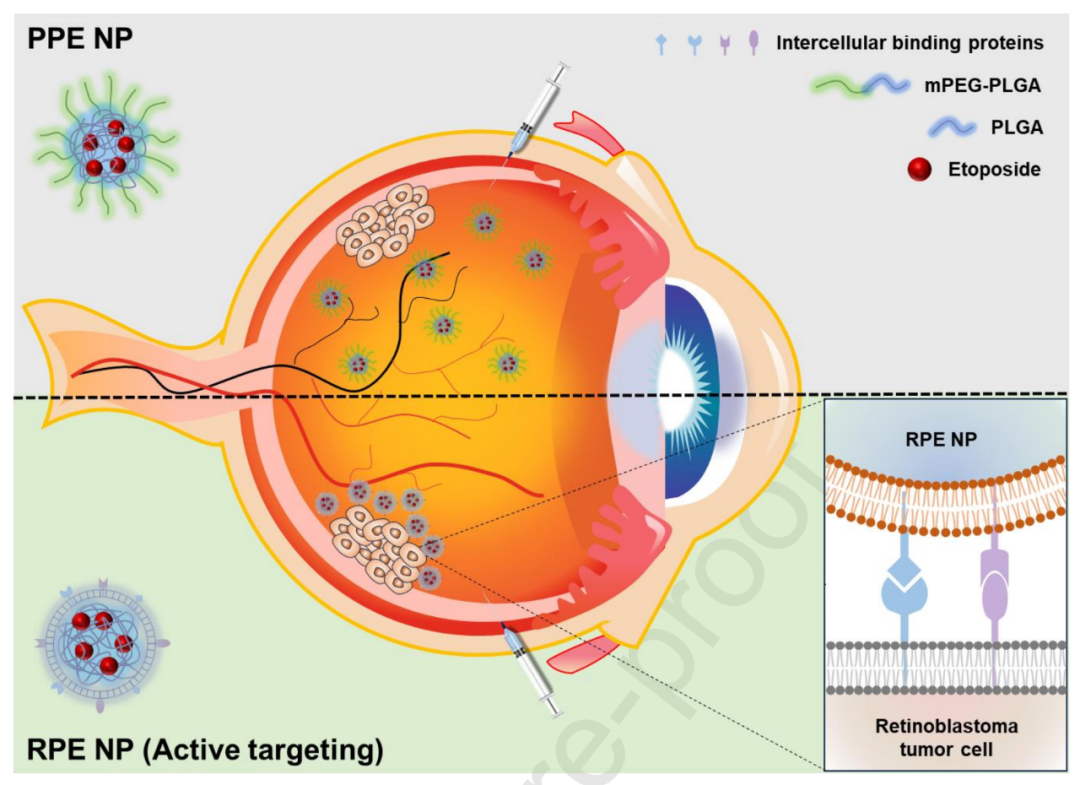
WERI-Rb-1细胞膜包覆纳米颗粒(RPE NPs)用于视网膜母细胞瘤靶向药物递送的示意图。与聚乙二醇修饰的纳米颗粒(PPE NPs)相比,RPE NPs对视网膜母细胞瘤展现出显著的靶向效应,这归因于其表面存在的细胞间结合蛋白所介导的同源性靶向作用。
为了评估体内抗肿瘤疗效,将成功接种原位视网膜母细胞瘤的Balb/c裸鼠随机分为四组,分别接受以下处理:PBS组、游离依托泊苷组、PPE NPs组和RPE NPs组。每只小鼠均通过玻璃体腔内缓慢注射2 μL相应制剂,依托泊苷的剂量为0.0269 mg/kg。在注射后11天内,每隔一天通过腹腔注射150 mg/kg D-荧光素钾盐,使用IVIS系统检测荧光信号,从而监测视网膜母细胞瘤的进展情况。在第11天,小鼠被安乐死,并采集其眼球与主要脏器,进行苏木素-伊红染色(H&E染色)分析。
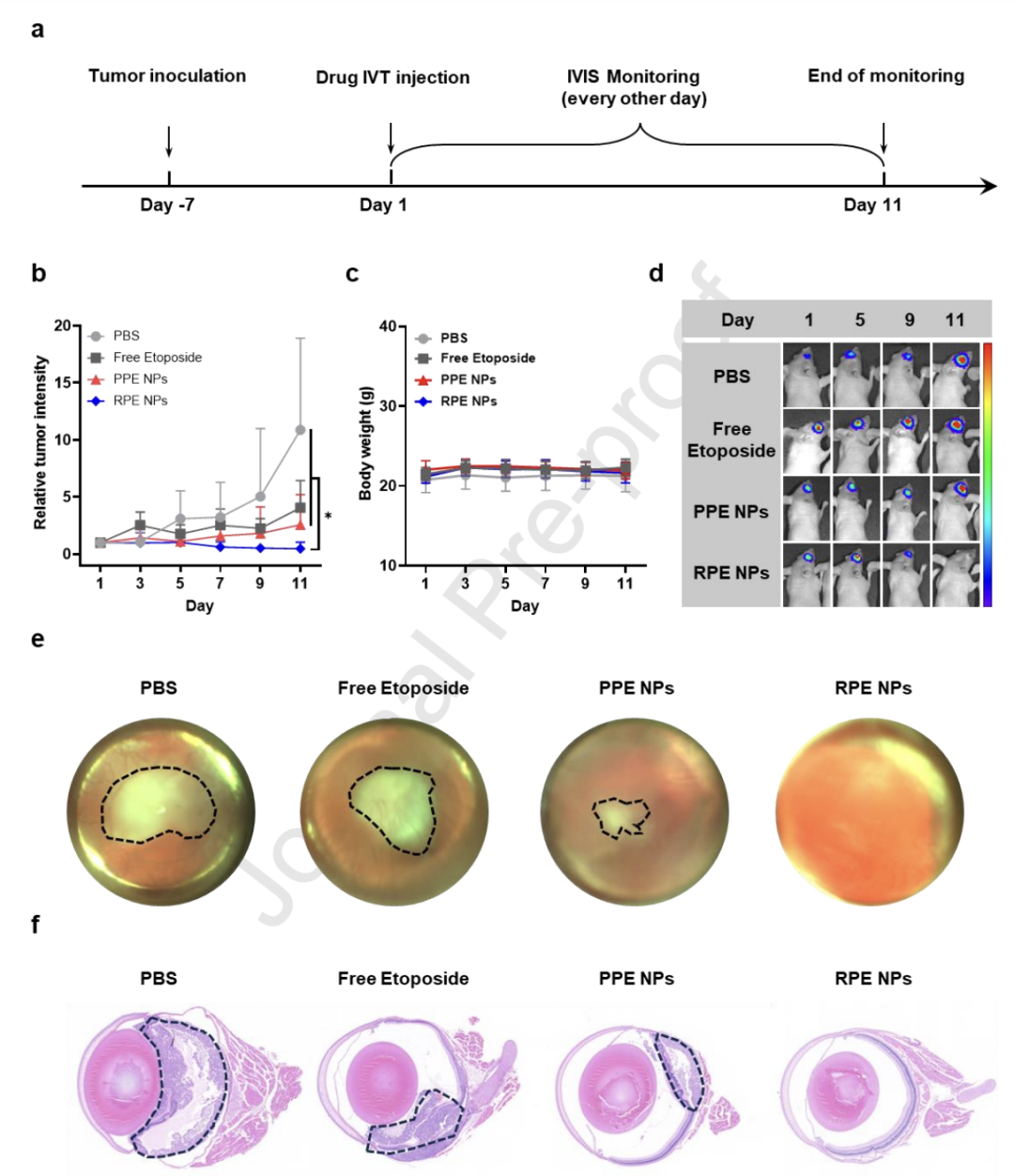
RPE NPs的体内抗肿瘤效果(a) 体内抗肿瘤实验方案图。(b) 在监测期间的肿瘤进展曲线(n=4,均值 ± 标准差)。*p < 0.05,单因素方差分析(one-way ANOVA)。(c) 接受不同处理的小鼠平均体重变化曲线(n=4)。(d) 在监测期间,视网膜母细胞瘤的代表性体内生物发光图像。(e) 监测期结束时,不同处理组小鼠眼球的代表性照片。(f) 监测期结束时,不同处理组小鼠眼球的代表性H&E染色组织切片(比例尺:500 μm)。
如上图b所示,与其他处理组(包括PBS、游离依托泊苷和PPE NPs)相比,RPE NPs组显著抑制了视网膜母细胞瘤的进展,说明其具有优异的抗肿瘤效果。如图c所示,在整个监测期间,所有小鼠的体重均保持稳定,表明RPE NPs具有良好的生物安全性。图d显示了各组小鼠在整个监测期间视网膜母细胞瘤的代表性发光图像。可以观察到,RPE NPs处理组的小鼠肿瘤发光信号显著减弱,显示出明显的肿瘤抑制作用;而其他三个对照组则表现出明显的肿瘤增长。研究人员还利用Micron IV系统拍摄了不同处理后小鼠白瞳症(leukocoria)情况,这是视网膜母细胞瘤的典型体征。代表性图像如图e所示。从图中可以看出,PBS组和游离依托泊苷组的小鼠仍明显表现出白瞳症,说明肿瘤仍在进展。而PPE NPs组的小鼠白瞳症范围有所减小,表明其对肿瘤增长有一定的抑制作用。相比之下,RPE NPs处理组小鼠的白瞳症完全消失,提示肿瘤基本被清除。通过H&E染色的眼球组织切片进一步验证了对视网膜母细胞瘤的抑制情况。如图f所示,PBS、游离依托泊苷和PPE NPs处理组的眼球中均可见明显的肿瘤区域;而RPE NPs处理组的眼球结构完整,视网膜保持健康,说明肿瘤被清除,且视网膜生物相容性良好。此外,研究人员还收集了不同处理组小鼠的主要器官,并进行了组织切片及H&E染色分析。所有器官均显示正常的生理形态,进一步说明系统性生物安全性良好。
总体而言,体内实验结果证实了WERI-Rb-1细胞膜包覆的PLGA纳米颗粒在视网膜母细胞瘤中的靶向递送效果和优异的抗肿瘤疗效。这项研究是首次将癌细胞膜包覆纳米颗粒应用于眼内肿瘤治疗。结合玻璃体腔注射这一局部给药方式,该平台实现了高效的药物递送效率。此外,该靶向递送系统所需剂量低、给药频率少,有助于减少如系统毒性等不良副作用。
这种结构设计简洁、制备工艺简单的WERI-Rb-1细胞膜包覆纳米平台具有良好的转化潜力。不过,仍有一些问题亟待解决,例如免疫相容性问题。目前已有潜在解决方案被提出,例如设计一种敲除免疫原性相关基因的“通用”细胞系。此外,尽管单剂量注射已被证实足以抑制肿瘤,但如果操作不当,可能会损伤眼内结构,导致眼内炎甚至更严重的后果。未来的研究可聚焦于开发其他剂型,如滴眼液。同时,还可以利用注射型水凝胶等工具进一步延长纳米颗粒在眼内的滞留时间,从而提高治疗效果。
综上所述,WERI-Rb-1细胞膜包覆的纳米颗粒为眼内肿瘤治疗提供了一种高效且安全的新策略。本研究也推动了仿生药物递送系统在眼科疾病治疗中的发展。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#视网膜母细胞瘤#
3 举报