Lancet Neurol | PTPN1基因缺失引发的新型自身炎症性脑病:临床与机制探索
2025-06-20 MedSci原创 MedSci原创 发表于上海
研究揭示PTPN1损失导致的Type I干扰素(IFN)信号异常升高,激活免疫通路,推动了疾病的发病机制,提供潜在的治疗靶点。
亮点总结
- 突破性发现:首次在人体中确认PTPN1(编码蛋白酪氨酸磷酸酶1B)单等位基因失活突变与一种以神经退行性变化为特征的自身炎症性脑病(autoinflammatory encephalopathy)相关,揭示了该基因在中枢神经系统免疫调控中的关键作用。
- 机制阐明:研究揭示PTPN1损失导致的Type I干扰素(IFN)信号异常升高,激活免疫通路,推动了疾病的发病机制,提供潜在的治疗靶点。
- 临床意义:患者多表现为亚急性神经功能障碍、运动和语言能力丧失,伴有脑萎缩与白质信号异常。部分患者在免疫抑制治疗下获益,提示免疫调控可成为重要干预手段。
研究背景
近年来,随着分子免疫学的不断突破,干扰素信号异常已被证实在多种神经系统疾病中扮演重要角色。Aicardi-Goutières 综合征(AGS)等经典的干扰素病(interferonopathies)为疾病机制提供线索,但仍有许多病例的遗传基础未明。本研究由英国爱丁堡和法国巴黎的多中心团队合作,针对一群表现为亚急性神经退行性变化的儿童展开,无明确遗传背景,采用大规模的无偏筛查,意外发现PTPN1基因突变与疾病密切关联。

研究目标
- 通过遗传学方法确认PTPN1突变的分子特征;
- 描述临床表现、影像特征及免疫学参数;
- 探索PTPN1在免疫调控中的分子作用机制;
- 评估免疫抑制治疗的潜在效果。
主要研究结果
1. 遗传特征与突变详情
在2013年至2023年间,识别出来自11个家庭的12名患者携带不同的PTPN1突变。这些突变包括十个新颖或非常罕见的变异(在gnomAD数据库中的频率低于1.25×10⁻⁶),大多数为终止突变(nonsense mutations)或影响剪接位点的突变。部分突变为去 novo发生,其他则遗传自无症状的父母。突变主要集中在PTPN1的催化域和调控区,影响蛋白质表达和功能。
2. 临床表现与影像特征
所有患者表现为亚急性起病(1-8岁),最初发育正常,随后迅速出现运动障碍(瘫痪、痉挛、肌张力障碍)和语言障碍。部分伴有吞咽困难、面肌麻痹等脑神经症状。影像学检查显示:
- 脑萎缩(单侧或双侧,部分早期为单侧);
- 白质信号异常(高T2信号);
- 腔隙性脑室扩大和钙化(少数病例)。
表现出高度一致性,类似的疾病表型提示该遗传变异导致的稳定性基础。
3. 免疫学与干扰素激活
所有检测的患者血清和脑脊液(CSF)中,脂酶异唑腺苷(neopterin)水平升高,反映中枢神经系统炎症状态。同时,血液中干扰素刺激基因(ISGs)表达水平显著升高(83%的检测结果异常),说明Type I干扰素信号持续升高。CSF中检测到IFN-α蛋白浓度和活性均增高,部分病例还存在细胞内的内质网内含体(tubuloreticular inclusions),是干扰素活跃的生物学标志。
在未接受治疗的患者中,免疫信号异常也存在,但部分患者在免疫抑制治疗(如高剂量糖皮质激素)下,临床表现与影像变化均显著改善。
4. 分子机制:PTPN1突变影响免疫调控
通过细胞实验发现,相关突变导致PTPN1 mRNA和PTP1B蛋白表达降低,影响其在负调控Type I IFN信号中的作用。敲除PTPN1的细胞在激活IFN信号时表现为:
- 过度磷酸化服从;
- 上调ISGs表达;
- 提高p-STAT1水平。
实验还揭示,PTPN1的功能缺失导致STING蛋白(DNA感应途径核心蛋白)稳定性增强,促进下游IFN产生和信号扩增。这些机制共同驱动了患者的慢性干扰素激活状态。
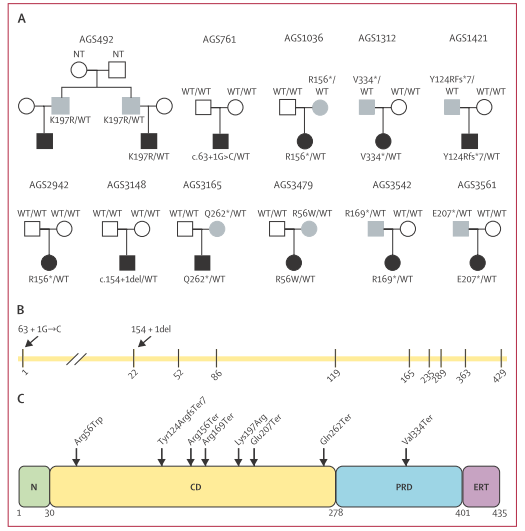
图:PTPN1突变分布示意图
研究意义与未来展望
本研究首次明确了PTPN1(蛋白酪氨酸磷酸酶1B)在人体免疫调控中的新角色——其单等位基因失活导致以中枢神经系统炎症为表现型的疾病。这一新发现丰富了干扰素病的遗传谱系,强调了负调控干扰素信号路径的关键蛋白的临床意义。尤其值得指出的是,患者展现出静态或部分恢复的潜能,这为临床提供希望——免疫调节或靶向干扰素信号可能成为未来治疗策略。
此研究还提示,干扰素信号异常不仅在经典的早发型Aicardi-Goutières综合征中存在,也可以由PTPN1等调控因子变异引起,提示“干扰素失衡”或将在多种神经免疫疾病中扮演重要角色。
未来工作应关注:
- 更大规模的患者表型研究;
- 长期随访,评估疾病的变异与亚型分化;
- 探索针对性免疫调控药物的疗效和安全性;
- 结合基因编辑和动物模型深入揭示机制。
原始出处
Zhu G, Didry-Barca B, Seabra L, et al. Autoinflammatory encephalopathy due to PTPN1 haploinsufficiency: a case series. Lancet Neurol. 2025;24(3):218-229. DOI:10.1016/S1474-4422(24)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#PTPN1基因# #自身炎症性脑病#
16 举报