Cell:酸性组织微环境可能是慢性炎症的重要肇事者
昨天 梅斯小智 MedSci原创 发表于威斯康星
炎症,是人体对抗外来病原体和损伤的重要“防线”,它能够有效维护机体健康,并清除潜在的威胁。然而,炎症反应如果失控,便可能演变成组织损伤、慢性疾病甚至癌症,成为医学研究的焦点。许
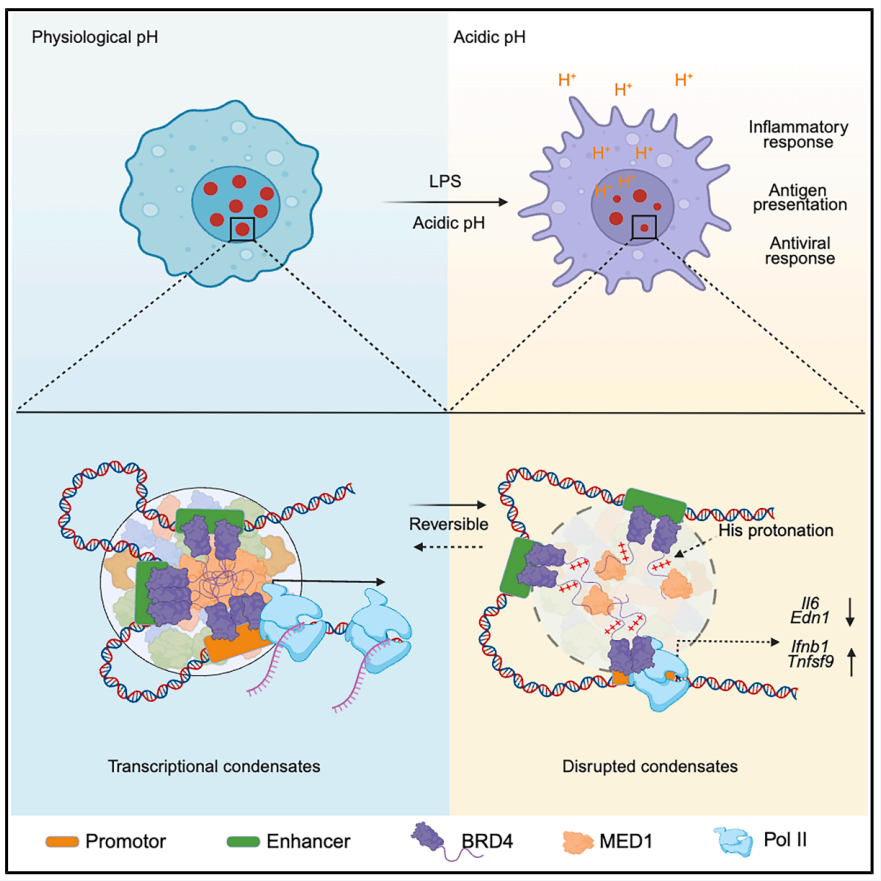
炎症,是人体对抗外来病原体和损伤的重要“防线”,它能够有效维护机体健康,并清除潜在的威胁。然而,炎症反应如果失控,便可能演变成组织损伤、慢性疾病甚至癌症,成为医学研究的焦点。许多研究集中在炎症如何影响身体各种器官及其微环境,但“组织微环境如何反过来影响炎症过程”这一问题,尤其是酸性微环境对免疫细胞功能的调节机制,仍未被充分揭示。近期,波士顿儿童医院/哈佛医学院周旭团队携手耶鲁大学Medzhitov 教授团队的一项开创性研究在Cell上发表,首次揭示了巨噬细胞内转录调控粒子BRD4凝聚体作为细胞内pH传感器的机制,为我们理解炎症和代谢的交互调控提供了新视角。 正常情况下,人类身体各组织的pH环境相对稳定。以血液为例,pH严格维持在7.35-7.45之间,任何微小偏差都可能提示疾病状态,如感染引起的代谢性酸中毒。大脑、淋巴结及肿瘤区域因局部血供不足、代谢异常等原因,也会出现不同程度的pH下降,形成酸性微环境。酸性环境不仅是病理状态的标志,也可深刻影响细胞功能和免疫反应。 细胞不仅能够“维持”其内外pH平衡,还能“感知”周围环境的pH变化。已有研究识别出细胞膜上的一系列pH感应受体,如GPR65、GPR68等,它们可以感知细胞外pH变化,调节代谢和免疫反应,比如运动时导致的肌肉疼痛、代谢调节等,但细胞内部是否存在直接的pH感知与响应机制,一直是免疫学的难点。 免疫系统中,巨噬细胞作为“前哨”,能快速识别和响应异常环境,调控基因表达,驱动炎症反应。巨噬细胞是否能通过感知细胞内pH变化,动态调节其炎症水平?这是本研究着眼的关键问题。 团队在LPS(脂多糖,细菌成分)刺激的小鼠炎症模型中检测到了巨噬细胞及其分泌物显著的酸性pH变化,约6.5,远低于正常细胞培养环境(pH7.4)。随后,体外实验通过将巨噬细胞分别置于pH 7.4与pH 6.5培养基中,预处理4小时,再用LPS刺激4小时,模拟炎症诱导的酸性局部环境,探究pH对炎症因子的影响。 结果显示不同炎症因子对酸性pH环境的反应存在显著差异: RNA-seq与线性去卷积分析共识别出1620个pH敏感差异表达基因,展示了酸性pH在基因调控上的精准调节,而非简单的泛抑制或促进。 这一结果颠覆了传统认为酸性环境“抑制炎症”的单一观点,说明组织微环境通过pH的精细调控,可能重塑免疫应答的性质和强度,具有重要的生理及病理意义。 接下来,研究组进一步探究这一pH依赖调控机制的分子基础。研究发现: 通过ATAC-seq和ChIP-seq分析(染色质开放性与组蛋白修饰),发现酸性pH仅选择性影响特定基因的染色质可及性与增强子活性,而不改变全基因组的表观遗传状态。pH抑制型基因的启动子区域H3K4me3和H3K27ac水平降低,增强子活性被抑制,这提示酸性环境可以通过影响染色质结构辅助调节转录活性。 为揭露pH信号感知的关键分子,团队参考酵母pH敏感蛋白的特征氨基酸序列,聚焦哺乳动物蛋白数据库进行筛选,最终“锁定”转录因子BRD4。 BRD4,是转录激活的重要调节因子,具备大量无序结构区(IDR),能与其它转录共激活因子如MED1、P-TEFb和RNA聚合酶II形成液-液相分离(LLPS)驱动的“转录凝聚体”。这些凝聚体对基因表达具有增强作用。 研究显示:酸性pH(6.5)会破坏BRD4凝聚体的形成,这一效应是可逆的——恢复到中性pH后,凝聚体迅速复原,基因表达亦同步恢复。进一步,约70%的pH敏感基因受BRD4调控,BRD4的IDR区域过表达能够部分“挽救”pH抑制型基因的表达。 细节方面,BRD4 IDR内含两段富含组氨酸(His)及脯氨酸(Pro)、天冬氨酸(Glu)序列(aa721-800和aa1001-1080),突变其中组氨酸为丙氨酸后,凝聚体就不再对酸性pH失稳。这是因为组氨酸的pKa约为6.0,在弱酸环境中质子化后,改变蛋白质间的相互作用,破坏液-液相分离结构。 更为有趣的是,将这一组氨酸簇模块移植到FUS蛋白的IDR区,也赋予该蛋白对pH的响应能力,说明组氨酸簇是一种可模块化的“酸性传感元件”。 这一发现首次从分子级别揭示了细胞内如何通过转录凝聚体实现pH感知,填补了长期以来细胞内pH感应机制的空白。 研究团队还发现, BRD4不仅调控炎症基因,也促进糖酵解关键酶表达。LPS刺激会增强巨噬细胞糖酵解,导致细胞内pH下降,进而抑制BRD4凝聚体。 使用BRD4抑制剂JQ1后,巨噬细胞的糖酵解明显减弱,提示BRD4通过促进糖代谢反向影响细胞内pH环境,二者共同形成一个负反馈调节环路: 这一反馈机制有效防止炎症反应过度激烈造成的组织损伤,实现炎症和代谢的动态平衡。 这项研究首次提出“转录凝聚体作为细胞内pH传感器”的概念,开辟了细胞微环境调控免疫反应的新领域。能够精准感知并响应炎症引起的局部酸性环境,细胞利用BRD4这一机制在转录层面实现动态、可逆的基因表达调控,为免疫细胞适应反复波动的病理环境提供了分子基础。 这不仅加深了我们对于炎症、糖代谢及表观遗传相互作用的理解,也为探索慢性炎症、自身免疫病和肿瘤微环境中的免疫调节提供参考。更重要的是,BRD4作为pH传感器的发现,为靶向其IDR结构和pH调控机制开发新型抗炎药物带来希望,有望推动精准治疗策略的发展。 此次周旭团队与Medzhitov教授团队合作,呈现了免疫细胞应对局部酸性环境的“惊人妙招”——通过BRD4凝聚体的动态组装实现pH敏感的转录调控。这种从微环境pH感知到基因表达精准调控的发现,既有深刻理论价值,也在临床抗炎、代谢调节领域具备巨大潜力。 几点思考: 未来研究若能抓住这些关键问题,将有助于将基础发现转化为临床诊疗新策略,引领免疫代谢调控学科的新篇章。 精益求精的科学探索正揭示着人类生命的复杂精妙,也提醒我们:任何细胞的微小环境变化,都可能写就健康与疾病的关键篇章。了解并干预这些“隐形开关”,是医学未来的必然趋势。
炎症和局部酸性环境:身体健康的“酸碱秘密”
研究设计:重塑炎症背景下的酸性环境
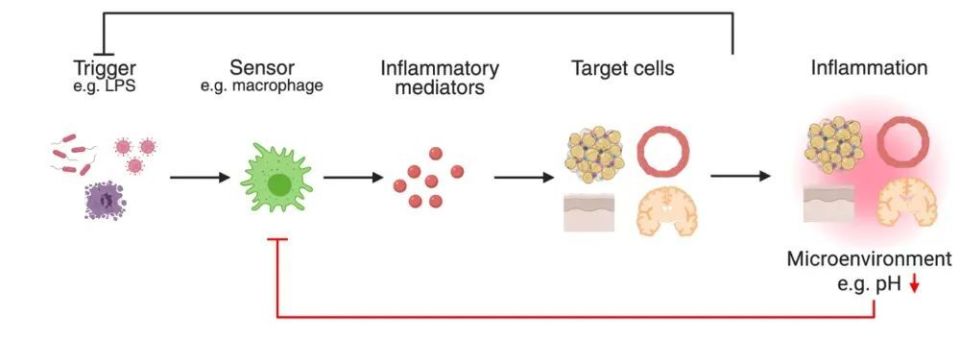
揭秘机制:酸性pH如何影响基因表达?
核心发现:BRD4凝聚体作为细胞内pH传感器
糖酵解与BRD4:炎症-代谢耦合的反馈回路
研究意义与展望
梅斯编辑点评
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















炎症,是人体对抗外来病原体和损伤的重要“防线”
25 举报
#炎症# #微环境# #酸性微环境#
25 举报