Sci Immunol:中国学者揭示CLNS1A 通过PRMT5调控CD4 T细胞周期,为自身免疫病治疗提供新靶点
2025-06-25 MedSci原创 MedSci原创 发表于上海
CLNS1A作为连接细胞增殖、DNA修复与转录调控的关键分子,其在T细胞免疫中的作用之前鲜有报道。
亮点
-
通过体内shRNA筛选,首次鉴定了氯离子核苷酸敏感通道蛋白1A(CLNS1A)作为促发病性T辅助17细胞(pTH17)功能和自身免疫的关键调控因子。
-
CLNS1A通过与蛋白精氨酸甲基转移酶5(PRMT5)相互作用,调控DNA修复、复制及细胞周期相关基因的表达,维持CD4 T细胞的基因组稳定性和增殖能力。
-
T细胞特异性敲除CLNS1A或其功能失活显著抑制实验性自身免疫脑脊髓炎(EAE)及炎症性肠病(IBD),显示其在自身免疫疾病中的潜在治疗价值。
研究概述
6月20日,中国学者在Science Immunology杂志上发表了一篇研究,系统阐述了CLNS1A在调控CD4 T细胞功能以及自身免疫病理中的新角色。研究利用前瞻性遗传筛选策略,结合CRISPR-Cas9基因编辑技术,全面揭示了CLNS1A如何通过合作PRMT5调节细胞周期和基因组稳定性,从而影响CD4 T细胞的增殖与致病能力。该研究不仅丰富了免疫细胞内离子通道及表观遗传调控的机制认知,也为自身免疫病新颖靶点的开发提供了理论基础。

研究背景
T辅助17(TH17)细胞作为CD4 T细胞亚群的重要成员,在维持粘膜屏障稳态和防御病原微生物中发挥双重作用。然而,其中的促发病性TH17细胞(pTH17)则与多发性硬化(MS)、炎症性肠病(IBD)、类风湿性关节炎及银屑病等慢性自身免疫炎症密切相关。由于对pTH17细胞生成和功能的分子机制了解有限,现有针对其的治疗策略效果局限。此类细胞的活化和扩增涉及复杂的信号转导、转录调控和离子通道功能,然而调节这些过程的具体膜蛋白及其分子机制尚不明晰。
氯离子通道及其调节蛋白是细胞离子稳态和体积调控的关键,先前研究发现ICT家族成员介导T细胞发育与功能,但系统鉴定仍缺乏。CLNS1A作为一个氯离子核苷酸敏感通道蛋白,既是小核核糖核蛋白(snRNP)生成的重要组分,也是PRMT5的伴侣蛋白,参与蛋白精氨酸对称二甲基化和表观遗传调控,在肿瘤细胞有一定研究,但其在免疫细胞中的功能和在自身免疫疾病中的作用尚未揭示。
研究方法
本研究采用了包括体内shRNA基因干扰筛选、小鼠EAE及IBD疾病模型、CRISPR-Cas9介导的基因敲除技术、细胞免疫学分析、RNA测序、ATAC-seq、CUT&RUN染色质结合分析、细胞周期及DNA损伤检测、免疫电泳、免疫共沉淀和细胞膜电流测定等多种现代分子与细胞生物学技术,系统地探讨了CLNS1A在CD4 T细胞及其亚群中的表达调控与功能机制。
研究结果
1. CLNS1A被shRNA体内筛选鉴定为调控促发病性TH17细胞的关键因子
研究者建立了覆盖223个已知或潜在离子通道及其调控蛋白的定制shRNA文库,转导Myelin特异性TCR的2D2 CD4 T细胞,随后将其移植至免疫缺陷小鼠诱导EAE。筛选结果显示,共有59个基因的shRNA导致T细胞在中枢神经系统(CNS)明显耗竭,说明其对自身免疫T细胞功能必不可少。其中,Clns1a基因表达显著上调,shRNA敲除Clns1a几乎完全消减了2D2 T细胞在CNS的积累。
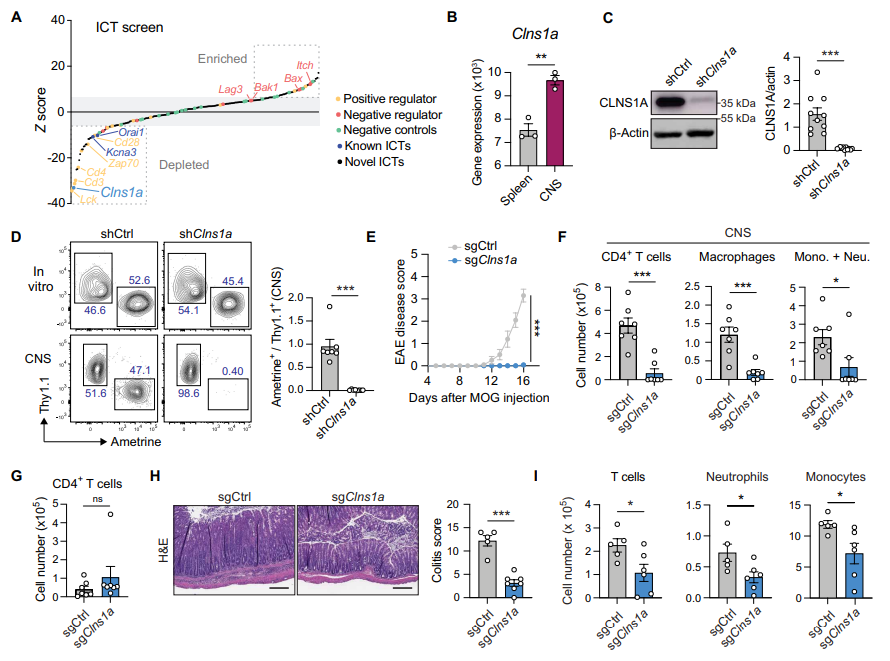
2. Clns1a基因特异性删除降低自身免疫疾病发病
利用CRISPR-Cas9和shRNA对2D2 CD4 T细胞中Clns1a进行敲除后分化为pTH17细胞,显著减轻了移植动物的EAE症状,减少了神经系统内的T细胞及炎症细胞浸润。类似地,敲除Clns1a的HH7-2 CD4 T细胞在细菌驱动的IBD模型中也表现出显著保护作用,表现为肠道炎症减轻和炎症细胞数量下降。此外,构建了Clns1a荧光素酶Fl/fl CD4-Cre小鼠,发现其T细胞发育基本正常,但外周CD4和CD8 T细胞数量减少,且EAE发病明显减轻。
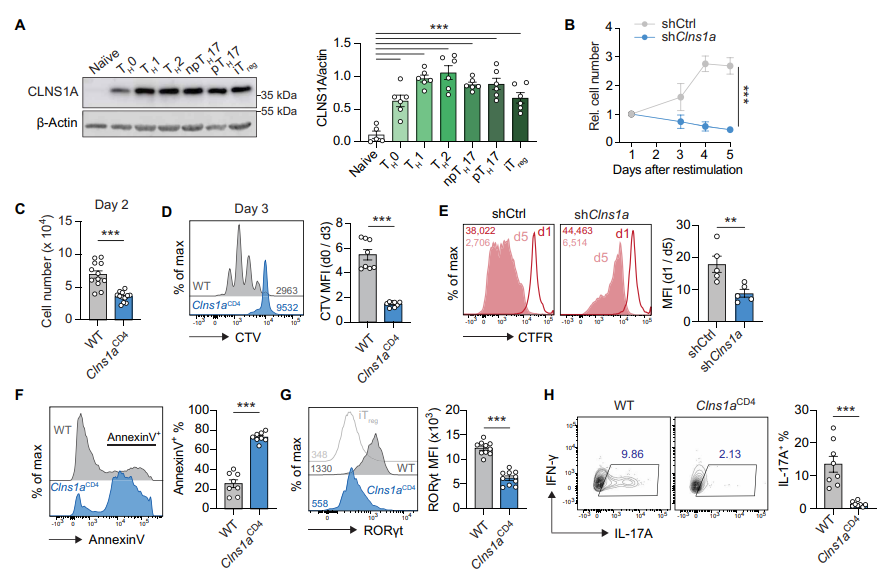
3. CLNS1A调控CD4 T细胞的增殖、生存和多向分化能力
激活状态下,CLNS1A蛋白在CD4 T细胞中大幅上调。Clns1a缺失导致pTH17及其它TH细胞亚群(TH1、TH2、npTH17、iTreg)增殖受阻,伴随细胞周期阻滞和凋亡率上升。细胞激活早期标志物CD44、CD69几乎不受影响,但重要活化受体CD25表达显著下降。体外偏向分化实验显示,CLNS1A缺失细胞的RORγt、IL-17A、T-bet、IFN-γ、GATA3、IL-13及FOXP3表达均降低。体内流感感染模型显示Clns1a缺失的CD4 T细胞TFH和GC B细胞响应受到抑制。
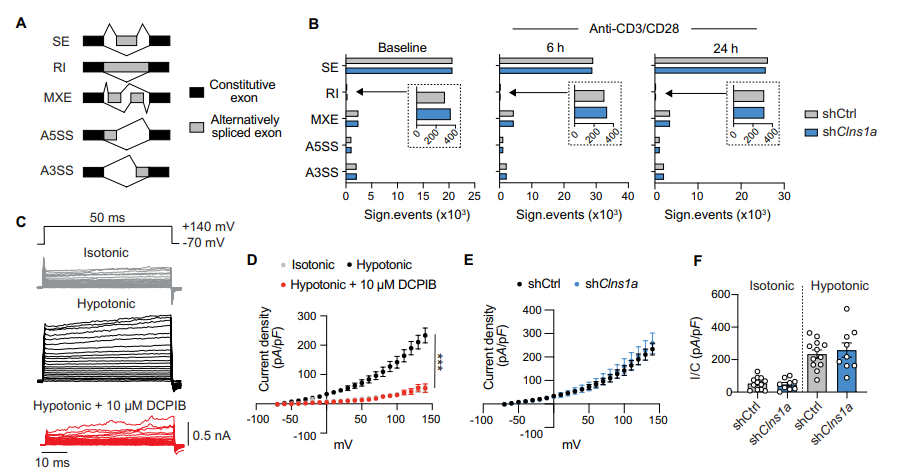
4. CLNS1A不影响预mRNA剪接或体积调节阴离子通道(VRAC)功能
考虑到CLNS1A在snRNP组装中的已知作用,研究检测了Sm蛋白、snRNA水平以及利用rMATS分析了剪接可变性,结果未见显著差异。电生理检测表明,Clns1a缺失并不影响CD4 T细胞VRAC电流特性,且CLNS1A蛋白主要分布于细胞核,而非质膜,暗示CLNS1A的主要作用非在膜电导调节。
5. CLNS1A调控参与DNA修复、复制及细胞周期的基因表达
RNA-seq检测Clns1a敲除pTH17细胞重新激活后mRNA表达,发现差异基因数量随激活时间延长大幅增加,包括大量DNA修复、复制及细胞周期相关基因显著下调,TH17细胞特异表达基因簇也下降。上游转录因子分析显示细胞周期正调控因子(E2F、MYC等)活性显著减弱,而p53及CDKN2A等负调控因子上升。敲除p53无法逆转Clns1a敲除引起的增殖障碍,表明CLNS1A调控网络复杂。
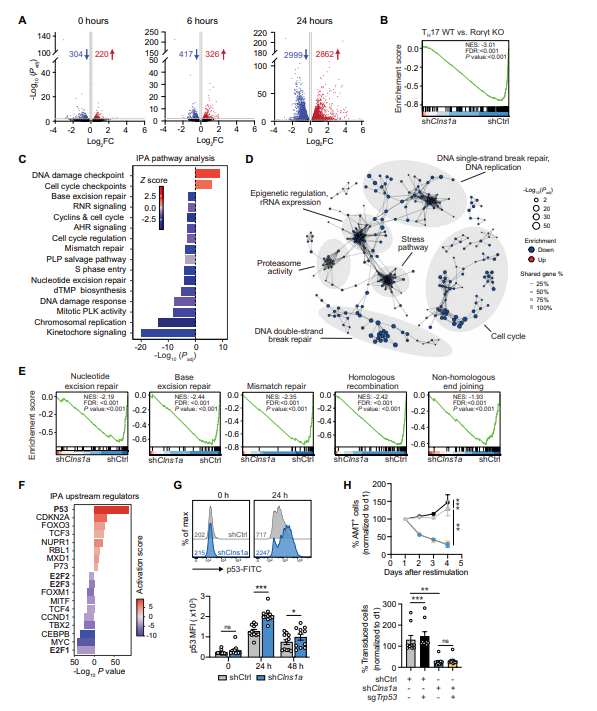
6. 缺失CLNS1A导致细胞周期停滞和DNA修复障碍
CLNS1A缺失细胞中,Ki67阳性细胞(增殖标志)显著减少,细胞周期停滞于G0-G1期,S期细胞比例下降。通过彗星实验检测DNA双链断裂修复,Clns1a敲除细胞修复能力受损,γH2AX检测显示DNA损伤累积,支持CLNS1A在维持基因组稳定性中的关键作用。
7. CLNS1A通过与PRMT5相互作用发挥功能
CLNS1A与PRMT5相结合介导组蛋白对称二甲基化。PRMT5在激活CD4 T细胞中高表达, pharmacologic抑制其活性或遗传敲减均导致TH17细胞功能障碍和EAE减轻,效应极似CLNS1A。CLNS1A的C端PRMT5结合区域删除突变失去与PRMT5相互作用能力,且不能恢复Clns1a缺失T细胞的增殖缺陷,也不能诱导EAE发病,证明两者相互依赖。
8. CLNS1A与PRMT5在细胞核共定位,结合于调控DNA修复和细胞周期基因的启动子
细胞分馏和免疫共沉淀表明CLNS1A-PRMT5复合体存在于染色质中。两者缺失均显著降低组蛋白H4R3对称二甲基化水平(H4R3me2s)。ATAC-seq显示Clns1a缺失未致广泛染色质开放性改变,提示其作用不通过改变染色质可接近性。CUT&RUN实验发现CLNS1A和PRMT5结合位点主要位于基因启动子区域,特别是DNA修复、复制及细胞周期相关基因,如Ung、Bard1和Lig1。
研究价值与意义
本研究开创性地揭示了离子通道调控蛋白CLNS1A在CD4 T细胞免疫调节中的核心功能,解答了其传统认识中作为电离子通道调节因子和mRNA剪接组装介质外的未知表观遗传功能。CLNS1A通过与PRMT5的协同作用,确保T细胞快速增殖过程中基因组稳定性和细胞周期正常进行,进而支持T细胞在炎症和自身免疫中的致病作用。
鉴于CLNS1A在MS及IBD等自身免疫疾病小鼠模型中的关键致病作用,其在人类免疫细胞中高表达表明了高度的临床相关性。值得注意的是,现有针对PRMT5的抑制剂正在多种癌症临床试验中,可为靶向CLNS1A-PRMT5复合物提供潜在转化治疗路径。未来,通过阻断CLNS1A-PRMT5相互作用或直接抑制CLNS1A功能,有望开发出新的免疫调节剂,既增强治疗自身免疫病的效果,也降低免疫治疗副作用。
梅斯编辑点评
CLNS1A作为连接细胞增殖、DNA修复与转录调控的关键分子,其在T细胞免疫中的作用之前鲜有报道。本文系统揭示CLNS1A通过核内复合物形式参与基因调控,为理解T细胞功能和自身免疫的分子机制提供了突破口。随着肿瘤免疫和自身免疫治疗的快速发展,探索细胞周期及基因组稳定性调控新靶点极具意义。后续研究可以进一步聚焦CLNS1A在不同T细胞亚群、不同炎症微环境及人类疾病中的表达谱与功能,并开发专一性靶向剂,考察其临床潜力。此外,是否存在CLNS1A在调节免疫耐受和慢性炎症中的双向作用,也是未来值得探讨的问题。
原始出处
Wang L, Noyer L, Jishage M, Wang Y-H, Tao AY, McDermott M, et al. CLNS1A regulates genome stability and cell cycle progression to control CD4 T cell function and autoimmunity. Sci Immunol. 2025 Jun 20;10(eadq8860).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#自身免疫病# #CD4 T 细胞#
13 举报