JACI:Spesolimab治疗广泛性脓疱性银屑病的分子途径和作用。
2021-12-24 医路坦克 MedSci原创
GPP和PPP都有与IL-36、TH17、中性粒细胞和角质形成细胞驱动的炎症相关的关键的失调通路。用spesolimab阻断IL-36R可使GPP患者的这些基因迅速正常化/下调,并有相应的临床改善。

脓疱型银屑病包括一系列严重的慢性或复发性炎症性皮肤病,伴有反复或持续的疼痛的中性粒细胞不育脓疱。脓疱型银屑病患者可以表现出不同的临床表型,包括泛发性脓疱型银屑病(GPP)和掌跖脓疱病(PPP)。GPP是一种罕见的疾病,其特征是肉眼可见的脓疱广泛发作。GPP和PPP的临床、病理和遗传学特征使其与斑块型银屑病区别开来。
GPP的几项研究已经报道了IL-36在皮损中的过度表达和IL-36R拮抗剂(IL36RN)编码基因的功能丧失突变,以及其他与IL-36途径有功能联系的基因的突变,其中包括CARD14,APS1S3和SERPINA3,IL36RN突变改变了IL-36R拮抗剂的正常功能,致IL-36R拮抗剂的抑制减少。研究还描述了免疫细胞功能和GPP发病机制之间的相互作用,其中髓过氧化物酶突变导致髓过氧化物酶缺陷的中性粒细胞导致IL-36a、IL-36b和IL-36b前体的活化酶增加。IL36RN突变已报道在10%到82%的GPP患者中发生了突变,虽然家族性病例通常与IL36RN纯合突变相关,但散发性病例更可能与复合杂合突变相关。此外,一项调查不同IL36RN突变对IL-36Ra蛋白表达和调节功能的影响的研究表明,零突变倾向于优先与GPP相关,而亚型突变在GPP和PPP中都被发现。
IL-36轴在GPP中的关键作用的研究进一步支持了IL-17A、IL-23、肿瘤坏死因子(TNF)、IL-1、IL-36和1型干扰素在GPP病变发病机制中的重要作用。在上调的基因中,IL-1和IL-36相关的转录本占主导地位。此外,中性粒细胞近端的角质形成细胞强烈表达IL-36a和IL-36gin
IL-36参与PPP免疫发病机制的证据尚不清楚;通常,PPP患者IL-36RN突变的发生率低于GPP。但是,与正常肢端皮肤相比,PPP中IL-17、b-防御素4、Lipocalin-2和IL-36g的表达增加,与GPP相似,PPP也受先天免疫系统支配,表现为与之相关的基因和蛋白表达增加。
总体而言,证据表明,阻断IL-36R信号通路对GPP或PPP患者是一种有吸引力的靶向治疗方法。此前,在一项概念验证阶段的多中心、单臂、开放标记研究(临床试验:NCT02978690)中,单次静脉注射10毫克/公斤的人源化抗IL-36R单抗(BI 655130)阻断IL-36R信号显示,出现GPP红肿的患者皮肤和脓疱迅速清除。然而,推动GPP或PPP发病的炎症回路和细胞相互作用推动了GPP或PPP的发病机制。为了研究这一点,我们检测了GPP和PPP患者皮肤活检组织的分子图谱,并与健康志愿者进行了比较。此外,参与上述临床试验的GPP患者在接受spesolimab治疗后,血液和皮肤中分子、组织病理学和蛋白表达谱的变化也被检测并在此报道。
治疗前和治疗后的皮肤和血液样本来自参加了一项单一的I期研究(N57)的GPP患者。PPP患者(n58例)和健康志愿者(n516例)的皮肤活检标本在基线时进行了比较。生物标记物通过RNA测序、组织病理学和免疫组织化学进行评估。
在GPP和PPP病变中,通常有1287个转录本上调或下调。IL-36信号通路的部分转录本在未经治疗的GPP和PPP病变中上调。在GPP患者中,Spesolimab早在第1周就下调了GPP、IL-36途径相关信号、TH1/TH17和先天炎症信号、中性粒细胞介质和角质形成细胞驱动的炎症途径。Spesolimab还降低了GPP患者皮损中相关的血清标志物和细胞群,包括CD31+、CD11c+、IL-36g细胞和Lipocalin-2表达细胞。在GPP患者中,Spesolimab还下调了GPP患者皮损中CD31T、CD11c1、IL-36g1细胞和Lipocalin-2表达细胞的水平。
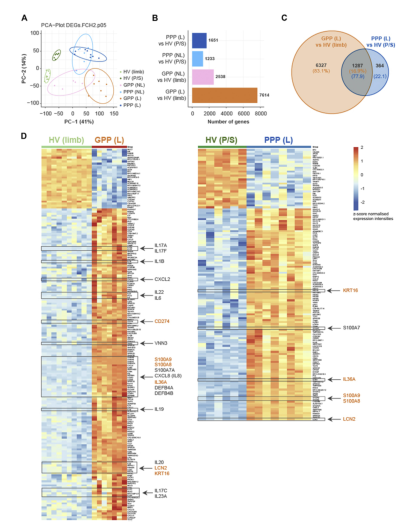
图1.基线下GPP和PPP损伤的不同转录变化。A,基于DEGS的PCA图显示健康皮肤与GPP和PPP皮肤,厚皮肤与薄皮肤。样本来自人类四肢(N510)和手掌/脚掌(N56),GPP皮损(N57)和非皮损(N57)肢体/躯干,PPP皮损(N58)和非皮损(N56)手掌/脚掌(N57)。B,基线时GPP、PPP和HVs皮损和非皮损皮肤活检的转录变化(调整后P<0.01,绝对褶皱变化>2)。右图:PPP患者皮损皮肤与HV手掌、足底皮肤样本之间的热图(绝对折叠率变化>16,调整后P<0.01),PPP患者皮损皮肤与HV手掌/足底皮肤样本之间的热图(绝对值变化>16,调整后P<0.01)。FCH,褶皱变化;HV,健康志愿者;L,皮损;NL,非皮损;PC,主成分;PCA,主成分分析;P/S,手掌和足底。
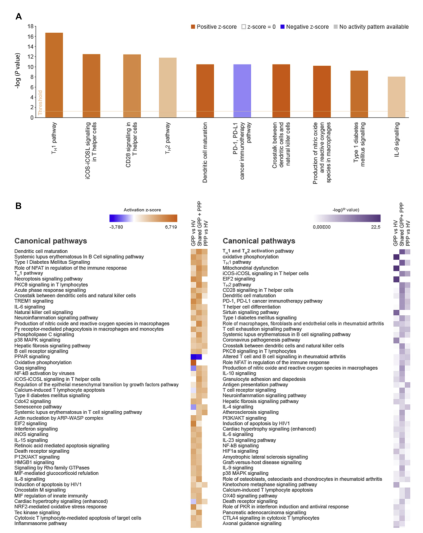
图2 A、GPP/PPP的IPA与HVs.B、激活度得分(左)、P值(右)、HV、健康志愿者;IPA、独创性路径分析;A、GPP/PPP的IPA与HVs.B、激活分数(左)、P值(右)、HV、健康志愿者;IPA、独创性路径分析。
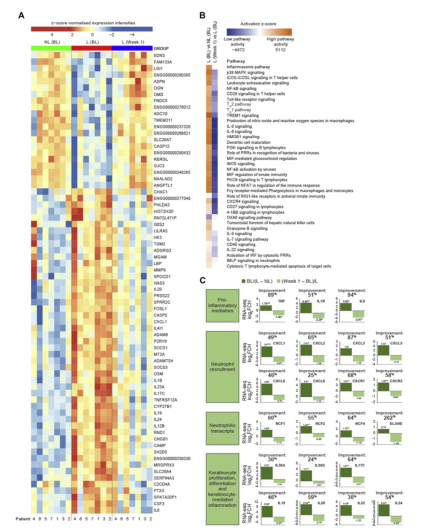
图3.SPESOLIMAB.A治疗后GPP皮损的DEG图,皮损和非皮损皮肤在基础状态下解除调节的71度的热图,以及SPESOLIMAB治疗1周后皮损皮肤与皮损皮肤相比(绝对log2倍变化>2,调整后P<0.05)。B,Spesolimab治疗1周后逆转过度激活的通路。皮损皮肤与非皮损皮肤在基线和治疗后1周的DEG的独创性路径分析。C,皮损皮肤中具有代表性的途径/过程标志物基因的改善百分比,从BL(深绿色)到第1周(浅绿色),描绘为log2FCH。(3)皮损皮肤中有代表性的途径/过程标志物基因从BL(深绿色)到第1周(浅绿色)的改善百分比,如log2FCH所示。(*P<_.05,**P<_.005,*P<_.0005)。改善百分比5(12bl周)BL.BL皮损样本/非皮损2 BL.BL,基线;FCH,褶皱改变;L,皮损;NL,非皮损。
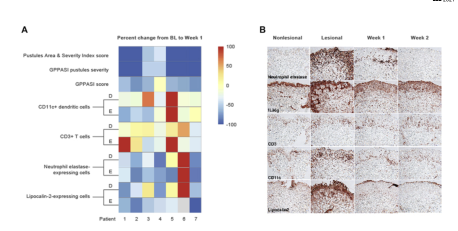
图4.GPP皮损使用spesolimab治疗后免疫组织化学生物标志物评分的变化。A,Spesolimab治疗后每名患者从基线到第一周的临床评分和免疫组织化学生物标志物变化热图。红血球表示与基线的百分比变化大于或等于100;灰色血细胞表示缺失值。B,GPP皮损中中性粒细胞弹性蛋白酶、IL-36g、CD3、CD11c和Lipocalin-2在Spesolimab治疗前(基线)和治疗后(1周和4周)表达的变化。(2)GPP皮损中中性粒细胞弹性蛋白酶、IL-36g、CD3、CD11c和Lipocalin-2表达的变化。有代表性的组织病理学显示:BL,基线;D,真皮;E,表皮;GPPASI,泛发性脓疱型银屑病面积和严重程度指数。
基于这些生物标记物的结果,我们发现GPP和PPP都有与IL-36、TH17、中性粒细胞和角质形成细胞驱动的炎症相关的关键的失调通路。此外,用spesolimab阻断IL-36R可使GPP患者的这些基因迅速正常化/下调,并有相应的临床改善。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#mAb#
105 举报
#PE#
84 举报
#ESO#
104 举报