Nature:癌细胞的“特洛伊木马”:浙大团队揭示肿瘤免疫逃逸的机制
2025-03-12 医悦汇 医悦汇 发表于陕西省
近期,浙江大学医学院许大千博士团队发表的研究成果揭示了肿瘤免疫逃逸的机制,为开发新型免疫治疗策略带来了曙光。
编者按:在癌症与免疫系统的“战争”中,癌细胞的“伪装术”一直是科学家们的研究重点。近期,浙江大学医学院许大千博士团队发表的研究成果揭示了肿瘤免疫逃逸的机制,为开发新型免疫治疗策略带来了曙光。
在癌症的战场上,免疫系统本应是人体的“守护者”,但狡猾的癌细胞却能劫持免疫系统的武器,从而躲避攻击。2025年3月3日,浙江大学医学院许大千博士团队在《Nature Cell Biology》上发表的研究成果揭示了一个惊人的机制:癌细胞通过一种名为腺苷酸琥珀酸裂解酶(ADSL)的代谢酶,劫持了cGAS-STING免疫通路,从而实现免疫逃逸。

癌细胞的“劫持”机制:ADSL与富马酸的作用
cGAS-STING通路是天然免疫系统的核心机制之一。当细胞质中出现异常的双链DNA时,cGAS会识别这些DNA并生成第二信使cGAMP,后者激活STING,进而启动I型干扰素的分泌、免疫细胞浸润和抗原呈递,从而引发抗肿瘤免疫反应。然而,在一些高侵袭性肿瘤中,这一通路却常常被癌细胞抑制。
许大千博士团队发现,在缺氧的肿瘤微环境中,乳腺癌细胞会高表达ADSL。缺氧激活的IKKβ激酶会使ADSL的T350位点发生磷酸化,磷酸化的ADSL随后转移到内质网,并与STING发生相互作用。更重要的是,ADSL代谢生成的富马酸会直接与STING结合,这种结合会抑制cGAMP与STING的结合,从而阻断STING的激活。
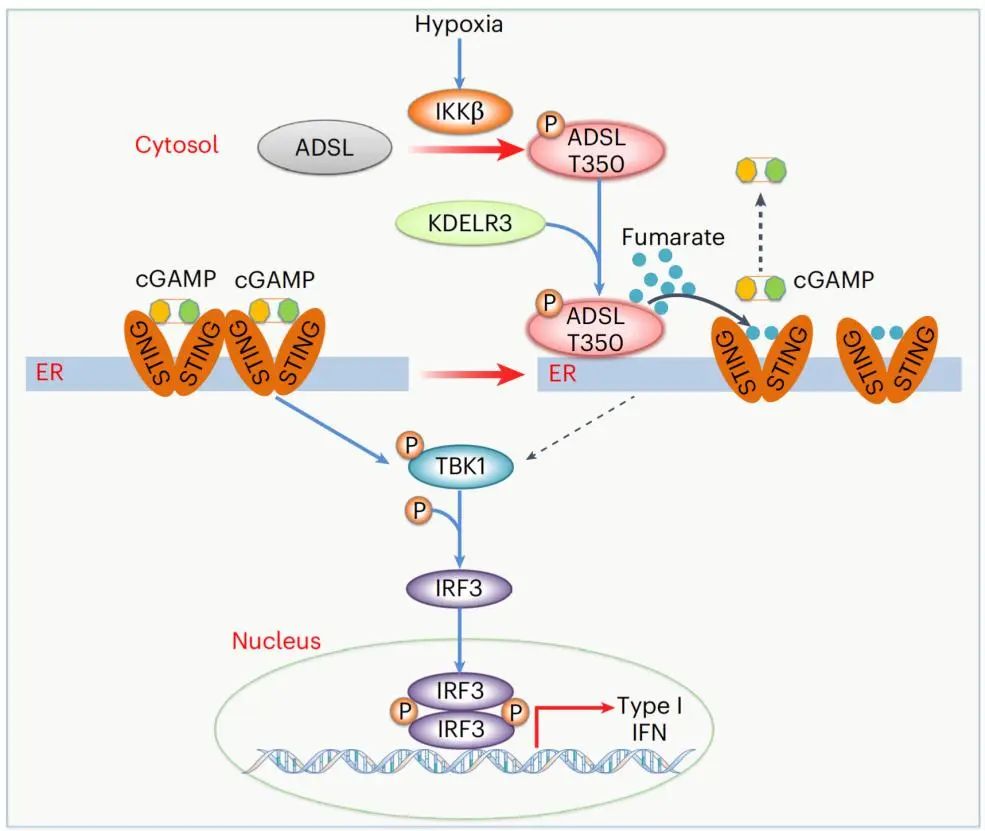
研究还发现,ADSL的代谢产物富马酸在内质网局部的浓度可高达cGAMP的3000倍,这种巨大的浓度差异使得富马酸在与STING的结合中占据绝对优势,从而完全抑制了cGAMP的作用。这种“不公平竞争”机制使得癌细胞能够成功“劫持”cGAS-STING通路,逃避免疫系统的监视。
打破癌细胞的“伪装术”:阻断ADSL与STING的相互作用
既然ADSL是癌细胞劫持cGAS-STING通路的关键,那么阻断ADSL与STING的相互作用就成为恢复免疫反应的潜在策略。研究团队设计了一种“内质网阻断肽”,成功切断了ADSL对STING通路的调控,从而显著增强了抗肿瘤免疫反应。此外,这种阻断肽与现有的PD-1抑制剂联合使用时,能够进一步抑制肿瘤生长,显示出显著的协同治疗效果。
这项研究不仅揭示了肿瘤细胞通过代谢重塑抑制天然免疫的新机制,还为开发新型免疫治疗策略提供了重要线索。通过靶向ADSL在代谢之外的其他功能,有望改善现有免疫检查点疗法的效果。未来,基于这一机制的药物开发可能会为癌症治疗带来新的突破,帮助免疫系统重新找回对抗癌细胞的“警报器”,从而更有效地消灭肿瘤。
在与癌症的这场“战役”中,癌细胞的“伪装术”固然狡猾,但科学家们正不断努力破解它们的诡计。每一次对癌细胞机制的深入了解,都为战胜癌症带来了新的曙光。
参考文献:
Duan Y, Hu Z, Han P, et al. ADSL-generated fumarate binds and inhibits STING to promote tumour immune evasion[J]. Nature Cell Biology, 2025: 1-15.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#ADSL#在癌症与免疫系统的“战争”中,癌细胞的“伪装术”一直是科学家们的研究重点。
28 举报
#肿瘤免疫逃逸# #ADSL#
19 举报