骨髓纤维化和MDS相关贫血的发病机制和治疗
19小时前 聊聊血液 聊聊血液 发表于上海
骨髓增生异常综合征(MDS)和原发性骨髓纤维化(PMF)常伴贫血,影响生存质量。其机制复杂,现有治疗包括传统药物与新疗法,联合治疗正研。
贫血是骨髓增生异常综合征(MDS)和原发性骨髓纤维化(PMF)的常见临床表现,会降低患者的生活质量和生存率,当前贫血管理的挑战在于针对骨髓纤维化(MF)和MDS相关贫血的批准药物有限。世界卫生组织(WHO)目前将女性血红蛋白(Hgb)<12.0 g/dL、男性<13.0 g/dL定义为贫血,而在MDS和PMF的风险评分系统中,Hgb<10 g/dL视为风险因素。
在MDS中,男性Hgb<9 g/dL、女性<8 g/dL或输血依赖性贫血(TDA)与生存期缩短独立相关。在PMF中,轻度贫血(Hgb≥10 g/dL但低于性别调整后的正常下限)在男性中预测生存期缩短,而严重贫血(Hgb<8 g/dL或TDA)与死亡风险增加1.5倍相关。
发病机制
髓系肿瘤中贫血的病理生理学是多方面且复杂的。影响因素包括无效红细胞生成、晚期红细胞前体的凋亡、促炎细胞因子的升高以及铁调素的增加,后者导致功能性铁缺乏和铁限制性红细胞生成。其他因素包括由于不适当的促红细胞生成素(Epo)水平或对Epo的低反应性导致的红细胞生成受损以及外周溶血。此外,在MF中,脾肿大伴脾功能亢进以及使用Janus激酶-信号转导和转录激活因子(JAK-STAT)抑制剂芦可替尼和fedratinib会加重贫血。
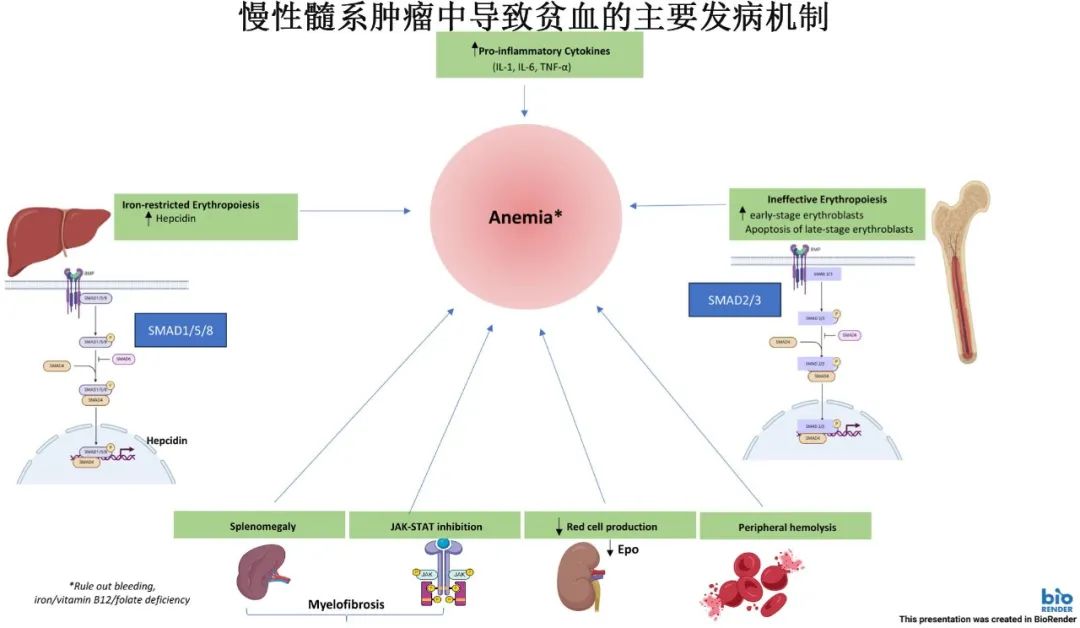
无效红细胞生成:TGF-β家族成员在红细胞生成的晚期阶段起负向调节作用,导致晚期红细胞前体细胞凋亡增加。例如,在较低危MDS中,肾缺氧刺激Epo产生增加,驱动早期红细胞前体细胞扩增,但晚期前体细胞凋亡增加,导致无效红细胞生成。
铁限制性红细胞生成:铁稳态由肝细胞产生的铁调素(hepcidin)调节。铁调素与巨噬细胞和十二指肠肠细胞上的铁输出蛋白(ferroportin)结合,导致铁被困在网状内皮系统中,造成功能性铁缺乏。TGF-β-BMP-SMAD和JAK-STAT是调节铁调素产生的两个主要信号通路,它们受到炎症细胞因子、全身铁含量和红细胞生成的综合影响。
炎症细胞因子:MF患者中,多种炎症细胞因子水平升高,如IL-1β、IL-6、TNF-α等,这些细胞因子通过激活JAK-STAT通路增加铁调素产生,从而加剧铁限制性红细胞生成。
治疗
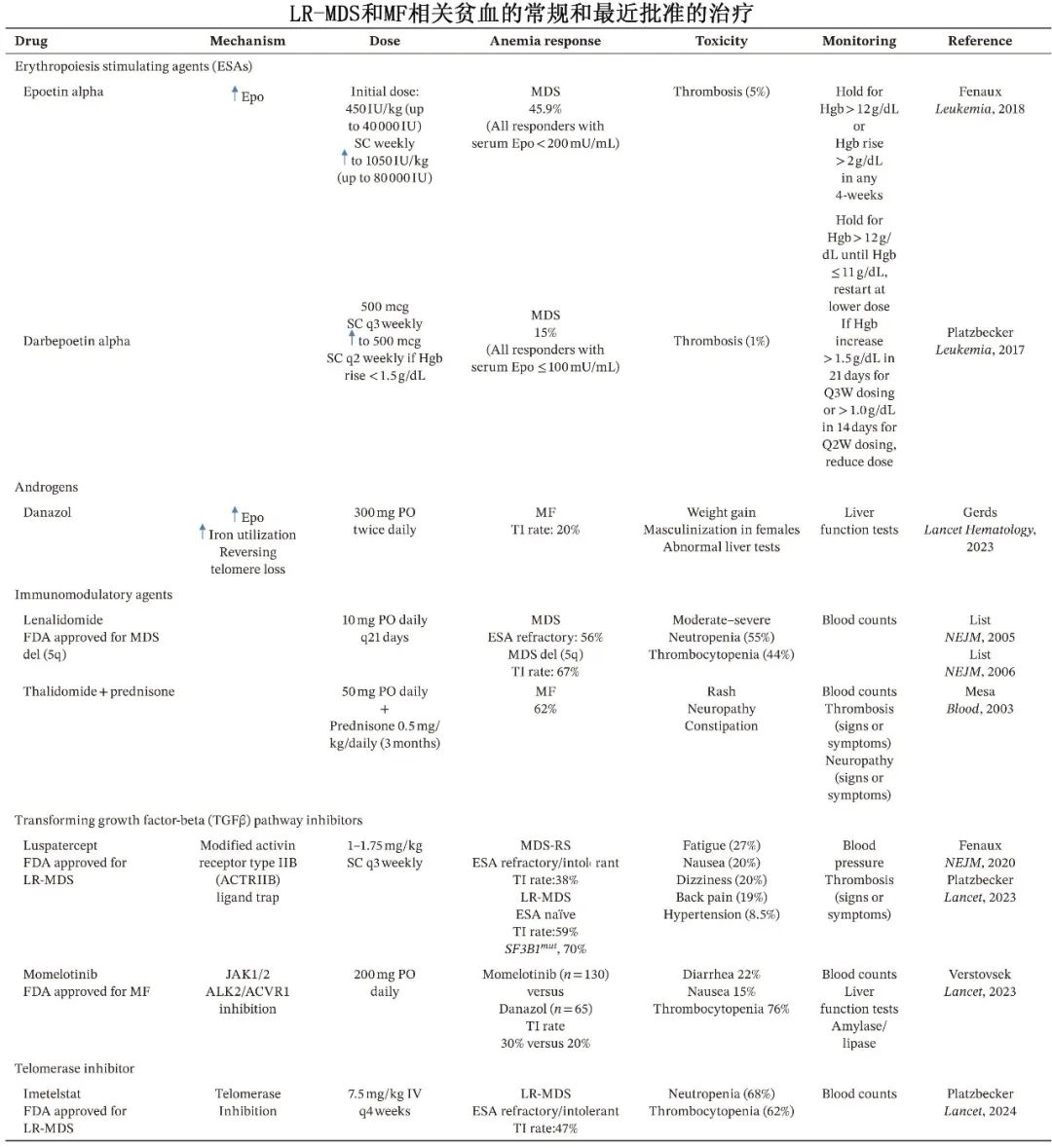
对于无症状的贫血患者,由于缺乏早期治疗有益的明确证据,建议采取观察性治疗。对于有症状且Hgb低于10 g/dL的贫血患者,建议采用药物治疗。传统治疗方法包括促红细胞生成素刺激剂(ESA)、danazol、糖皮质激素以及免疫调节剂,如沙利度胺和来那度胺。罗特西普和Imetelstat(端粒酶抑制剂)是近年来新批准用于较低危MDS(LR-MDS)相关贫血的治疗药物。此外,2023年,Momelotinib被批准用于骨髓纤维化(MF)患者的贫血治疗。同时,针对TGF-β-BMP-SMAD和HIF/PH通路的几种新疗法目前正在积极的临床研究中。
传统疗法:
促红细胞生成素刺激剂(ESA):如Epoetin alpha和darbepoetin alpha,虽然未正式获批用于MDS和MF的贫血治疗,但在临床中广泛使用。研究显示,对ESA的反应率在MDS中为15%-45.9%,在MF中为23%-53%。
雄激素治疗:如danazol,用于MF贫血的管理,反应率约为30%,但常见副作用包括男性化和肝功能异常。
免疫调节剂:沙利度胺、来那度胺和泊马度胺等,其中来那度胺被FDA批准用于MDS伴del(5q)。在MF中,沙利度胺联合泼尼松的治疗方案显示出62%的贫血改善率。
新疗法:
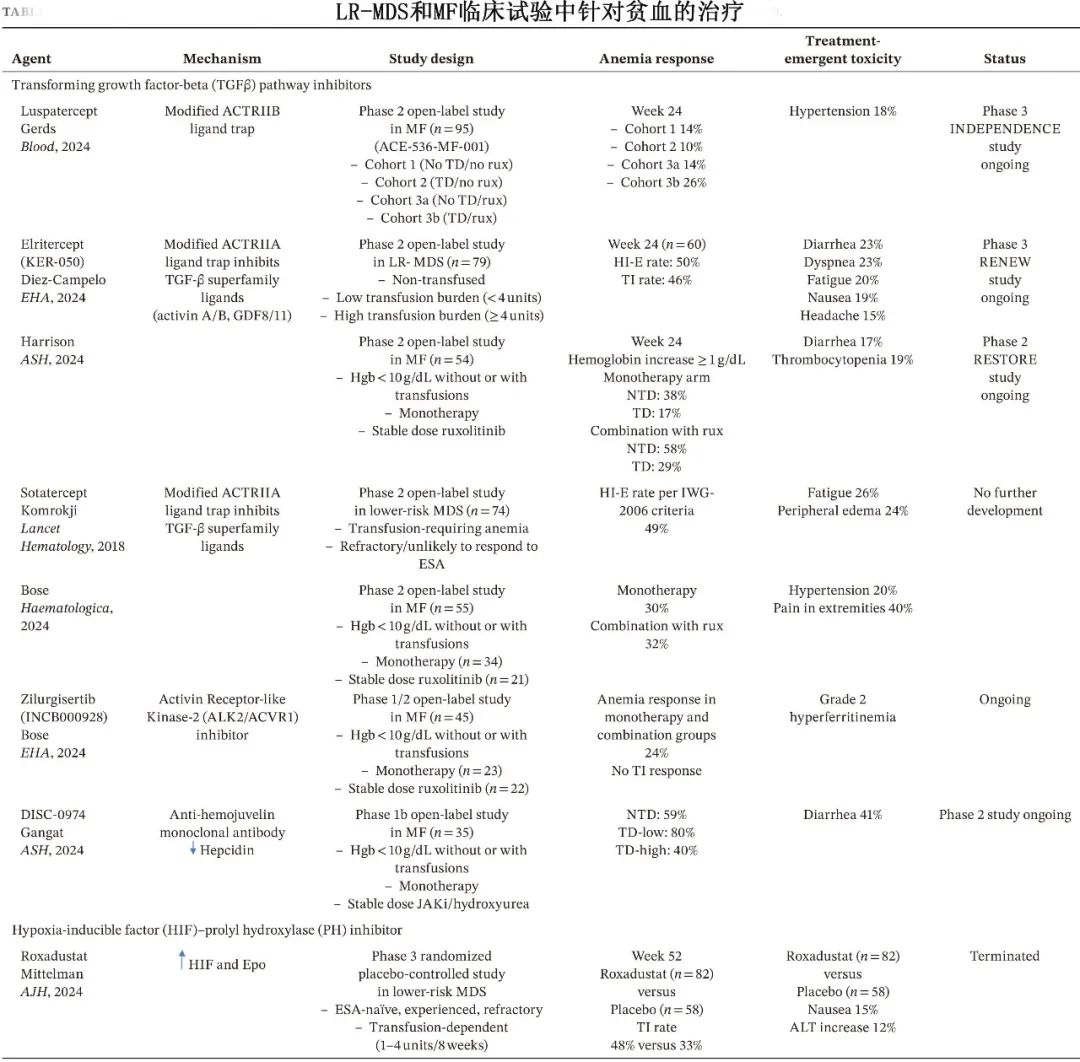
TGF-β通路抑制剂:如罗特西普(FDA批准用于较低危MDS)、momelotinib(FDA批准用于MF)和elritercept等。这些药物通过抑制TGF-β超家族配体与受体的结合,阻断SMAD信号通路,从而改善无效红细胞生成和铁限制性红细胞生成。
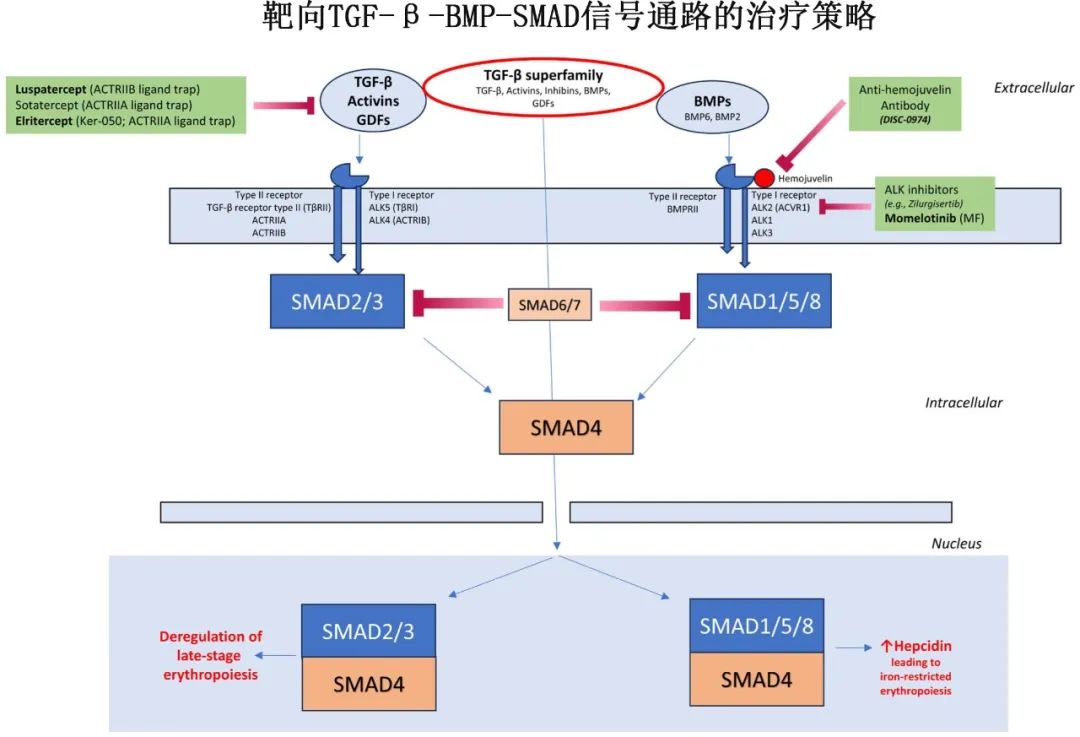
HIF/PH抑制剂:如roxadustat,通过稳定HIF并刺激内源性Epo产生,间接抑制hepcidin。然而,roxadustat在一项III期临床试验中未能达到主要终点,后续开发已终止。
端粒酶抑制剂:如imetelstat,通过抑制端粒酶活性,诱导恶性造血祖细胞凋亡,改善红细胞生成。imetelstat在2024年获得FDA批准,用于对ESA难治或复发的低风险MDS患者。
联合治疗:将具有互补机制的药物联合使用,如罗特西普联合ESA、罗特西普联合来那度胺、momelotinib联合罗特西普等,正在临床试验中研究。
参考文献
Am J Hematol. 2025 Mar 8. doi: 10.1002/ajh.27659.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#骨髓增生异常综合征# #原发性骨髓纤维化#
2