【柳叶刀血液病学】EMN关于优化多发性骨髓瘤CAR T和双抗治疗的建议
昨天 聊聊血液 聊聊血液 发表于上海
欧洲骨髓瘤网络(EMN)提供了关于患者选择、转诊和操作策略的建议,以优化T细胞免疫疗法治疗多发性骨髓瘤的安全性和有效性。
免疫调节剂、蛋白酶体抑制剂和靶向CD38的抗体的引入显著改善了多发性骨髓瘤患者的生存情况。在过去的5年中,新型T细胞免疫疗法(包括T细胞重定向双特异性抗体和CAR T细胞疗法;图1)改变了三类暴露(triple-class exposed)多发性骨髓瘤的治疗格局。在这些新型T细胞疗法出现之前,三类耐药(triple-class refractory)多发性骨髓瘤患者预后较差,中位无进展生存期约为3-4个月,中位总生存期约为9-12个月。目前,T细胞免疫疗法正在向更早期的治疗线推进。
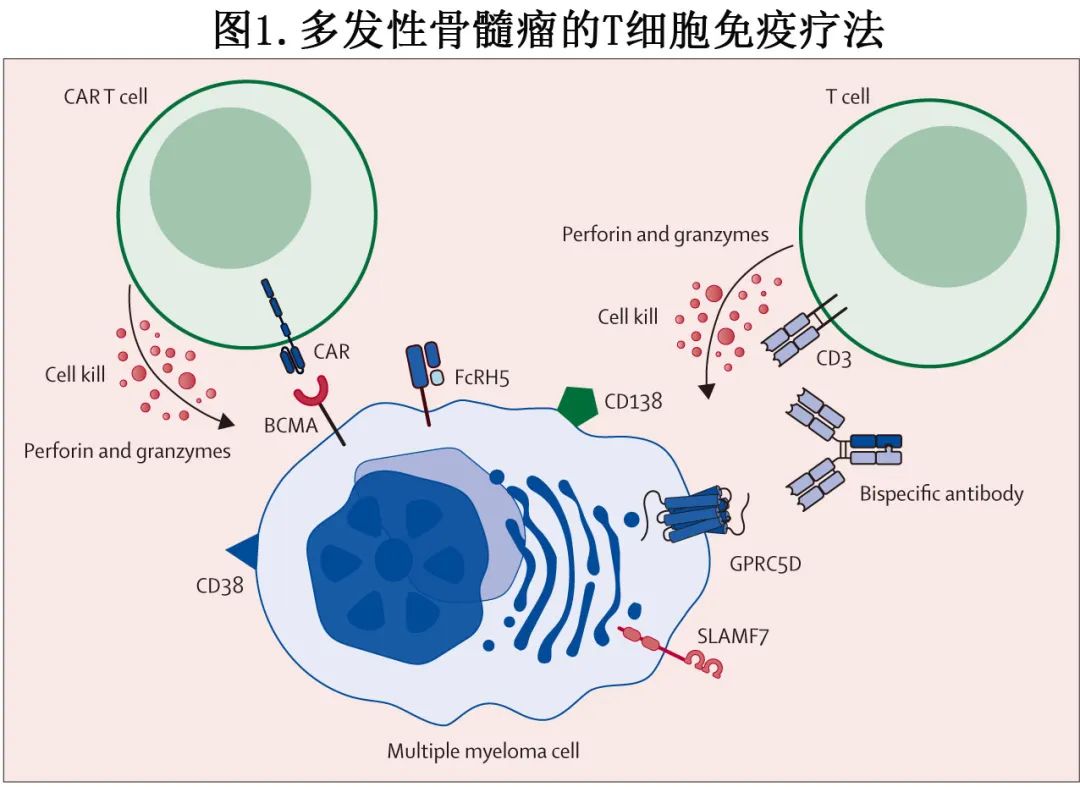
《The Lancet Haematology》近日发表综述,欧洲骨髓瘤网络(EMN)提供了关于患者选择、转诊和操作策略的建议,以优化T细胞免疫疗法治疗多发性骨髓瘤的安全性和有效性,还讨论了T细胞免疫疗法的序贯使用,并描述了在开始T细胞免疫疗法之前可能存在的、可修改的风险因素。因为该综述是欧洲学者所写,很多内容可能更符合当地的治疗观念。

T细胞免疫治疗
CAR T
T细胞可以通过基因修饰表达一种嵌合抗原受体(CAR),这种受体特异性针对肿瘤抗原,从而使T细胞能够识别并清除肿瘤细胞。目前有两种靶向B细胞成熟抗原(BCMA)的CAR T细胞疗法(ide-cel和cilta-cel)已获得美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)的批准,用于治疗复发或难治性多发性骨髓瘤患者。CAR T的制造成本高昂,还包括住院和辅助治疗的额外费用,可及性相对较低(表1)。
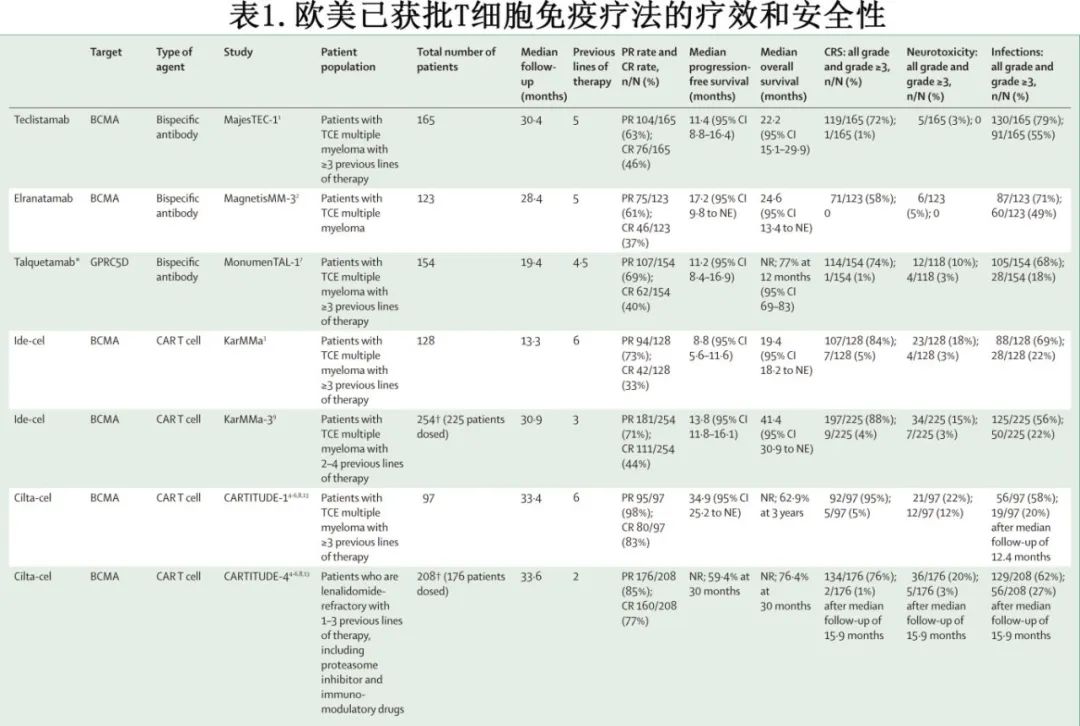
ide-cel和cilta-cel最初是基于在重度经治多发性骨髓瘤患者中显示出的高缓解率和长无进展生存期而获得批准的:ide-cel在128例患者中总缓解率(ORR)为94例(73.4%),完全缓解为42例(32.8%),中位无进展生存期为8.8个月(95% CI 5.6–11.6);cilta-cel在97例患者中ORR为95例(97.9%),完全缓解为80例(82.5%),中位无进展生存期为34.9个月(95% CI 25.2至无法估计)。
随后,基于两项3期临床试验在早期治疗线中的阳性结果,两款CAR T产品的适应证获得扩大。首先,在KarMMa-3试验中,接受ide-cel治疗的三类暴露多发性骨髓瘤患者(既往接受过2-4线治疗)的ORR为(71%),中位无进展生存期为13.8个月(95% CI 11.8–16.1),而接受标准治疗的患者ORR为42%,中位无进展生存期为4.4个月(95% CI 3.4–5.8)。在所有亚组中,包括根据是否存在高危细胞遗传学异常定义的亚组,ide-cel治疗的无进展生存期获益均一致。由于56%的患者从标准治疗交叉至ide-cel治疗,ide-cel未显示出总生存期获益。基于这些结果,EMA和FDA将ide-cel的适应证扩大至接受过二线或以上治疗的三类暴露多发性骨髓瘤患者。
其次,CARTITUDE-4试验比较了cilta-cel与标准治疗在来那度胺耐药且既往接受过1-3线治疗的多发性骨髓瘤患者中的疗效。与接受标准治疗的患者相比,cilta-cel组的ORR、30个月时的无进展生存率和30个月时的总生存率均有所提高(分别为84.6% vs 67.3%、59.4% vs 25.7%和76.4% vs 63.8%)。
重要的是,cilta-cel治疗的高危细胞遗传学或功能性高危患者也观察到无进展生存期和缓解深度的改善。基于CARTITUDE-4的结果,EMA和FDA将cilta-cel的适应证扩展至至少接受过一线治疗的来那度胺耐药患者。其他多种靶向BCMA和GPRC5D的CAR T细胞产品也正处于开发的后期阶段。
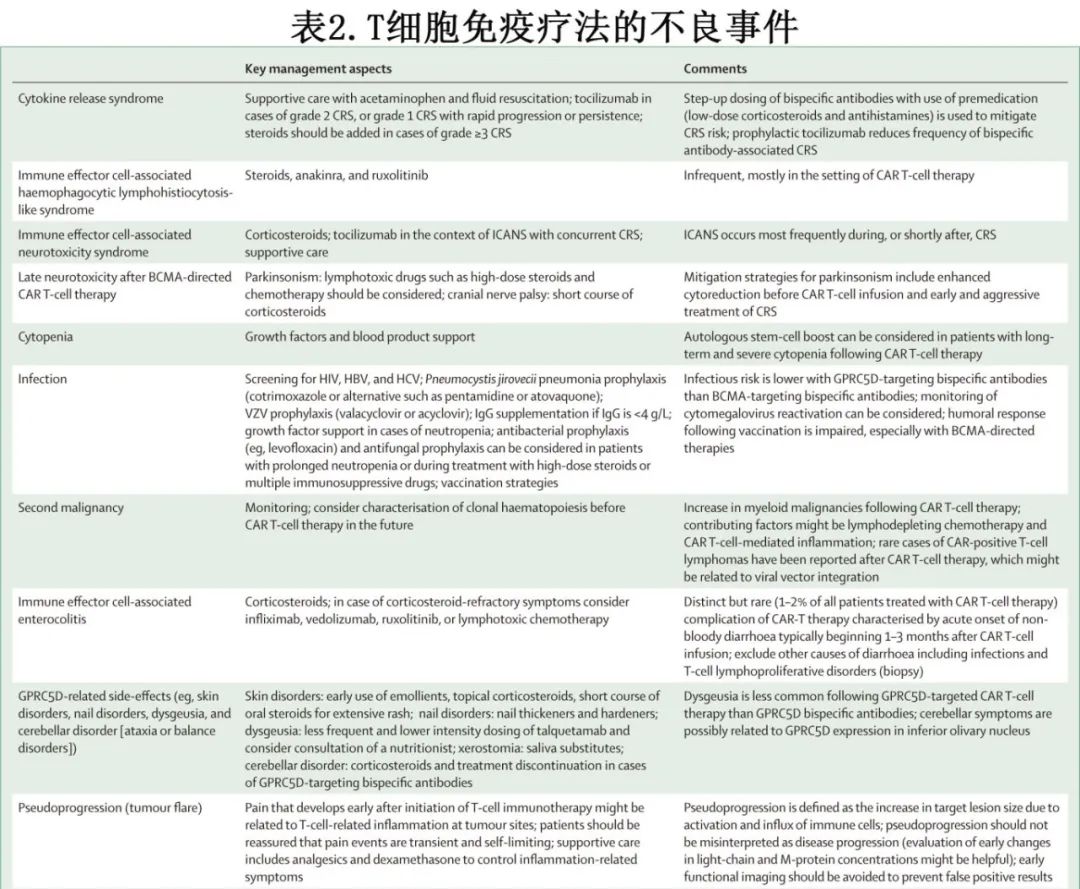
CAR T细胞疗法与多种不良事件相关,包括血细胞减少症和感染,以及细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS),它们与T细胞激活和细胞因子分泌有关。毒性也可能与健康组织中的靶点表达有关(靶向但非肿瘤毒性),例如BCMA靶向疗法中B细胞和多克隆浆细胞的清除,导致低丙种球蛋白血症。此外,帕金森病的发展可能与基底神经节神经元上的BCMA表达有关。GPRC5D在角化组织中表达,从而解释了GPRC5D靶向疗法的特异性副作用(例如,皮肤、指甲和口腔疾病)。与病毒载体整合相关的表达CAR的T细胞淋巴瘤在CAR T细胞治疗后极为罕见。这些毒性的预防和管理策略见表2。
双特异性抗体
T细胞重定向双特异性抗体能够同时结合肿瘤细胞表面的抗原和T细胞表面的CD3,从而形成免疫突触,随后激活T细胞并使其脱颗粒,最终导致肿瘤细胞溶解。双特异性抗体是现货型药物,可以直接提供给患者,使出现侵袭性复发的患者能够立即接受治疗,以快速控制疾病。
目前有两种靶向BCMA的双特异性抗体获得FDA和EMA的批准,用于治疗三类暴露复发或难治性多发性骨髓瘤患者(见表1)。特立妥单抗(Teclistamab)是首个获批的抗BCMA双特异性抗体,其批准基于MajesTEC-1研究的结果,该研究显示165例患者中ORR为63%,其中76例(46%)患者达到完全缓解,中位无进展生存期为11.4个月(95% CI 8.8–16.4)。Elranatamab也已获批用于治疗重度经治患者,其安全性特征和疗效与特立妥单抗相似(ORR为61%,完全缓解为37%,中位无进展生存期为17.2个月[95% CI 9.8至无法估计])。还有其他几种靶向BCMA的双特异性抗体正在进行临床开发(例如linvoseltamab、etentamig[ABBV-383]和HPN217)。
由于选择BCMA阴性或突变克隆是BCMA靶向治疗期间复发的重要驱动因素,因此需要开发靶向其他肿瘤抗原的双特异性抗体。Talquetamab是一种靶向GPRC5D的双特异性抗体,已获批用于治疗三类暴露多发性骨髓瘤。在MonumenTAL-1研究中,接受每2周0.8 mg/kg剂量talquetamab治疗的154例患者中,ORR为69%,完全缓解为40%,中位无进展生存期为11.2个月(95% CI 8.4–16.9)。Cevostamab是一种靶向FcRH5的双特异性抗体,目前处于临床开发的后期阶段。在目标剂量160 mg下,重度经治患者中ORR为44.3%,而在未接受过BCMA治疗的亚组患者中ORR为60.6%。正在进行的3期研究正在评估不同双特异性抗体在早期治疗线中的价值,无论是单药治疗还是与其他药物联合使用。
与CAR T细胞疗法相比,双特异性抗体的重度细胞因子释放综合征(CRS,≥3级)或神经毒性发生率较低,使得其可以在衰弱或有多种合并症的患者中使用(表1和表2)。然而,靶向BCMA的双特异性抗体比CAR T的感染发生率更高,但通过适当的辅助治疗,包括IgG补充治疗,可以降低感染风险。与靶向BCMA的双特异性抗体相比,靶向GPRC5D的双特异性抗体感染风险较低,这可能是因为talquetamab不会清除B细胞和正常浆细胞,而靶向BCMA的双特异性抗体则会显著耗竭这些免疫细胞亚群。与talquetamab相关的on-target, off-tumour不良事件包括味觉障碍、体重减轻,以及皮肤和指甲相关毒性。尽管罕见,但接受talquetamab治疗的患者中有报告出现共济失调和平衡障碍。在达到深度缓解后减少双特异性抗体的给药频率或采用固定时长的治疗,可能有助于防止T细胞耗竭,并改善毒性与疗效之间的平衡。
T细胞免疫疗法的序贯使用
T细胞免疫疗法的序贯是可行的,但药物的使用顺序对于提高疗效至关重要。多项小规模研究表明,患者在接受BCMA靶向双特异性抗体治疗后,接受CAR T细胞疗法的缓解持续时间显著缩短,而既往接受CAR T细胞疗法对后续双特异性抗体治疗的影响则不太明显。这些观察结果可能可以通过CAR T细胞疗法后较长的无治疗间隔来解释:与双特异性抗体治疗引起的慢性T细胞刺激和持续选择压力导致的T细胞健康度(fitness)降低和抗原丢失频率增加相比,T细胞耗竭和抗原逃逸的风险有所降低。
使用靶向不同抗原的双特异性抗体序贯使用是可行的,但与第一个双特异性抗体的疗效相比,第二个双特异性抗体的活性通常会降低。有初步证据表明,至少3-6个月的双特异性抗体间隔期可能会提高第二个双特异性抗体的疗效。然而在真实世界中,对于已经用尽其他治疗选择的患者来说可能具有挑战性。
小型研究表明,如果使用过不同的CAR T细胞产品,序贯BCMA CAR T细胞疗法可以诱导持久缓解。使用相同CAR T细胞产品的再治疗是无效的,这可能部分是由于抗CAR抗体的产生。小规模研究还表明,对于接受过BCMA CAR T细胞疗法的患者,GPRC5D CAR T细胞疗法可能有效。
未来,用于评估复发机制的诊断检测(例如T细胞耗竭与抗原丢失或抗原突变),可能对于指导第二次T细胞免疫疗法的选择(即方式和靶点)非常重要。
T细胞免疫疗法的初始选择
了解如何最佳地使用不同的T细胞重定向疗法以改善多发性骨髓瘤患者的总体预后至关重要。多发性骨髓瘤的治疗选择取决于现有治疗方案的有效性和耐受性之间的平衡,以及各种疾病特征和患者特征。在复发或难治性多发性骨髓瘤中,治疗选择受到既往对多发性骨髓瘤药物暴露和耐药性的影响,还应考虑治疗方案对后续治疗选择的影响。尚未开展前瞻性、随机研究以确定应首先选择的最优化的T细胞重定向疗法,现有证据仅基于重度经治患者的小队列和真实世界研究。随着正在进行的研究提供新的见解,治疗格局可能会演变。
对于适合接受CAR T细胞疗法的患者,建议优先使用CAR T细胞疗法,并在疾病后期使用双特异性抗体,因为单次CAR T细胞输注后具有高缓解率和持久的无进展生存期,尤其是cilta-cel。越来越多的证据表明,既往接受双特异性抗体治疗会降低CAR T细胞疗法的疗效,而CAR T细胞疗法后的复发可以通过双特异性抗体有效管理。与随机研究中的标准方案相比,单次CAR T细胞输注还与更长的无治疗间隔和改善的生活质量相关。然而,CAR T细胞疗法在不同地理区域的可及性差异很大。此外,由于从静脉到静脉的时间较长,对于病情迅速进展、已经用尽标准治疗且没有有效桥接治疗选择的患者,CAR T细胞疗法在物流上可能具有挑战性。对于这些患者,应考虑现货型、可立即使用的治疗选择,例如双特异性抗体,或者在未来不久,包含belantamab mafodotin(belamaf)的方案。由于衰弱或合并症(如心脏病或神经系统疾病),部分患者可能不适合接受CAR T细胞疗法。由于严重CRS和ICANS的发生率较低,双特异性抗体可以安全地用于老年患者和虽然患者,衰弱患者也可能从基于belamaf的治疗中受益。
选择哪款CAR T产品?
cilta-cel目前是首选的CAR T细胞疗法。虽然没有随机试验直接比较cilta-cel与ide-cel,但在跨试验比较的局限性背景下,cilta-cel治疗与ide-cel相比具有更好的缓解率、无进展生存期和总生存期。一项回顾性真实世界研究纳入了586名美国患者,这些患者接受过四线或以上的既往治疗,结果显示接受cilta-cel治疗的患者无进展生存期(风险比0.48,95% CI 0.36–0.63)和总生存期(0.67,0.46–0.97)优于接受ide-cel治疗的患者。在欧洲的一项回顾性研究中,204名接受过三线或以上既往治疗的患者也观察到cilta-cel相较于ide-cel的改善结局。然而,cilta-cel治疗也与更高的重度CRS、重度ICANS、迟发性神经毒性和感染发生率相关,但并未改变非复发死亡率。在≥70岁患者中,cilta-cel的疗效也优于ide-cel。尽管如此,由于cilta-cel的CRS和神经毒性发生率较低,ide-cel可以在有神经或心血管合并症的老年患者中考虑使用。这些老年患者也可能从双特异性抗体以及belamaf中获益。
双特异性抗体:BCMA还是GPRC5D?
虽然目前没有直接比较,但在重度经治多发性骨髓瘤患者中,靶向BCMA和靶向GPRC5D的双特异性抗体具有相似的疗效,但毒性特征不同——靶向BCMA的双特异性抗体感染发生率更高,而靶向GPRC5D的双特异性抗体则更多出现皮肤、指甲和口腔不良事件。尽管基于不良事件特征,靶向BCMA的双特异性抗体通常在标准治疗中被优先选择,但对于有严重感染史或患有慢性肺部疾病(如慢性阻塞性肺疾病或支气管扩张症,这些疾病会增加呼吸道感染复发的风险)的患者,talquetamab可能是更优选择,因为talquetamab治疗期间体液免疫得以保留。talquetamab也适用于既往接受过BCMA靶向治疗(例如CAR T细胞疗法或belamaf)的患者。可以考虑使用GPRC5D双特异性抗体进行桥接治疗(在单采后开始),可能会提高后续BCMA CAR T细胞疗法的疗效。
CAR T细胞疗法:优化疗效的考虑
早期转诊和规划
CAR T细胞疗法是一种昂贵的治疗方式,且生产能力有限,对医疗保健系统构成挑战;因此谨慎选择患者至关重要(图2)。
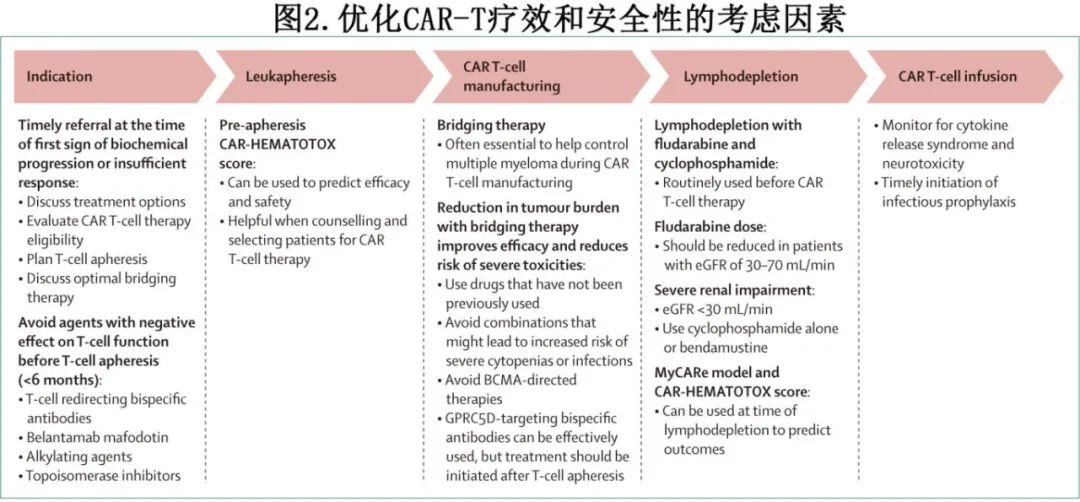
潜在适合接受CAR T细胞疗法的患者应尽早转诊至CAR T细胞中心,以讨论治疗选择并评估资格,因为CAR T细胞制造的名额有限,且CAR T细胞制造或保险审批可能需要较长时间。所有患者都应接受HIV、HBV和HCV检测。在评估CAR T细胞疗法时,对于老年患者以及有心脏或肺部疾病迹象或症状的患者,应考虑进行心脏和肺功能检测。应在生化进展或对治疗反应不足时直接转诊患者,以计划T细胞单采并讨论最佳桥接治疗,因为对肿瘤负荷较低的患者进行CAR T细胞治疗可以提高疗效并降低严重毒性风险(图2)。高肿瘤负荷也是ide-cel制造产量低的预测因素。
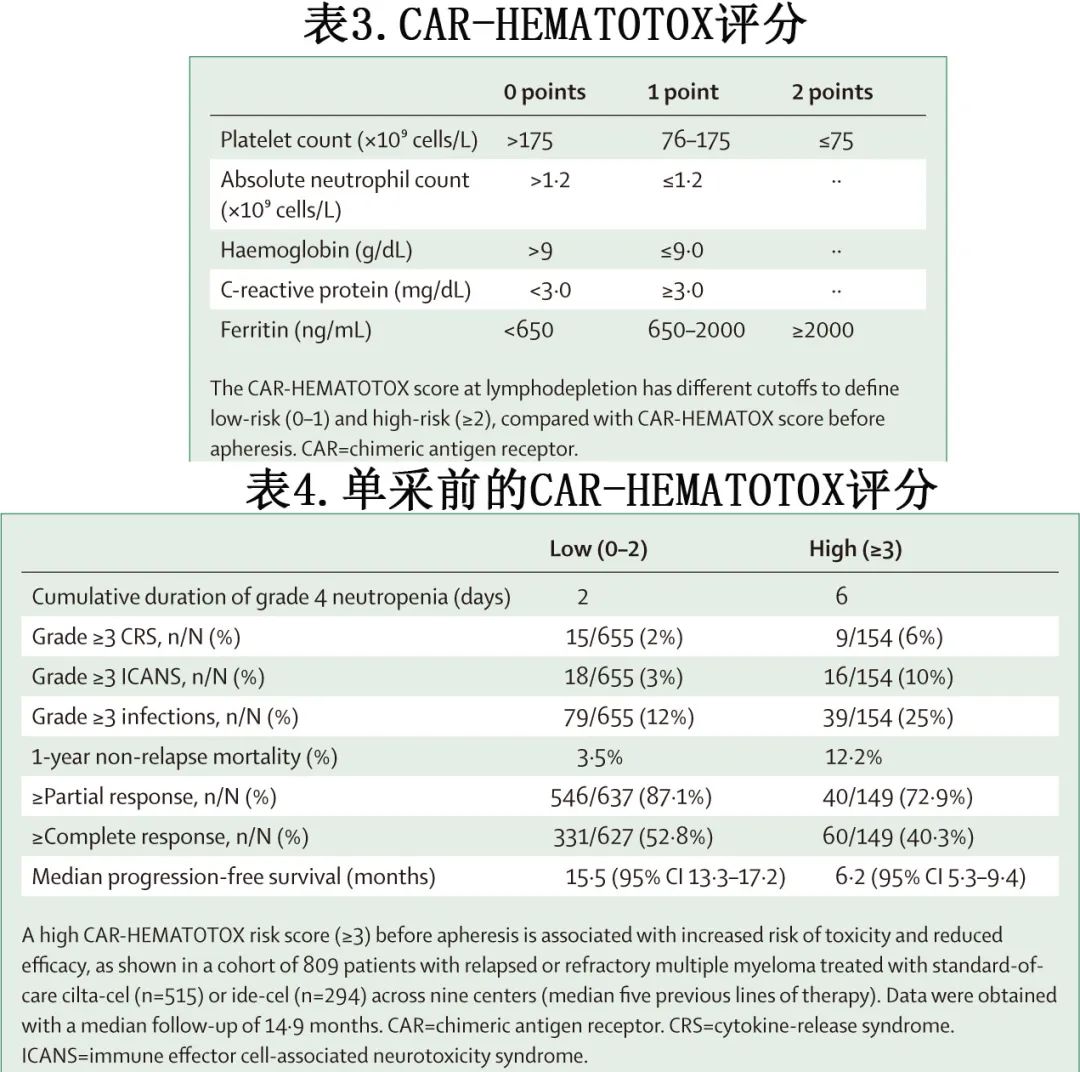
CAR-HEMATOTOX评分是一种新型风险分层工具,包括与造血储备(例如血小板计数、血红蛋白和绝对中性粒细胞计数)和基线炎症(例如C反应蛋白和铁蛋白)相关的标志物,在单采前使用CAR-HEMATOTOX评分可用于预测疗效、毒性(例如感染、ICANS和血细胞减少症)以及非复发死亡率(见表3和表4)。这些信息可用于在咨询和选择CAR T细胞疗法的患者时使用,并通过识别可修改的风险因素(例如有效的桥接治疗以减轻肿瘤负荷和肿瘤诱导的炎症的负面影响)来优化预后。
早期使用CAR T
早期使用CAR T细胞疗法可能会减少不良事件,例如长期血细胞减少症。CAR T细胞疗法在疾病早期使用更为有效,可能是因为T细胞的适应性更好、桥接治疗的选择更多,以及肿瘤在基因组上复杂性更低。在对两项独立试验的比较中,cilta-cel在CARTITUDE-4试验(既往接受过1-3线治疗)中显示出更好的结果,微小残留病(MRD)阴性率为67.6%(阈值为10⁻⁶),30个月无进展生存率为68.4%,30个月总生存率为84.3%,而CARTITUDE-1试验(既往接受过3线或以上治疗)的相应数据分别为40.2%、54.2%和68.0%。此外,在KarMMa-3试验(既往接受过2-4线治疗)中,ide-cel的中位无进展生存期为13.8个月(95% CI 11.8–16.1),而KarMMa试验(既往接受过3线或以上治疗)为8.8个月(95% CI 5.6–11.6)。
因此,CAR T细胞治疗应在疾病早期考虑,尤其是在具有高危细胞遗传学特征、功能性高危(早期复发)的患者,或者在复发时对来那度胺和CD38抗体耐药的患者中。随着新诊断患者越来越多地接受四药联合方案治疗,首次复发时出现三类暴露或三类耐药疾病的患者比例也显著增加。然而,对于之前未接受过含CD38抗体方案治疗的患者,也可能从首次复发或之后的达雷妥尤单抗或艾沙妥昔单抗为基础的联合治疗中获益,并在疾病后期选择CAR T细胞治疗;该联合治疗也可以作为接受过CD38靶向抗体固定疗程治疗、在CD38靶向治疗期间未进展且经历了较长CD38靶向抗体间隔期的患者的考虑方案。
T细胞单采前避免对T细胞功能产生负面影响的药物
在考虑接受CAR T细胞疗法的患者中,应在单采前避免使用对CAR T细胞制造过程或CAR T细胞输注后临床结果产生负面影响的抗骨髓瘤药物。
双特异性抗体
越来越多的证据表明,应在T细胞单采前避免双特异性抗体治疗,因其会对CAR T细胞的制造和CAR T细胞输注后的结果产生负面影响。在白细胞单采前接受过BCMA或GPRC5D双特异性抗体治疗的患者中,制造失败的风险增加(25-40%),并且产品不符合规格(即未达到预定义的接受标准)的风险也增加。2025年的一项研究表明,即使在白细胞单术前接受过少量(中位数为3次)BCMA或GPRC5D双特异性抗体治疗,与接受其他治疗的患者相比,其不符合规格率也高达40%(其他治疗为9.5%),可能导致需要重新单采,并增加从单采到CAR T细胞输注的时间。不符合规格的CAR T细胞产品的原因包括生产过程中CAR T细胞增殖不足,以及在IFNγ实验中CAR T细胞的效力不足。与这些临床发现一致,体外实验也表明,暴露于双特异性抗体的T细胞在CAR T细胞生成过程中扩增能力减弱,转导效率降低,并且由此产生的CAR T细胞产品杀伤多发性骨髓瘤细胞的能力降低。在这些体外研究中,无论使用特立妥单抗还是talquetamab,都观察到了类似的结果,表明双特异性抗体的负面影响与靶点无关。
接受过双特异性抗体治疗的患者,其BCMA CAR T细胞疗法的临床结果显著受损。例如,在CARTITUDE-2研究的C队列中,接受过BCMA双特异性抗体治疗的患者接受cilta-cel治疗后,中位无进展生存期为5.3个月(95% CI 0.6至无法估计)。尽管需要进一步研究,但多项研究表明,使用具有不同作用机制的替代疗法可以延长BCMA靶向治疗之间的间隔时间(>6个月),从而提高CAR T细胞疗法的疗效。
综上所述,为了避免影响T细胞的健康度,应在单采前避免双特异性抗体治疗。尽管数据有限,但现有的数据表明,对于CAR T细胞疗法的候选患者,双特异性抗体的洗脱期为6个月。然而,对于可能在疾病后期有机会接受CAR T细胞疗法的患者,应避免选择次优的治疗方案。
Belamaf
几项小型研究表明,既往接受过belamaf治疗会降低BCMA CAR T细胞疗法的疗效,可能与部分患者体内BCMA丢失有关。因此,在接受BCMA CAR T细胞疗法之前应避免使用belantamab。初步证据表明,超过6个月的无BCMA靶向治疗间隔可以减轻belantamab对后续BCMA靶向CAR T细胞疗法的负面影响。
其他抗骨髓瘤药物
在ide-cel治疗的患者中,单采前近期暴露于CD38靶向抗体、免疫调节剂或接受过elotuzumab治疗与中性或有利的结局相关,而烷化剂(例如环磷酰胺或苯达莫司汀)、蛋白酶体抑制剂治疗或拓扑异构酶抑制剂治疗后的短暂洗脱期与ide-cel治疗的无进展生存期缩短相关,这些药物对临床结局的影响可能与其对T细胞计数的负面影响以及诱导T细胞衰老有关。T细胞耗竭在最后一次暴露于烷化剂或蛋白酶体抑制剂后可长达9个月仍可检测到。与最后一次治疗与单采术间隔不足9个月的患者相比,间隔9个月或以上的患者中位绝对淋巴细胞计数更高(烷化剂:0.61×10⁹/L vs. 0.90×10⁹/L;蛋白酶体抑制剂:0.70×10⁹/L vs. 0.95×10⁹/L)。
既往接受过大剂量马法兰和自体造血干细胞移植(HSCT)的患者,接受ide-cel治疗时完全缓解率显著降低,无进展生存期缩短,但对cilta-cel的无进展生存期无影响。近期接受过自体HSCT的患者,其单采材料中幼稚T细胞数量较少,衰老T细胞比例较高。
目前尚需更多关于不同抗骨髓瘤药物在单采前的最佳洗脱期信息,但现有证据表明,烷化剂的洗脱期可考虑为3-6个月(洗脱期可能与总给药剂量相关)。对于预计后期适合接受CAR T细胞疗法的患者,应在疾病早期、在长时间暴露于对T细胞健康度产生负面影响的药物之前,探索T细胞采集的可能性。
CAR T细胞输注前的桥接治疗
T细胞采集后的制造和随后的质量控制可能需要长达8-12周,在疾病快速进展的情况下尤其具有挑战性。在KarMMa研究中,接受白细胞单采的患者中,有8.6%(KarMMa)和9.6%(KarMMa-3)未能接受ide-cel输注;在CARTITUDE研究中,接受白细胞单采的患者中,有14.2%(CARTITUDE-1)和5.8%(CARTITUDE-4)未能接受cilta-cel输注,主要原因均为疾病进展或因疾病进展导致的死亡。在真实世界研究中,约10%接受单采术的患者因在输注前死亡、单采后因疾病进展导致临床恶化或制造失败而未能接受CAR T细胞产品输注。
桥接治疗(即白细胞单采与CAR T细胞输注之间接受的治疗)通常对于在CAR T细胞制造期间控制多发性骨髓瘤至关重要,约75%-88%的重度经治患者需要桥接治疗。越来越多的证据表明,通过桥接治疗维持或减少肿瘤负荷可能会改善CAR T细胞输注后的临床结局。桥接治疗还可以降低CAR T细胞相关毒性(包括严重CRS和ICANS)的风险。在CARTITUDE-4研究中,接受cilta-cel治疗的患者中发生帕金森病的比例低于CARTITUDE-1研究(CARTITUDE-4为0.6%,CARTITUDE-1为6.2%),可能与CARTITUDE-4中更有效的桥接治疗有关。通过桥接治疗在CAR T细胞制造期间减少肿瘤负荷,也有潜力提高疗效。在KarMMa研究中,接受桥接治疗控制肿瘤负荷且在ide-cel输注时肿瘤负荷低的患者,其结局优于肿瘤体积大的患者。同样,在KarMMa-3研究中,对桥接治疗有反应(肿瘤负荷减少≥25%)的患者接受ide-cel治疗后的无进展生存期得到改善(中位无进展生存期为20.7个月[95% CI 11.2至无法估计]),而桥接治疗期间病情稳定(15.1个月[95% CI 12.4-17.3])或进展(6.9个月[95% CI 2.4-11.8])的患者则较差。此外,在CARTITUDE-4研究中,对桥接治疗有反应(肿瘤负荷减少≥25%)的患者与无反应的患者相比,无进展生存期更长(中位无进展生存期未达到[95% CI范围无法估计] vs 19.2个月[95% CI 15.8至无法估计])。在一项德国回顾性研究中,CAR T细胞输注(ide-cel或cilta-cel)后的无进展生存期显著受到缓解深度的影响,在桥接治疗后达到完全缓解的患者结局最佳,而桥接治疗后不足部分缓解的患者结局较差(完全缓解患者的中位无进展生存期未达到;部分缓解和非常好的部分缓解患者为10个月[95% CI 10至无法估计];不足部分缓解患者为6个月[95% CI 2至无法估计])。另一项大型回顾性研究也表明,对桥接治疗有反应的患者在CAR T细胞治疗后的生存结局得到改善。这些数据共同强调了在CAR T细胞给药前给予并优化桥接治疗以有效控制疾病的重要性。
桥接治疗的类型
桥接治疗通常在较短时间内进行(1-2个周期),需要在疗效和安全性之间达到最佳平衡,通常包括多药系统治疗或放疗,方案的选择取决于患者特征、疾病特征、既往治疗暴露情况和耐药状态。如果可能,建议使用患者既往治疗中未使用过的药物,但应避免使用BCMA靶向药物。应预防不良事件(例如严重的血细胞减少症和感染),因为除了疾病进展外,毒性也是接受单采的患者未能接受CAR T细胞输注的重要原因。回顾性研究表明,桥接治疗的类型也可能对CAR T细胞输注后的安全性特征产生影响。基于双特异性抗体的桥接治疗与较低的CRS发生率(50%)相关,而其他桥接治疗组的发生率为81%。一项回顾性研究表明,含有塞利尼索的方案与较高的ICANS发生率(≥2级;38%)相关,而其他桥接治疗的发生率分别为:烷化剂9%、蛋白酶体抑制剂联合方案0%、免疫调节剂或抗体联合方案17%。该结果可能与塞利尼索能够穿透血脑屏障有关。
研究表明,对于计划接受BCMA CAR T细胞疗法的三类暴露的重度经治多发性骨髓瘤患者,GPRC5D双特异性抗体可以作为桥接治疗的选择。在一项回顾性研究中,77名患者接受了talquetamab桥接治疗(其中65名患者接受了CAR T细胞输注)。talquetamab桥接治疗的中位持续时间为26天,77名患者中ORR为62%。talquetamab和CAR T细胞的毒性大多为低级别。在几项小规模研究中,talquetamab桥接治疗在83%-89%的患者中有效减少了肿瘤负荷,并在CAR T细胞输注后显示出有前景的缓解持续时间。尽管CRS较为常见,但在talquetamab治疗期间,没有患者出现延迟CAR T细胞治疗的并发症。此外,CAR T细胞输注后也没有出现意外的安全性问题。目前尚无研究关于GPRC5D双特异性抗体桥接治疗对后续使用相同或不同GPRC5D靶向治疗(例如通过诱导功能性抗原丢失)的潜在影响,因此使用GPRC5D靶向桥接治疗的决定应基于个案情况。
BCMA靶向双特异性抗体作为桥接治疗的作用尚不明确。在一项回顾性研究中,52名接受BCMA CAR T细胞疗法(cilta-cel或ide-cel)的患者中,BCMA或GPRC5D双特异性抗体是桥接治疗的有效且安全的选择,其缓解率(100%)高于化疗、基于抗CD38抗体的方案或含有elotuzumab的治疗(45%)。尽管差异无统计学意义,但缓解率的差异转化为双特异性抗体组与接受其他桥接治疗的患者相比更长的无进展生存期(中位无进展生存期未达到 vs 9个月[95% CI 5至无法估计])。小样本量限制了对接受BCMA或GPRC5D双特异性抗体的患者临床结局的比较,然而BCMA双特异性抗体桥接治疗可能导致BCMA表达减少或完全丢失、BCMA突变,甚至可能掩盖BCMA抗原,从而影响后续BCMA CAR T细胞的疗效。这些数据表明,talquetamab是优于BCMA双特异性抗体的首选桥接方案,以避免在BCMA双特异性抗体治疗期间发生BCMA抗原丢失,确保CAR T细胞的最佳疗效。
GPRC5D靶向双特异性抗体是已经用尽所有其他挽救治疗策略的患者的有效桥接选择。然而,由于双特异性抗体对CAR T细胞制造和疗效的负面影响,应在T细胞单采前避免使用。
放疗
一项小样本研究显示,放疗可以作为多发性骨髓瘤桥接治疗的一部分积极且安全地使用,尤其是在有骨旁或髓外浆细胞瘤的患者中。这些患者接受CAR T细胞治疗的预后较差,尤其是当髓外疾病伴有血液播散时。
清淋化疗
CAR T细胞治疗前的淋巴细胞清除化疗是CAR T细胞治疗的一个关键组成部分,可为CAR T细胞的扩增创造有利的免疫和细胞因子环境,并减少抗CAR的免疫反应,从而促进CAR T细胞的持续存在。在多发性骨髓瘤患者中,通常在CAR T细胞治疗前使用氟达拉滨和环磷酰胺的组合。
LEGEND-2研究评估了LCAR-B38M(与cilta-cel相同的CAR结构)在复发或难治性多发性骨髓瘤患者中的疗效。在这项研究中,74名患者中有89%接受了单药环磷酰胺(300 mg/m²,每日一次,连续3天)清淋,而8名(11%)患者接受氟达拉滨(25 mg/m²,每日一次,连续3天)联合环磷酰胺(250 mg/m²,每日一次,连续3天)。尽管两组的缓解率和CAR T细胞峰值相似,但与单独使用环磷酰胺相比,氟达拉滨联合环磷酰胺与更持久的缓解相关。LEGEND-2试验中氟达拉滨和环磷酰胺清淋的使用频率较低,可能部分解释了其无进展生存率低于CARTITUDE-1研究的原因;在CARTITUDE-1研究中,所有患者均接受氟达拉滨(30 mg/m²)和环磷酰胺(300 mg/m²),每日一次,连续3天。尽管LEGEND-2研究中的患者接受的既往治疗较少,但这种差异仍然存在。LEGEND-2研究的中位无进展生存期为18.0个月,而CARTITUDE-1研究为34.9个月(95% CI 25.2至无法估计)。
同样,在B细胞淋巴瘤中,氟达拉滨联合环磷酰胺方案与减少抗CAR免疫反应、增加CAR T细胞扩增和持续性以及提高缓解率相关,比单独使用环磷酰胺更为有效。
肾脏受损患者中的清淋化疗
在ide-cel和cilta-cel的关键研究中,肾功能受损(肌酐清除率<40–45 mL/min)的患者被排除在外。真实世界证据表明,对于肾功能严重受损的患者,包括需要血液透析的患者,CAR T细胞治疗是可行的。这些患者的疗效和CRS及神经毒性发生率与无肾功能受损的患者相似,但短期高级别血细胞减少症的发生率更高,并且住院时间更长。
由于氟达拉滨有40%通过肾脏清除,对于肌酐清除率为30–70 mL/min的患者,氟达拉滨剂量应减少至24 mg/m²,因为存在肾毒性的风险。对于肌酐清除率低于30 mL/min的患者,尚无可用的剂量建议。对于肾功能严重受损的患者,可以单独使用环磷酰胺进行治疗,或者使用减量氟达拉滨(环磷酰胺的肾脏排泄率低,为10–20%)。有证据表明,这些患者可能会从苯达莫司汀中受益。一项真实世界研究发现,苯达莫司汀清淋在CAR T细胞扩增、缓解率和无进展生存期方面与氟达拉滨和环磷酰胺相似。与氟达拉滨和环磷酰胺相比,苯达莫司汀还与更高的中性粒细胞绝对值低谷和更低的输血需求相关。总的来说,这些研究表明,对于对氟达拉滨和环磷酰胺有禁忌的患者(例如肾功能受损),以及可能的老年患者或有合并症(如造血储备不足)的患者,可以考虑使用苯达莫司汀(连续两天每天90 mg/m²)。
双特异性抗体:优化疗效的考虑
早期转诊和规划
及时转诊患者有助于通过在疾病早期识别出需要高支持治疗的患者,从而优化双特异性抗体治疗。例如,基线多克隆IgG浓度较低(<4 g/L)的患者可能在治疗开始前从免疫球蛋白补充中获益。对传染病进行筛查并及时开始适当的预防性治疗(例如,对于慢性或已解决的HBV感染患者,使用恩替卡韦预防HBV再激活)也是至关重要的。及时规划可以讨论剂量递增的最合适方案(即住院或门诊,以及是、否使用预防性托珠单抗)。
临床前和临床研究表明,在肿瘤负荷高的情况下双特异性抗体的效果较差,可能原因包括:效应细胞与靶细胞比例不利,由于双特异性抗体介导的T细胞激活增加而导致的T细胞早期耗竭。高疾病负荷与可溶性BCMA的高浓度相关,可溶性BCMA通过作为药物陷阱来降低BCMA靶向双特异性抗体的效力。因此,患者可能从及时开始双特异性抗体治疗中获益,例如在生化复发时(此时肿瘤负荷相对较低),而非等待临床复发。然而,患者可能在复发时出现高肿瘤负荷或髓外浆细胞瘤,这些情况预示着预后不良。对于这些高危患者,可以考虑减瘤化疗。使用多发性骨髓瘤小鼠模型进行的临床前实验表明,肿瘤减瘤可以改善双特异性抗体的抗多发性骨髓瘤活性,并防止T细胞耗竭。同样,在一项回顾性研究中,36名有髓外疾病或高肿瘤负荷的患者在开始BCMA双特异性抗体治疗前接受了传统化疗(大多数接受了1个周期),获得高缓解率和持久无进展生存(中位数为9.4个月[95% CI 4.1–18.1])。对于有大浆细胞瘤的患者,放疗也可以带来获益,可通过缩小肿瘤来改善T细胞的募集,还包括诱导炎症。
双特异性抗体的早期使用
根据EMA的说明书,患者目前可以在第三次复发或之后接受双特异性抗体治疗,而FDA已批准该疗法用于接受过四线或以上治疗的患者。作者倾向于在疾病早期尽可能早地为符合条件的患者使用双特异性抗体,因为早期使用与更长的缓解期和缓解深度增加有关。例如,在teclistamab的MajesTEC-1研究中,接受过三线或以下治疗的患者的中位无进展生存期为21.7个月(95% CI 13.8至无法估计),而接受过超过三线治疗的患者为9.7个月(95% CI 6.4–13.1)。在elranatamab的MagnetisMM-3研究和真实世界研究中也观察到类似结果,例如在早期治疗线中无进展生存期改善。此外,在MonumenTAL-1研究中,talquetamab治疗(每2周0.8 mg/kg)在接受过四线或以下治疗的患者中中位无进展生存期为17.8个月,而在接受过超过四线治疗的患者中为8.5个月(95% CI不可用)。此外,随着治疗线的增加,患者的流失率也在增加,从而进一步强调了在疾病早期实施新的有效且耐受性良好的治疗以提高患者生存率的必要性。
肾脏受损
尽管在评估已批准的双特异性抗体的临床研究中排除了肌酐清除率低于30–40 ml/min的患者,但真实世界证据表明,在肾功能严重受损的患者中,包括接受血液透析的患者,双特异性抗体治疗是可行的,并且没有意外的副作用。双特异性抗体不会通过肾脏清除,因此不需要调整剂量。
避免对靶抗原或T细胞功能产生负面影响的药物
使用不同的靶向BCMA形式进行再治疗是可行的,但既往的BCMA治疗会降低BCMA双特异性抗体的缓解持续时间,且这种影响在接受过belantamab治疗后可能比接受BCMA CAR T细胞治疗后更为明显。BCMA双特异性抗体的启动时间与末次BCMA治疗的关系可能很重要,因为在BCMA间隔超过9个月的患者中无进展生存期有所改善。GPRC5D靶向双特异性抗体的疗效不受既往BCMA CAR T细胞治疗或belantamab的影响。
近期接触烷化剂、蛋白酶体抑制剂或拓扑异构酶抑制剂会对T细胞的数量和质量产生负面影响,但尚不清楚这些药物是否与双特异性抗体治疗的临床结局受损有关。
总结和未来方向
T细胞免疫疗法正在改变复发或难治性多发性骨髓瘤患者的治疗模式。本文基于最佳可用证据,提供了优化T细胞免疫疗法治疗多发性骨髓瘤的安全性和有效性的建议。然而仍需要更多的研究,尤其是指导T细胞免疫疗法的序贯使用,因为目前的建议主要基于小规模且患者群体异质性较大的研究。还需要进一步的研究来确定影响T细胞健康度的药物的最佳洗脱期,同时考虑总给药剂量对临床结局的影响。
尽管双特异性抗体现成可用,但CAR T细胞疗法的广泛应用受到多种限制,包括复杂的制造程序和产能限制,这些因素导致了较长的从静脉到静脉的等待时间以及高昂的制造成本。学术CAR T细胞产品和快速制造平台可能有助于缩短制造时间和降低成本,从而改善患者的可及性。体内CAR T细胞(在患者体内使用现成的病毒或纳米颗粒载体生成CAR T细胞)比目前用于体外CAR T细胞的制造过程更快,且可能成本更低,目前已有多种产品正在1期临床试验中进行探索,包括近日柳叶刀发表了武汉协和医院体内CAR T治疗多发性骨髓瘤的首次探索。此外,具有即时可用性的异基因CAR T细胞疗法可能允许更广泛的使用。异基因CAR T细胞可以在不需要侵入性单采的情况下给予患者,并且没有制造等待时间。目前正在进行的几项临床试验正在评估异基因CAR T细胞,包括P-BCMA-ALLO1和ALLO-715。与自体CAR T细胞相比,异基因CAR T细胞的缓解持续时间较短,这可能与持续时间较短有关(持续时间短是由于排斥反应,以及为解决移植物抗宿主病及宿主抗移植物反应所进行的基因编辑)。
预计联合策略也将进一步取得进展。正在进行的临床试验正在探索双特异性抗体与其他抗多发性骨髓瘤药物的联合使用,这些药物可以耗竭免疫抑制细胞(CD38靶向抗体)或改善T细胞健康度(IMiDs),并已显示出有前景的早期结果。一旦评估这些联合方案的随机3期试验的数据可用,T细胞免疫疗法的序贯使用应重新评估。同样,通过使用免疫调节剂或cereblon E3连接酶调节药物、双特异性抗体或CD38靶向抗体进行维持治疗,可能会提高CAR T细胞疗法的疗效。同时靶向两种肿瘤相关抗原是另一种通过防止肿瘤细胞单一抗原阴性逃逸来改善临床结果的策略。目前正在进行的临床研究正在评估多种双重靶向策略,包括两种具有不同靶点的双特异性抗体的联合使用、三特异性抗体以及双靶CAR T细胞。基于在经过重度经治多发性骨髓瘤患者中显示出的高活性,T细胞免疫疗法也在向更早期的治疗线推进,包括新诊断多发性骨髓瘤,甚至冒烟型多发性骨髓瘤。正在进行的多项大型3期研究正在评估新诊断多发性骨髓瘤中的CAR T细胞疗法。双特异性抗体也在新诊断的多发性骨髓瘤中进行研究,无论是作为诱导方案的一部分,还是作为自体干细胞移植后的新型维持策略,早期数据显示MRD阴性率接近100%。总体而言,预计这些新策略将改善多发性骨髓瘤患者的生存率。
参考文献
Lancet Haematol . 2025 Jun 25:S2352-3026(25)00117-6. doi: 10.1016/S2352-3026(25)00117-6.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#多发性骨髓瘤#
11 举报