JHO:CCR9与CD1a双靶向CAR-T细胞治疗T细胞急性淋巴细胞白血病的新突破
5小时前 吾乃喵大人 MedSci原创 发表于上海
本研究针对目前T-ALL治疗中针对T细胞自身抗原带来的自相残杀、T细胞停用及肺部造血干细胞移植依赖等问题,提出了一种创新的、安全且功能强大的CAR-T细胞治疗策略。
亮点摘要
-
首次系统鉴定CCR9在T细胞急性淋巴细胞白血病(T-ALL)患者中高表达,尤其是复发病例中的显著维持,且在正常组织中表达极低,证实其作为安全免疫治疗靶点的潜力。
-
创新开发出人源化CCR9特异性CAR-T细胞,体外及体内模型均表现出强效并且特异的抗白血病活性。
-
实现CCR9和CD1a两种非泛T抗原的双靶向CAR-T细胞策略,显著提高对白血病异质性细胞群体的覆盖,降低抗原逃逸和复发风险。
近日,Tirado 等人在Journal of Hematology & Oncology杂志发表了一项题为“CAR-T cells targeting CCR9 and CD1a for the treatment of T cell acute lymphoblastic leukemia”的研究,重点探索了CCR9这一非泛T细胞抗原在T-ALL中的表达及其作为免疫治疗靶点的可行性,并开发出以CCR9和CD1a为双靶点的CAR-T细胞,展示了其在多种T-ALL模型中的有效性和潜在临床应用价值。本研究针对目前T-ALL治疗中针对T细胞自身抗原带来的自相残杀、T细胞停用及肺部造血干细胞移植依赖等问题,提出了一种创新的、安全且功能强大的CAR-T细胞治疗策略。

T-ALL是一种侵袭性极强且具有高度异质性的血液系统恶性肿瘤,常表现为骨髓、血液及外周组织的淋巴母细胞积聚。尽管儿童患者经强化化疗治疗后治疗成功率达到80%左右,成人患者长期生存率仍低于40%,复发及难治性情况预后极差。当前缺乏针对T-ALL有效的靶向免疫治疗手段,主要因肿瘤与正常T细胞在抗原上的高度重叠,导致传统CAR-T细胞治疗面临自我残杀(fratricide)、T细胞消耗及制造过程中的肿瘤细胞污染等挑战。
CD7、CD5等泛T细胞抗原虽然是CAR-T细胞治疗的风险靶点,因自相残杀及免疫缺陷风险限制临床推广。目前,采用基因编辑技术自行敲除靶标抗原表达,或采用基因编辑阻断CAR表达来规避自相残杀,已进入临床试验阶段,但技术复杂昂贵,且需依赖异体供者及后续同种异体造血干细胞移植,增加患者负担。针对非泛T细胞抗原,如CD1a(主要表达于皮质型T-ALL,约占30%病例)及CCR9(此前报道覆盖约2/3 T-ALL病例),CAR-T细胞成为新的破局点。
然而,单一靶点抗原表达的异质性及肿瘤细胞的抗原逃逸机制依然限制治疗效果的稳定性。基于此,作者提出CCR9和CD1a双靶向CAR-T治疗策略,聚焦于全面覆盖白血病细胞群,减少单靶抗原逃逸。
研究结果
1. CCR9在T-ALL中的表达及安全性评估
研究团队对180例T-ALL患者急诊及复发时的白血病细胞进行了CCR9表达分析,发现超过70%患者CCR9阳性,复发患者中阳性率高达92%。CCR9在不同发育阶段的T-ALL细胞中均被表达,且不见于患者外周正常CD4+及CD8+ T细胞(图1)。单细胞RNA测序数据(Tabula Sapiens)和流式细胞术检测显示,CCR9在健康成人的外周血、骨髓中表达极低,除少量B细胞、胸腺细胞和肠道驻留淋巴细胞外,其他组织及造血干/祖细胞无表达,从组织分布和免疫安全性角度评估,CCR9是一个理想的靶点。
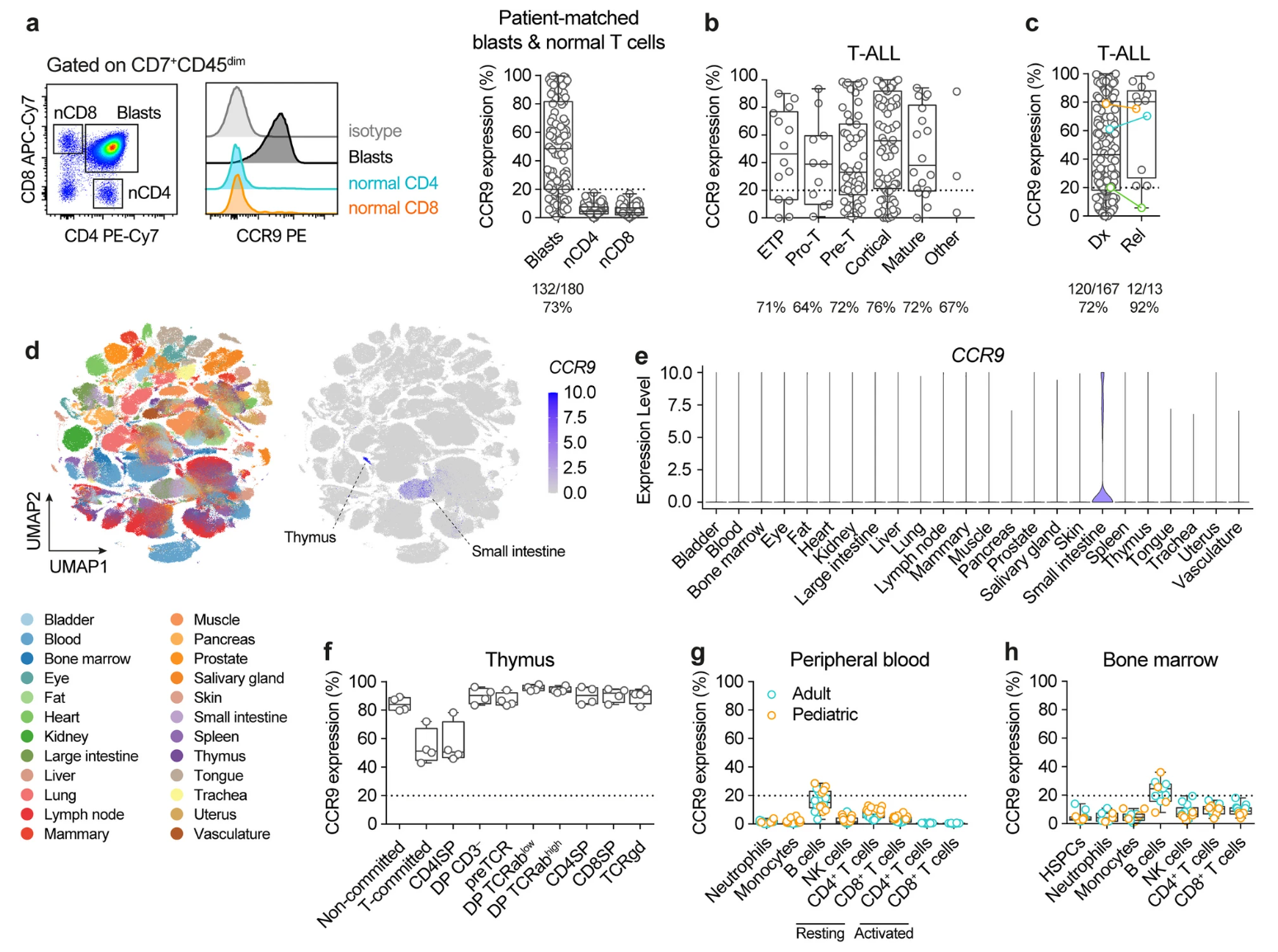
图1 CCR9表达及安全性分析
2. 人源化CCR9 CAR设计及其抗癌活性
团队依托CCR9 N端细胞外肽段制备抗体,通过杂交瘤法筛选出特异性强的克隆。经CDR移植技术完成人源化设计,获得CCR9 H2单链抗体(scFv),并构建二代CAR表达载体(图2)。转导后的CAR-T细胞表现出优异的扩增能力,无显著自相残杀。CCR9 CAR-T细胞在CCR9高表达的MOLT4和低表达的SupT1细胞系,以及两例患者来源的异种移植白血病(PDX)模型中均表现强效、特异的细胞杀伤活性。MITIVAL检测与体内异种移植小鼠模型验证其有效性,尤其是CCR9 H2 CAR-T细胞组,完全消除白血病细胞,控制疾病进展。
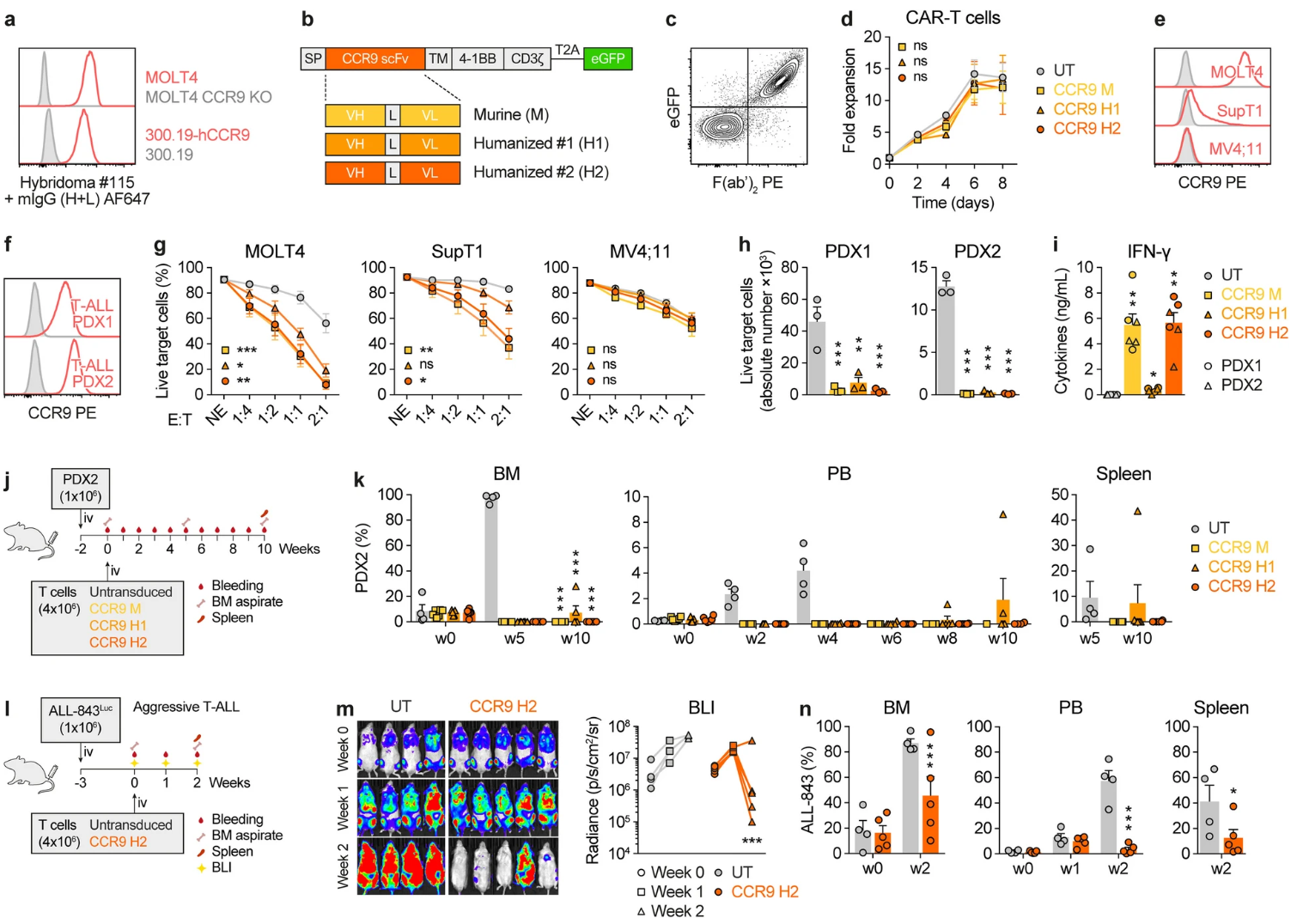
图2 CCR9 CAR-T细胞的设计及抗白血病活性
3. CCR9与CD1a在T-ALL细胞中的共表达及双靶向CAR策略的构建
通过流式检测,团队证实CD1a和CCR9两者在180例T-ALL样本中的表达呈异质分布,分别为51%和73%。两者合计覆盖率高达86%,标明大部分患者可从双靶向治疗中获益(图3)。实验中,八种串联CAR和四种双顺反子(bicistronic)CAR构建以及双载体共转导均被设计测试,结果显示串联CAR构型抗癌效能有限,多因分子空间结构限制。反之,共转导和双顺反子载体均有效。共转导CAR-T细胞在不同CCR9/CD1a组合的细胞系模型中实现了完整杀伤,验证了双靶向优于单靶向效果(图4)。
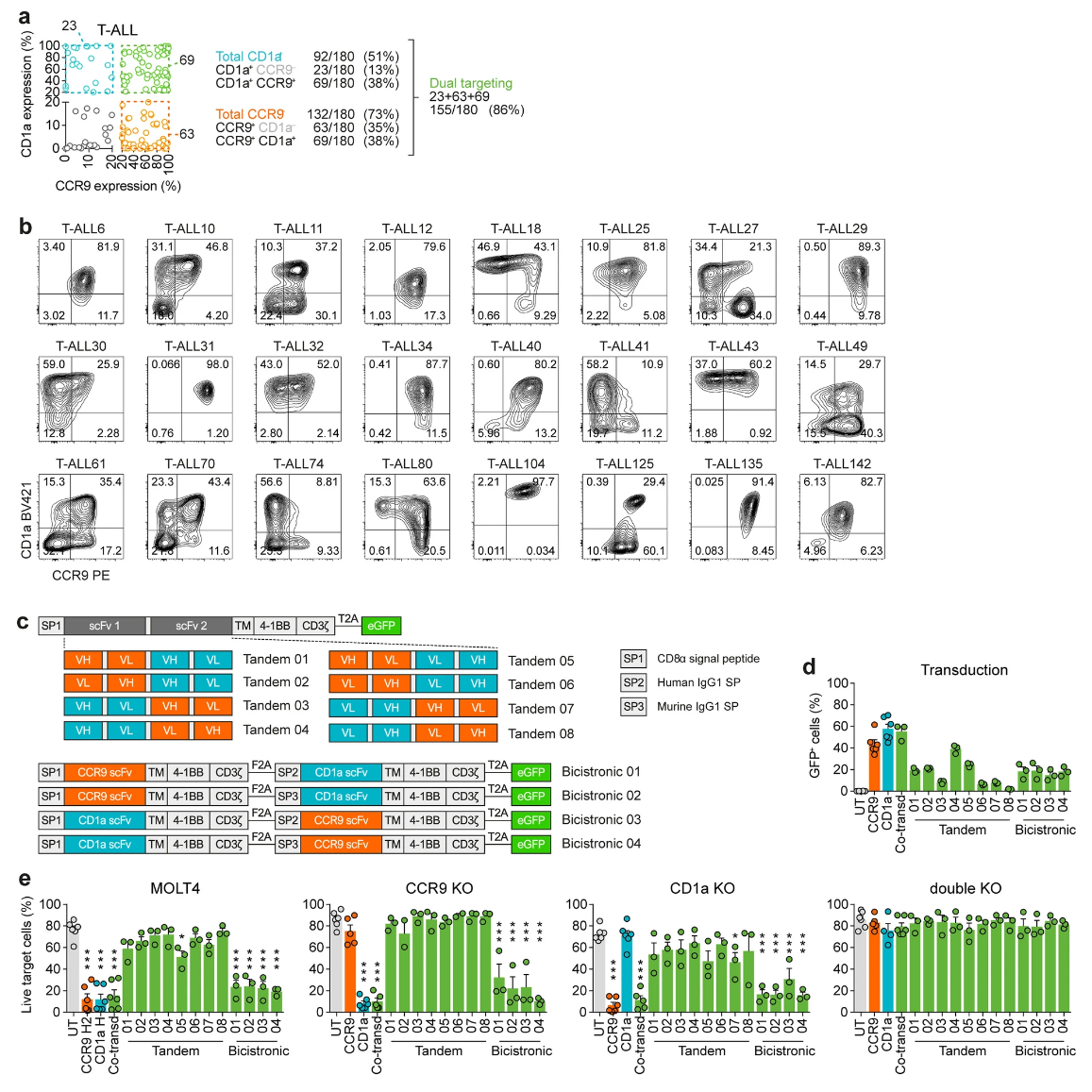
图3 CCR9/CD1a共表达及CAR结构设计
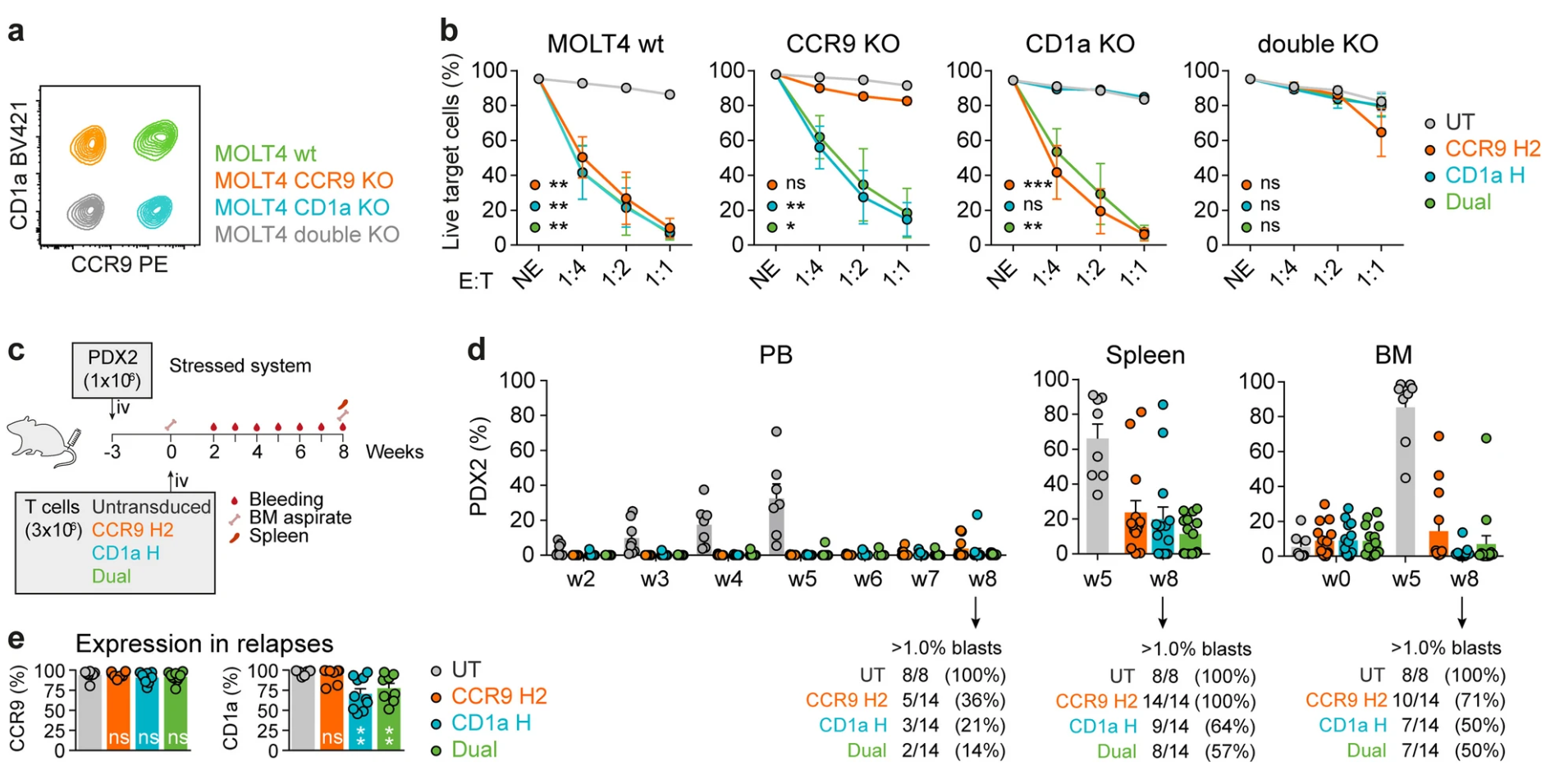
图4 双靶向CAR-T杀伤效果
4. 解决T-ALL异质性:双靶向CAR-T细胞对白血病多表型细胞群的优越疗效
模拟临床异质肿瘤状况,研究团队将CCR9和CD1a单阳性及双阳性MOLT4细胞混合作为靶细胞。结果表明,单一靶点CAR-T细胞无法消除所对应阴性靶点细胞亚群,导致残留逃逸,而双靶向CAR-T细胞则可完全消灭混合靶细胞群。体内同源模型及基因编辑所构建低表达模型同样验证了双靶向CAR的效能优势。此外,患者原代样本中不同CCR9/CD1a表达水平白血病细胞经历双靶向CAR-T细胞攻击亦表现高度杀伤活性(图5)。
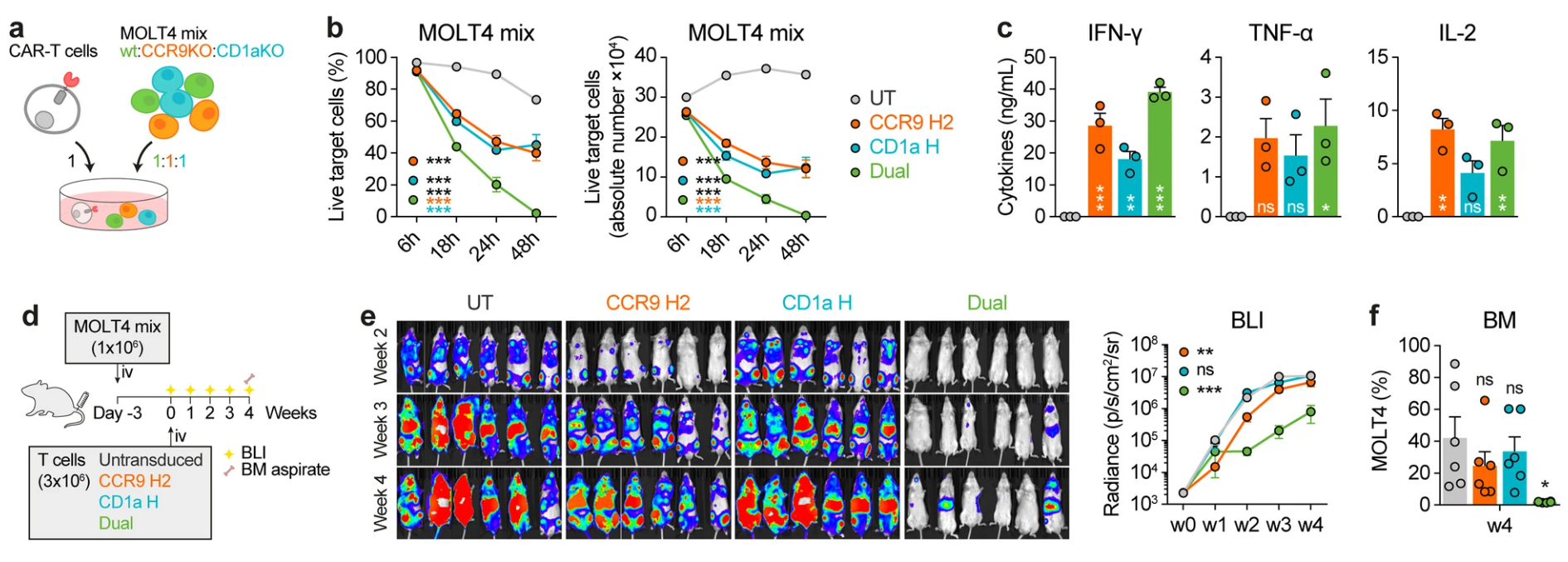
图5 双靶向CAR-T对异质性白血病群的杀伤能力
5. 临床前试验:基于患者自身T细胞构建的双靶向CAR-T细胞功能验证
针对实际临床操作难点,团队创新选择患者骨髓或外周血冷冻样本,在高白血病细胞负荷前先进行CD1a阳性细胞耗竭,再进行T细胞激活及转导。最终获得患者自身来源的CCR9/CD1a双靶向CAR-T细胞。体外实验中,这些自体CAR-T细胞对CCR9高表达的MOLT4细胞表现出高效杀伤能力,且特异性清除患者本体白血病细胞(图6),验证了临床应用可行性。
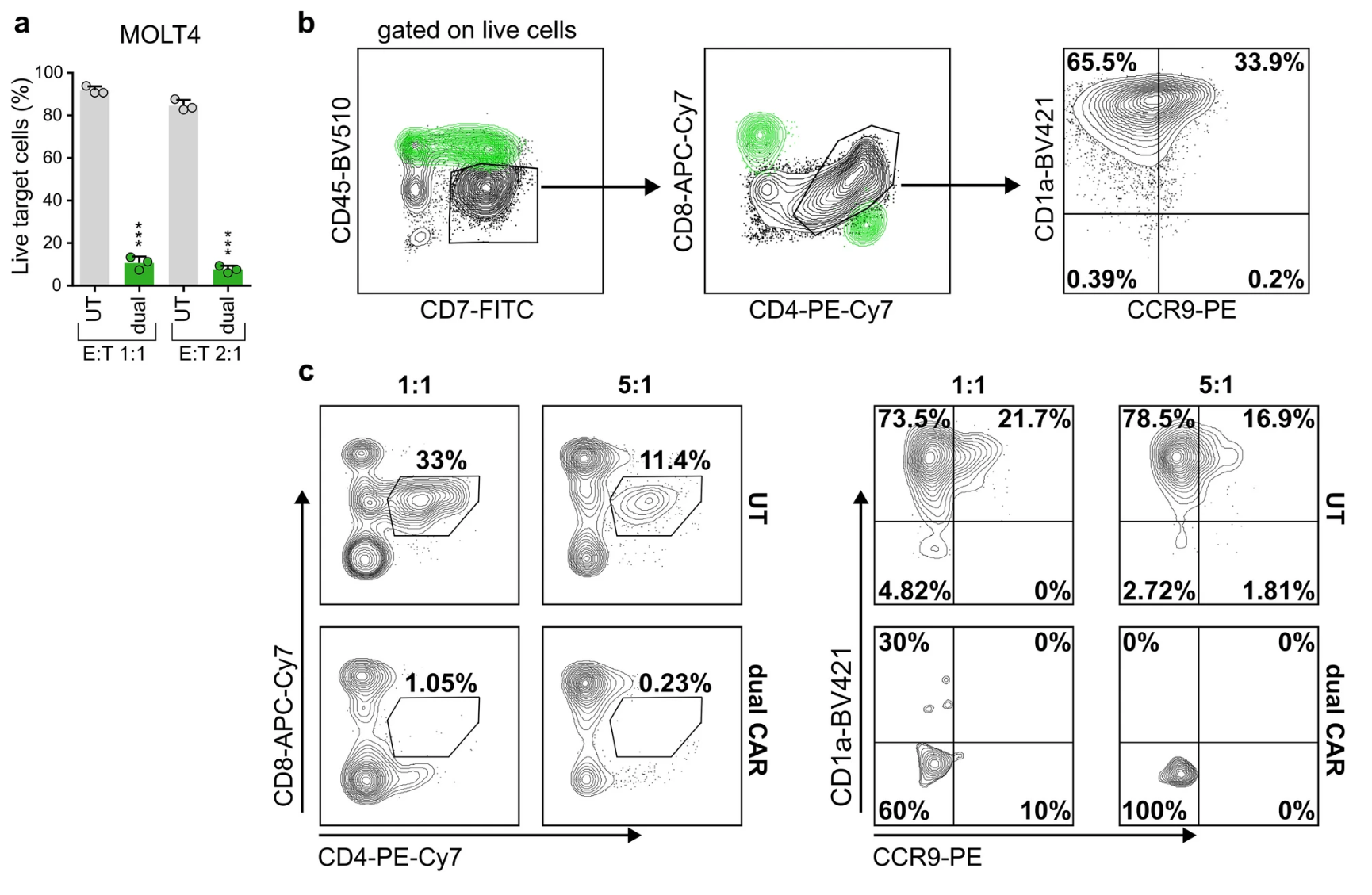
图6 患者来源CAR-T细胞对MOLT4及自体白血病细胞的杀伤活性
研究价值与意义
本研究系统证实CCR9作为T-ALL重要且安全的免疫治疗靶点,不仅在诊断期占比高,且在复发期表达保持稳定,填补了非泛T抗原靶向治疗的关键空白。开发的人源化CCR9 CAR-T细胞性能出色,无自相残杀风险,具备良好临床转化潜力。
更为重要的是,结合已在临床阶段的CD1a CAR-T细胞,双靶向策略有效克服了T-ALL复杂的表型异质性和抗原逃逸问题,大幅提升靶向覆盖范围,为解决难治复发的T-ALL患者提供了新思路。该策略不仅避免了基因编辑引发的安全性和监管障碍,也可能减少患者在治疗后的T细胞缺乏及依赖同种异体造血干细胞移植的风险。
此外,CCR9在多种肿瘤中的表达提示该靶点具备潜在的跨癌种免疫治疗价值。未来,可围绕该靶点设计更广谱的免疫细胞治疗方案,包括采用配体基(CCL25)结构化CAR等。
基于目前基因编辑技术带来的潜在染色体不稳定风险及免疫治疗的技术复杂性,本研究的无基因编辑双靶向CAR-T研发模式为T细胞肿瘤免疫治疗开创出更安全、经济、易实施的新途径,具有广阔应用前景。
梅斯小编点评
这项来自Tirado等人的前沿研究切中了T-ALL治疗的痛点——肿瘤抗原的异质性与免疫治疗的安全限制,提出的CCR9和CD1a双靶向CAR-T策略颇具创新性并展现了令人振奋的前瞻性价值。尤其是通过人源化精细设计和多角度功能验证,为CAR-T细胞疗法避开基因编辑的安全隐忧提供了范例。
随着该策略在临床试验中的推进,相信未来可望显著提升T-ALL尤其难治复发患者的治疗选择和预后。此外,该研究鼓励我们进一步挖掘其它非泛T细胞靶点的双重或多重靶向途径,推动T细胞恶性肿瘤的精准免疫疗法迈向新阶段。期待后续关于治疗耐受性、长期疗效及安全性的报道,同时也建议开展多中心、多亚型临床试验来验证其广泛适用性。
原始出处
Tirado, N., Fidyt, K., Mansilla, M.J. et al. CAR-T cells targeting CCR9 and CD1a for the treatment of T cell acute lymphoblastic leukemia. J Hematol Oncol 18, 69 (2025). https://doi.org/10.1186/s13045-025-01715-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















首次系统鉴定CCR9在T细胞急性淋巴细胞白血病(T-ALL)患者中高表达,尤其是复发病例中的显著维持,且在正常组织中表达极低,证实其作为安全免疫治疗靶点的潜力。
0 举报
#T细胞急性淋巴细胞白血病# #CCR9#
3 举报