中药复方鼎真丸的现代药理突破!Chinese Medicine发文:鼎真丸抑制cGAS-STING通路减轻帕金森病神经铁死亡
2025-06-18 清泉心田 MedSci原创 发表于上海
本研究首次系统揭示了传统中药方剂“鼎真丸”(DZP)通过抑制cGAS-STING通路,减轻帕金森病(PD)模型小鼠神经元的铁死亡与神经炎症。
研究亮点
近期发表于Chinese Medicine的研究报道,清晰展示了传统中医药方剂鼎真丸(DZP)在MPTP诱导的帕金森病小鼠模型中的神经保护作用。该工作结合了代谢组学和蛋白质组学技术,鉴定了460余种DZP的次级代谢产物及其在PD小鼠血清中的分布,且通过靶点预测与分子对接,筛选出8种具有潜在治疗效应的活性分子。这些活性成分通过抑制cGAS-STING通路,抑制了神经元的铁死亡和神经炎症,显著改善了PD小鼠的运动功能和多巴胺能神经元存活。该研究深化了对DZP多组分、多靶点作用机制的理解,促进了DZP临床转化应用的研发进程。

研究背景
帕金森病作为全球第二大常见的神经退行性疾病,发病机制复杂,目前尚未找到根治手段。其病理特征主要包括中脑黑质多巴胺能神经元退变及路易体形成,伴随神经递质失衡、线粒体功能异常、氧化应激及神经炎症等多重病理机制。目前主要药物如左旋多巴及其类似物虽能缓解症状,但长期使用存在治疗效果减弱及多种副作用,亟需发现新型安全有效的神经保护治疗策略。传统中医药因其多成分、多靶点调控优势,在PD治疗中展现良好前景。鼎真丸由多种中药组成,以其调节神经系统功能、改善多巴胺系统异常及抗氧化、抗炎作用而被关注,但其具体分子机制尚不清晰,成为本研究重点探讨的方向。
关键研究结果
1. 鼎真丸改善PD小鼠运动障碍及保护多巴胺能神经元
通过MPTP诱导PD小鼠模型,在连续口服DZP 4周后,运动能力显著提升,体现在开放场测试的活动距离与速度、转杆测试时间均优于未治疗组,震颤评分降低(图1)。免疫荧光染色结果显示,DZP治疗组黑质区酪氨酸羟化酶(TH)阳性神经元数量增加,α-突触核蛋白(α-syn)表达降低,提示神经元损伤得到减轻(图2)。

图.1 鼎真丸改善PD小鼠运动障碍
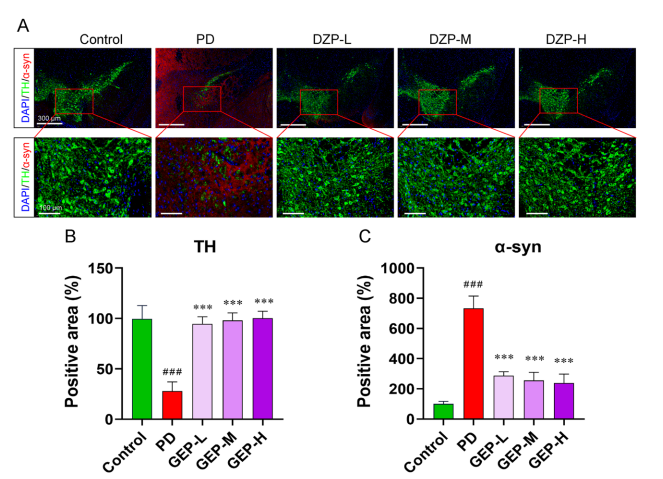
图.2 鼎真丸修复黑质多巴胺能神经元
2. 代谢组学揭示DZP中的主要活性成分及其相关信号通路
在PD小鼠血清中检测到460种DZP的次级代谢产物,其中显著上调了萜类、酚酸类及黄酮类等众多小分子(图3)。KEGG富集分析表明,这些代谢物主要参与酚丙氨酸代谢、酪氨酸代谢、神经活性配体-受体相互作用、多巴胺能突触及PD相关通路,体现其对神经系统的潜在调节作用。

图.3 鼎真丸主要活性代谢物及KEGG富集分析
3. 靶点预测与网络药理学分析锁定关键治疗靶点
通过多数据库靶点预测,筛选出1797个潜在靶点并与PD相关667个疾病靶点交叉,获得238个共同靶点,构建了成分-靶点-疾病网络(图4)。核心靶点包括TP53、AKT1、GSK3B、IL6、TNF、NFKB1等,与神经炎症和铁死亡密切相关。GO和KEGG分析提示,疗效机制主要涉及氧化应激、铁死亡及多种神经退行性疾病通路。

图.4 成分-靶点网络及核心靶点分析
4. 蛋白质组学揭示DZP调控关键蛋白与信号通路
DZP组与PD组脑组织比较,鉴定207个差异表达蛋白(87上调,120下调)
| 蛋白编码 | 基因符号 | 蛋白名称 | 表达趋势 |
|---|---|---|---|
| ATP7A | Atp7a | 铜转运ATP酶ATP7A | 上调 |
| CHRM1 | Chrm1 | 乙酰胆碱受体M1型 | 上调 |
| GSK3B | Gsk3b | 糖原合酶激酶3β | 下调 |
| SLC7A11 | Slc7a11 | 胱氨酸/谷氨酸交换体 | 上调 |
| SOD2 | Sod2 | 超氧化物歧化酶2 | 上调 |
| PSEN1 | Psen1 | 前蛋白酶体1 | 下调 |
| PTPN1 | Ptpn1 | 蛋白酪氨酸磷酸酶1 | 上调 |
| GSTM1 | Gstm1 | 谷胱甘肽S-转移酶M1 | 上调 |
差异蛋白位于细胞质和线粒体,功能关联氧化还原过程及细胞凋亡。KEGG路径分析提示DZP介入多条神经退行性病变相关通路,包括铁死亡和Parkinson病通路。
5. 分子对接验证关键成分-靶点结合及体外神经保护效应
通过分子对接分析,确定DZP中的Daidzein、Ursolic acid、Albiforin、Pinobanksin等与上述靶点具有良好结合能(表3,图5)。在MPP+诱导的神经细胞模型中,这些活性分子显著提升细胞存活率,说明其神经保护作用。
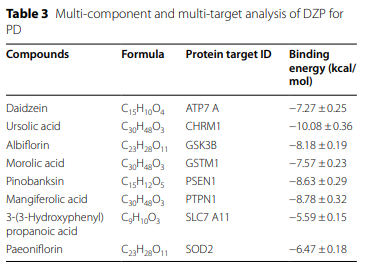
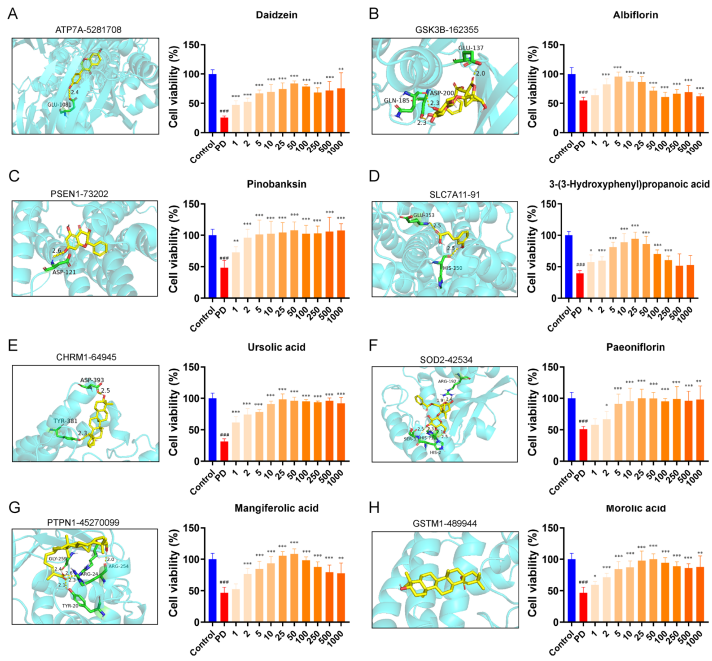
图.5 分子对接与体外神经保护验证
6. 鼎真丸通过抑制cGAS-STING通路抑制神经铁死亡和神经炎症
免疫荧光及免疫印迹示范,DZP显著抑制PD小鼠脑内cGAS及STING表达,减少星形胶质细胞活化及TNF-α释放,降低铁含量、脂质过氧化产物(MDA)及ROS水平(图6)。同时,其显著上调抗铁死亡关键蛋白GPX4、SLC7A11,降低促铁死亡蛋白ACSL4,综合抑制神经铁死亡进程。
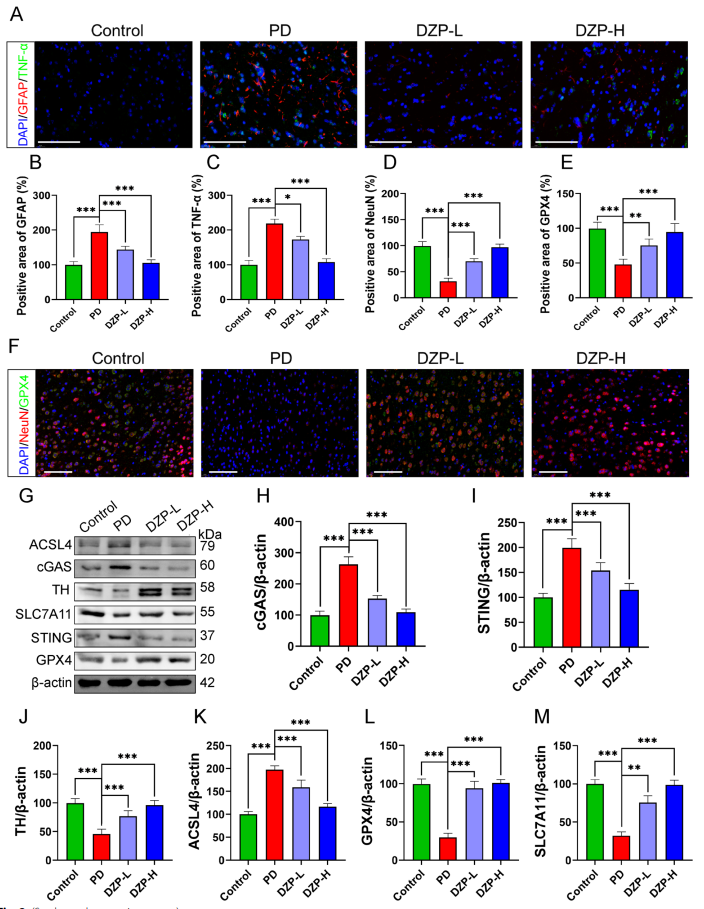
图.6 鼎真丸抑制cGAS-STING通路神经炎症及铁死亡
研究价值与意义
本研究系统整合代谢组学、蛋白质组学与网络药理学,通过多维度深入揭示了“鼎真丸”治疗帕金森病的多成分、多靶点和多通路协同机制,特别强调其通过抑制cGAS-STING介导的铁死亡和炎症反应实现神经保护的核心作用。这为中医药治疗PD提供了严密的分子基础及科学依据。以DZP为代表的复方中药,可以作为PD神经保护性治疗的候选药物,弥补现有西药以缓解症状为主的不足。更重要的是,本研究为中药成分筛选、复方药物作用机制解析及精准治疗策略设计提供了范例。同时,该研究对cGAS-STING通路在PD发病中的作用也作出了新探索,推动了PD病理机制研究的深入,促进未来相关靶向药物的研发。
梅斯编辑点评
“鼎真丸抑制cGAS-STING通路减轻帕金森病神经铁死亡”,这一研究从组学角度为传统中药配方的现代药理活性提供了坚实的科学支撑,极大丰富了我们对PD病理机制特别是铁死亡及神经炎症环节的认知。未来,可以进一步结合临床样本验证这一机制,同时利用基因编辑或动物基因敲除模型深入探讨各个关键靶点的功能作用和信号传导,进而为中药现代化开发及精准靶向治疗PD开辟新天地。
原始出处
Gaoshuang Fu1, Ting Li2, Yukun Zhao1, Shuai Zhang1, Xin Xue1, Yuqin Yang1, Tingyu Li1, Shaohan Luo1,Guangxin Yue1* and Tong Lei1*Chinese Medicine (2025) 20:87. DOI: https://doi.org/10.1186/s13020-025-01135-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#帕金森病# #鼎真丸#
18 举报