Cell子刊:上海交通大学王佳谊等发现线粒体CCN1通过脂肪酸β-氧化驱动铁死亡
2025-04-27 iNature iNature 发表于陕西省
该研究发现CCN1是一种可诱导的线粒体蛋白,它能增强FAO依赖性铁死亡,这为基于铁死亡的癌症治疗提供了重要的见解。
铁死亡是一种氧化细胞死亡,尽管其关键代谢过程仍未完全了解。
2025年4月24日,上海交通大学王佳谊、于永春、得克萨斯大学西南医学中心唐道林在Developmental Cell(IF=10.7)在线发表题为“Mitochondrial CCN1 drives ferroptosis via fatty acid β-oxidation”的研究论文,该研究发现线粒体CCN1通过脂肪酸β-氧化驱动铁死亡。总之,该研究发现CCN1是一种可诱导的线粒体蛋白,它能增强FAO依赖性铁死亡,这为基于铁死亡的癌症治疗提供了重要的见解。

铁死亡是一种细胞死亡的非凋亡机制,以铁积累和广泛的脂质过氧化为特征。这一过程破坏氧化还原平衡,并受到分子途径的可变调节。经典诱导剂,如erastin和(1S,3R)-RSL3 (RSL3)靶载体家族7成员11 (SLC7A11)和谷胱甘肽过氧化物酶4 (GPX4)抑制抗氧化防御,增强铁死亡在克服耐药性癌症和增强免疫治疗和放射治疗效果中的效用。铁死亡途径的异质性强调了识别调节剂以促进治疗策略的重要性。
线粒体功能障碍导致氧化应激和铁死亡,铁代谢、三羧酸循环和电子传递链(ETC)活动增加了铁死亡的易感性。相反,增强线粒体抗氧化防御抑制铁死亡。线粒体脂肪酸(FA)β-氧化(FAO)在铁死亡中起着双重作用。尽管FAO产生的活性氧(ROS)可促进脂质过氧化,FAO还可通过降解脂质过氧化的关键底物多不饱和脂肪酸(PUFAs)来防止铁死亡。非正常线粒体分子,通常为线粒体外分子,可在铁死亡期间重新定位至线粒体并发挥意想不到的功能,尽管其具体作用和调节机制尚不清楚。
细胞通讯网络因子1 (CCN1)是一种基质细胞蛋白,通过与整合素和硫酸乙酰肝素蛋白聚糖的相互作用来调节细胞粘附、增殖和凋亡。CCN1还调节氧化应激和脂质代谢,其表达在缺氧条件下增加,从而增加ROS的产生并改变线粒体形态。这些功能强调了CCN1对代谢性疾病的治疗潜力。
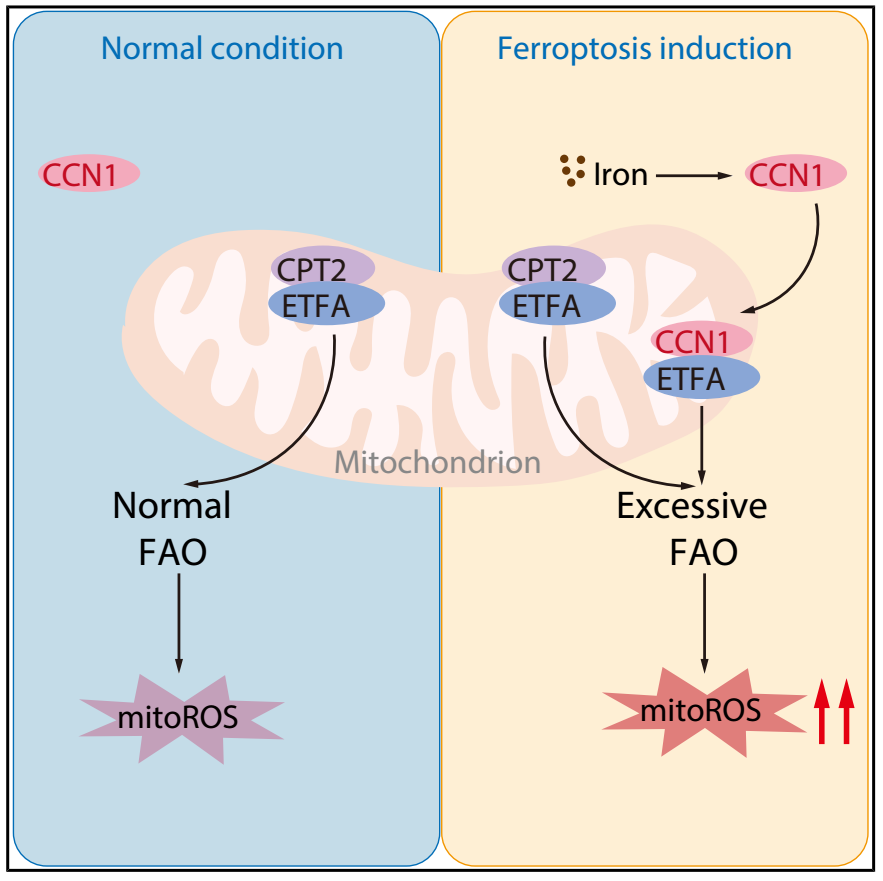
机理模式图(图源自Developmental Cell)
在这里,研究人员采用了一种综合的多组学筛选方法,确定细胞通讯网络因子1 (CCN1)是铁死亡的代谢催化剂。在铁死亡诱导时,CCN1重新定位于线粒体复合物,促进电子转移黄素蛋白亚单位α(ETFA)依赖性脂肪酸β氧化。与传统的肉碱O-棕榈酰转移酶2 (CPT2)-ETFA途径相比,CCN1-ETFA途径为线粒体活性氧产生提供了额外的底物,从而通过脂质过氧化刺激铁死亡。高脂饮食可增强肺癌小鼠模型中铁死亡的抗癌功效,这依赖于CCN1。此外,来源于高甘油三酯血症或高CCN1表达患者的原发性肺癌细胞在体外和体内表现出对铁死亡的易感性增加。这些发现不仅确定了线粒体CCN1的代谢作用,而且建立了一种增强基于铁死亡的抗癌疗法的策略。
参考信息:
https://www.cell.com/developmental-cell/fulltext/S1534-5807(25)00206-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#铁死亡# #CCN1#
0