Gut Microbes:IBD发病的遗传 - 微生物互相作用,PTPN2 变异推动AIEC 入侵肠上皮
4小时前 熊佳仪 MedSci原创 发表于上海
本研究创新性地揭示了IBD风险基因PTPN2的功能变异如何通过JAK-STAT信号通路调节肠上皮细胞CEACAM6的表达,进而驱动AIEC菌株的黏附及肠上皮侵袭。
炎症性肠病(IBD)主要包括克罗恩病(CD)及溃疡性结肠炎(UC),临床表现为消化道慢性复发性炎症。研究证实,IBD发病过程系遗传易感性、环境因素及肠道菌群失调的复杂交互结果。基因组关联研究(GWAS)发现逾240个与IBD相关的基因,其中PTPN2基因的rs1893217 SNP与IBD发病风险显著相关。PTPN2基因编码的蛋白酪氨酸磷酸酶TCPTP属于负调节JAK-STAT信号的关键因子,其功能障碍可能导致免疫过度活化及肠道屏障功能受损。此前研究显示,PTPN2基因失活模型(Ptpn2-KO小鼠)表现出肠道菌群失衡,尤其是AIEC菌株显著扩增。CEACAM6是肠上皮表面的糖蛋白受体,被AIEC利用以黏附及进入肠上皮细胞,成为介导菌株侵染的核心分子。迄今虽知PTPN2参与肠道菌群菌落调控,但其肠上皮特异作用机理及与AIEC侵袭关系尚不明确。
近期,发表在Gut Microbes杂志的一项研究,围绕IBD相关易感基因PTPN2的rs1893217单核苷酸多态性(SNP)与肠道微生物相互作用进行了深入解析。研究揭示PTPN2变异通过激活JAK-STAT信号轴,诱导肠上皮细胞表面趋化蛋白CEACAM6表达上调,促进AIEC的肠上皮黏附及侵袭机制,且临床应用药物托法替尼(tofacitinib)对此过程具备干预潜力。
 研究基于IBD患者肠道活检样本的免疫组化检测,结合基因编辑技术在培养的人肠上皮细胞系(HT-29、Caco-2BBe)中构建了PTPN2敲低、敲除及携带rs1893217 SNP的细胞系模型。通过细菌附着、内侵实验评估AIEC感染能力,辅以IL-6及托法替尼处理,探讨JAK-STAT信号通路调控机制。多通道免疫荧光、西方印迹及RNA测序技术被广泛应用,进一步解析蛋白表达及信号活化状态。
研究基于IBD患者肠道活检样本的免疫组化检测,结合基因编辑技术在培养的人肠上皮细胞系(HT-29、Caco-2BBe)中构建了PTPN2敲低、敲除及携带rs1893217 SNP的细胞系模型。通过细菌附着、内侵实验评估AIEC感染能力,辅以IL-6及托法替尼处理,探讨JAK-STAT信号通路调控机制。多通道免疫荧光、西方印迹及RNA测序技术被广泛应用,进一步解析蛋白表达及信号活化状态。
主要结果
1、PTPN2 rs1893217 SNP与肠上皮CEACAM6表达升高的关联
在IBD患者结肠活检中,携带rs1893217 SNP(CT与CC型)的患者,相较野生型(TT)显示肠上皮细胞表面CEACAM6显著过表达(见图1),而该差异在回肠未见明显。HT-29肠上皮细胞系中PTPN2敲低也导致CEACAM6 mRNA及蛋白表达显著增加,提示PTPN2调控CEACAM6表达存在直接关联。
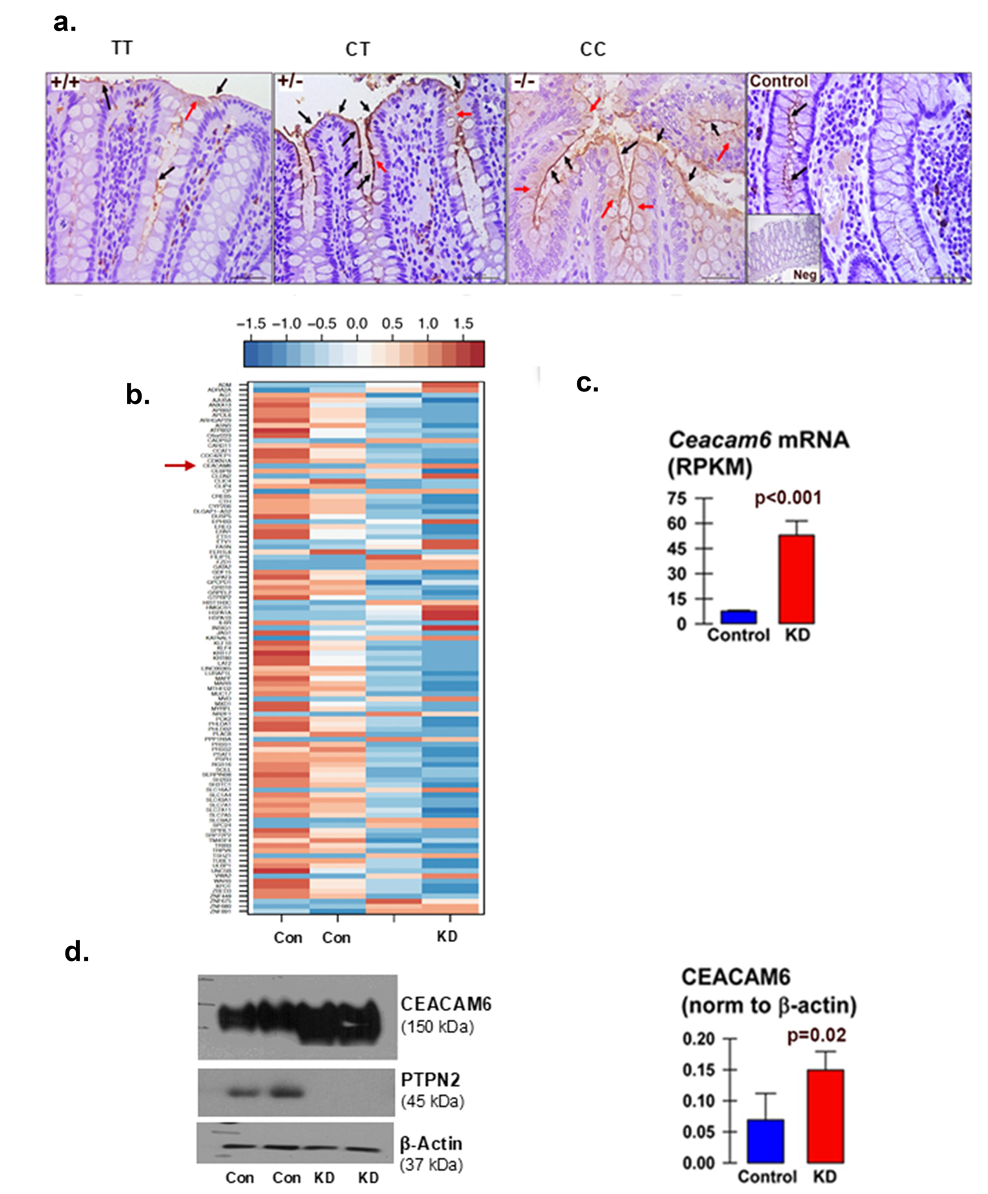
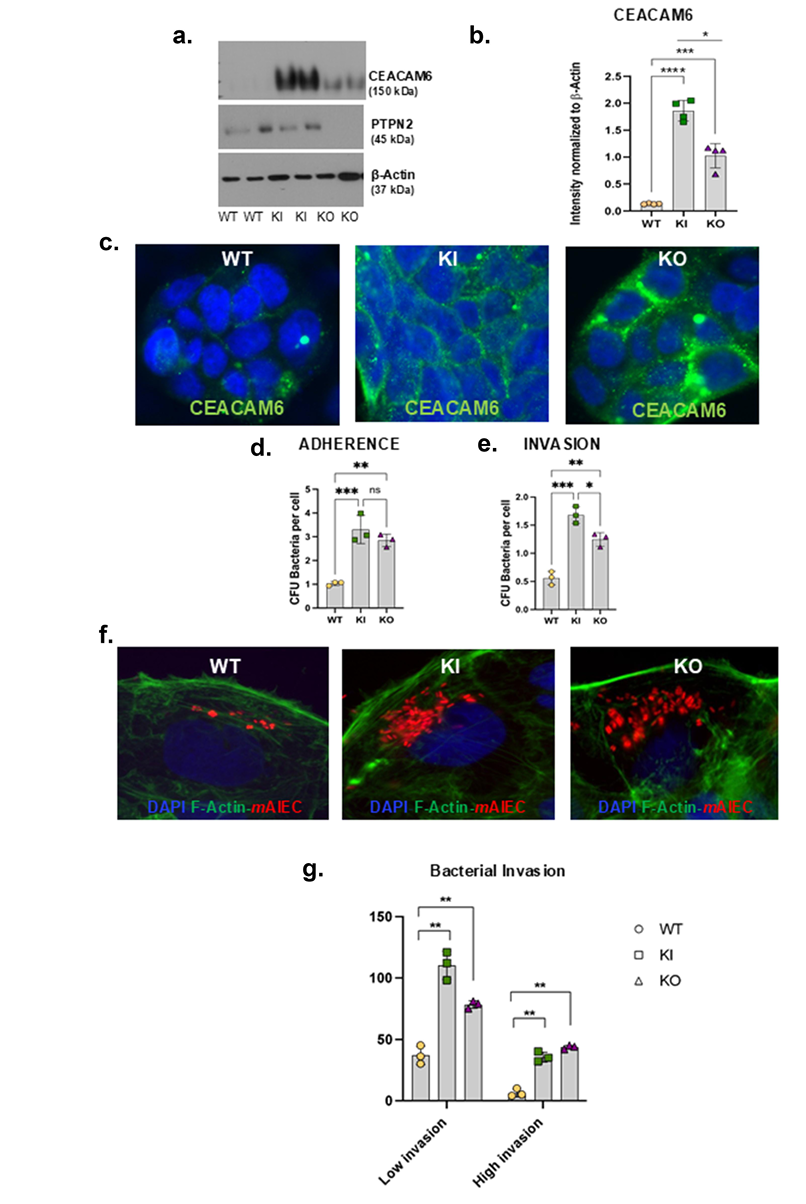
2、PTPN2功能缺失增强AIEC黏附及入侵
利用CRISPR-Cas9构建的Caco-2BBe细胞模型,携带PTPN2 rs1893217 SNP(KI型)或PTPN2基因敲除(KO型)细胞,均表现出CEACAM6蛋白表达显著超过野生型(WT)细胞,且主要定位于细胞膜表面(见图2c)。功能性检测显示,PTPN2-KI及KO细胞对AIEC LF82菌株的黏附及内侵能力均提升2倍以上(见图2d,e),用针对CEACAM6的阻断抗体介入后,可显著减弱细菌入侵,确证了CEACAM6介导的关键作用。
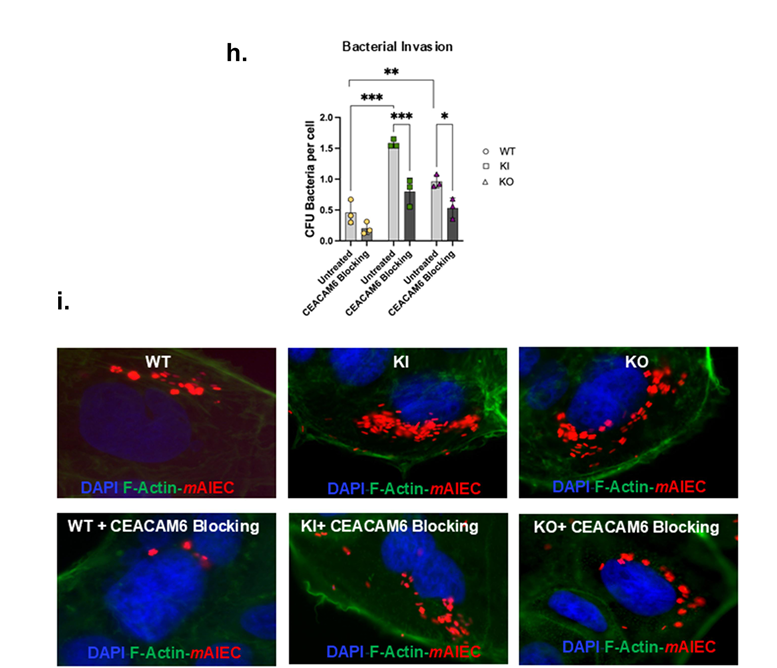
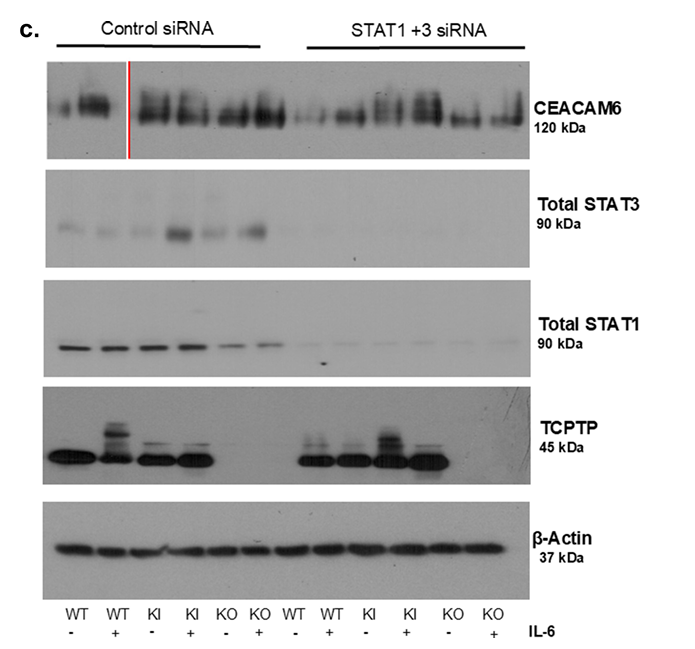
3、IL-6促进PTPN2缺陷细胞CEACAM6表达,STAT1/3介导功能被揭示
IL-6刺激下,PTPN2-KI和KO细胞的STAT3及STAT1磷酸化程度明显增强(见图3a),伴随CEACAM6表达进一步升高。STAT1与STAT3联合沉默可部分抑制CEACAM6蛋白上调,表明该表达受JAK-STAT通路调控,特别是STAT1/3的协同作用。
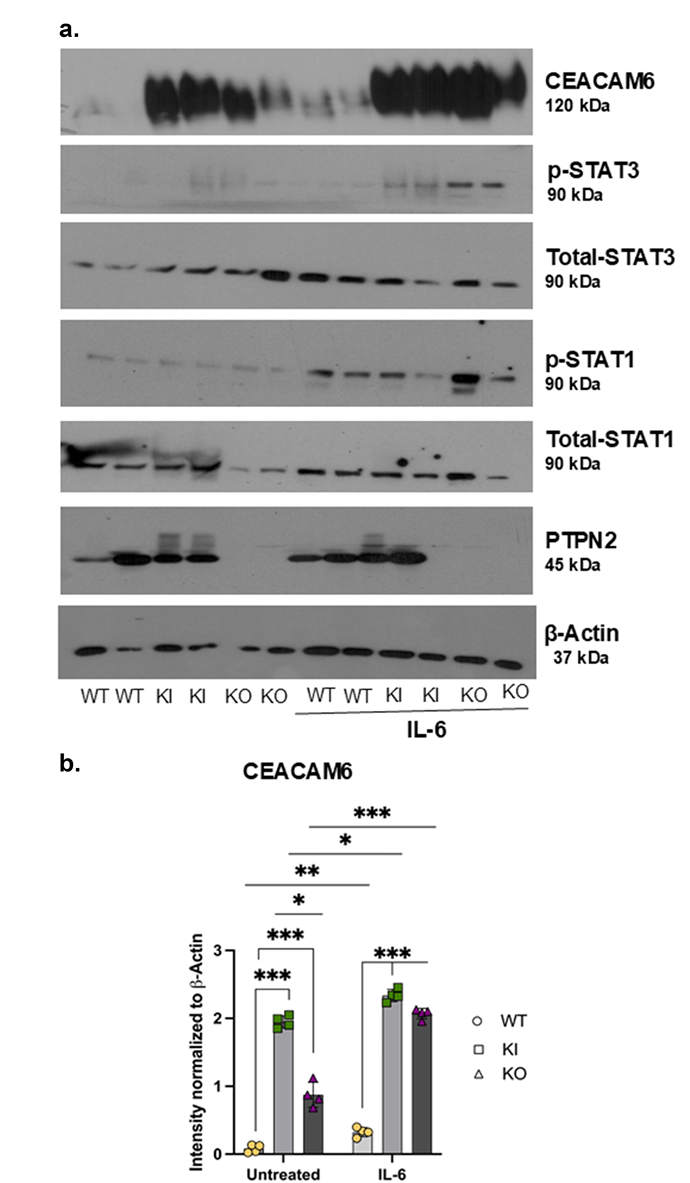
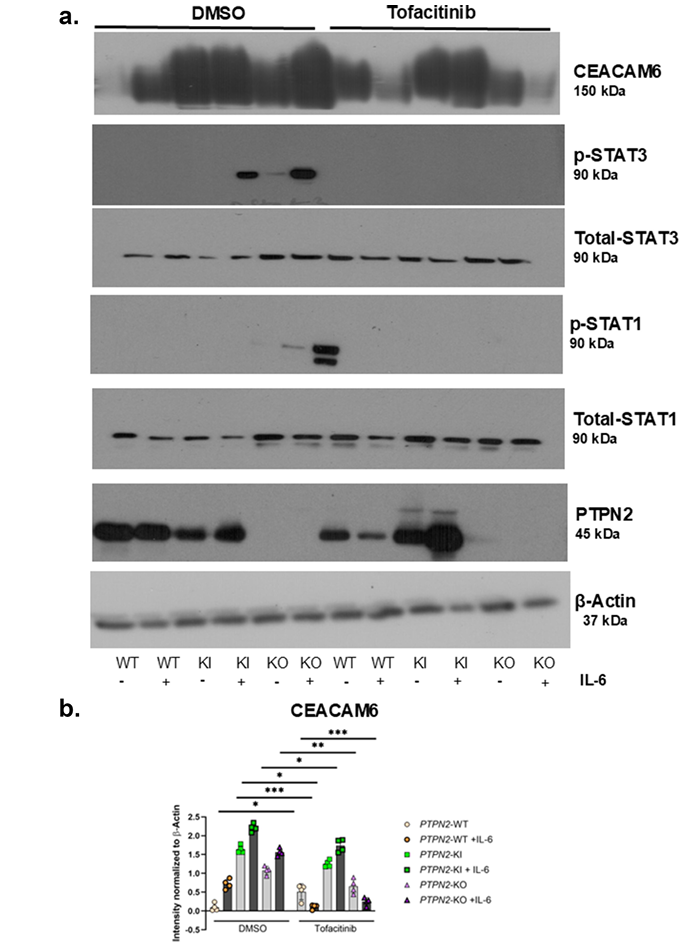
4、托法替尼抑制JAK-STAT信号及CEACAM6表达,减少AIEC感染
托法替尼处理可有效降低PTPN2-KI及KO细胞的STAT1/3磷酸化水平,同时显著抑制CEACAM6蛋白表达(见图4a,b,c)。托法替尼作用下,AIEC菌株对PTPN2变异细胞的黏附和入侵均有明显下降,恢复制御能力,提示JAK抑制剂可作为干预AIEC肠上皮入侵的潜在治疗手段。
讨论
本研究创新性地揭示了IBD风险基因PTPN2的功能变异如何通过JAK-STAT信号通路调节肠上皮细胞CEACAM6的表达,进而驱动AIEC菌株的黏附及肠上皮侵袭,这为理解IBD发病的遗传-微生物交互机制提供了重要分子依据。CEACAM6此前被认为是AIEC特异性受体,本研究则明确PTPN2基因的缺失或变异增强了该受体的表达,提示PTPN2作为肠上皮微生物屏障的关键调控因子。此外,托法替尼作为JAK抑制剂显示可以有效逆转该受体过表达及病原入侵,揭示其在IBD个体化治疗中尤其是携带PTPN2功能变异患者中的应用潜力。该研究不仅丰富了IBD遗传学患者亚群的病理理解,也为靶向病理菌群入侵提供创新治疗思路。
原始出处
Chatterjee P, Canale V, King SJ, et al. The PTPN2 rs1893217 IBD risk allele increases susceptibility to AIEC invasion by a JAK-STAT-CEACAM6 axis. Gut Microbes. 2025;17(1):2526136. doi:10.1080/19490976.2025.2526136
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#炎症性肠病# #PTPN2# #AIEC#
4 举报