Nat Aging:温州医科大学宋伟宏等揭示GLP-1受体激动剂防治阿尔茨海默病新机制
7小时前 iNature iNature 发表于上海
该研究证明了GLP-1受体激动剂可以通过激活5'腺苷酸激活蛋白激酶(AMPK)信号来缓解AD相关的表型。
患有二型糖尿病病的人患阿尔茨海默病病(AD)的风险增加。GLP-1受体激动剂(GLP-1受体激动剂)用于糖尿病的血糖控制,并显示出潜在的神经保护特性,但它们对AD的作用和潜在机制尚未完全了解。
2025年5月20日,温州医科大学宋伟宏、南京大学张韵在Nature Aging在线发表题为“Activation of AMPK by GLP-1R agonists mitigates Alzheimer-related phenotypes in transgenic mice”的研究论文,该研究证明了GLP-1受体激动剂可以通过激活5'腺苷酸激活蛋白激酶(AMPK)信号来缓解AD相关的表型。
研究发现血浆GLP-1水平在AD模型小鼠中降低,在AD患者中与淀粉样β蛋白(Aβ)负荷呈负相关。通过GLP-1受体增强GLP-1信号传导增加了CaMKK2-AMPK信号传导,这随后减少了BACE1介导的淀粉样前体蛋白(APP)的裂解和Aβ的产生。GLP-1受体激动剂还增加小胶质细胞的AMPK活性,抑制神经炎症,促进Aβ吞噬作用。因此,GLP-1受体拮抗剂抑制了斑块的形成,并改善了AD模型小鼠的记忆缺陷。该发现表明AMPK激活介导了GLP-1受体激动剂对AD的作用,突出了GLP-1受体激动剂对AD的治疗潜力。

阿尔茨海默病(AD)是最常见的痴呆症,神经炎斑块、神经原纤维缠结和神经元丢失是AD神经病理学的标志。淀粉样β (Aβ)蛋白是斑块的主要成分,由β-分泌酶和γ-分泌酶裂解淀粉样前体蛋白(APP)产生。β位点APP裂解酶1 (BACE1)是β分泌酶,在Aβ结构域内的两个β位点Asp+1和Glu+11裂解APP,分别产生膜结合APP C末端片段(CTF)C99和C89。随后,γ分泌酶裂解C99,导致Aβ和CTFγ的释放。
患有二型糖尿病病(T2DM)的人患AD的风险增加。大脑中葡萄糖稳态受损在AD发病机制中起着重要作用。个体可能在阿尔茨海默病症状出现前10年以上出现胰岛素抵抗和糖代谢受损,这表明胰岛素抵抗和糖代谢可以作为该疾病早期诊断的生物标志物。受损的胰岛素信号和高葡萄糖也会破坏APP的加工和Aβ的清除。神经元葡萄糖摄取减少与tau蛋白的过度磷酸化、受损的突触可塑性、神经递质的缺乏和炎症级联反应的启动有关,从而导致神经退行性疾病。这些发现提高了抗糖尿病药物治疗AD1的可能性。
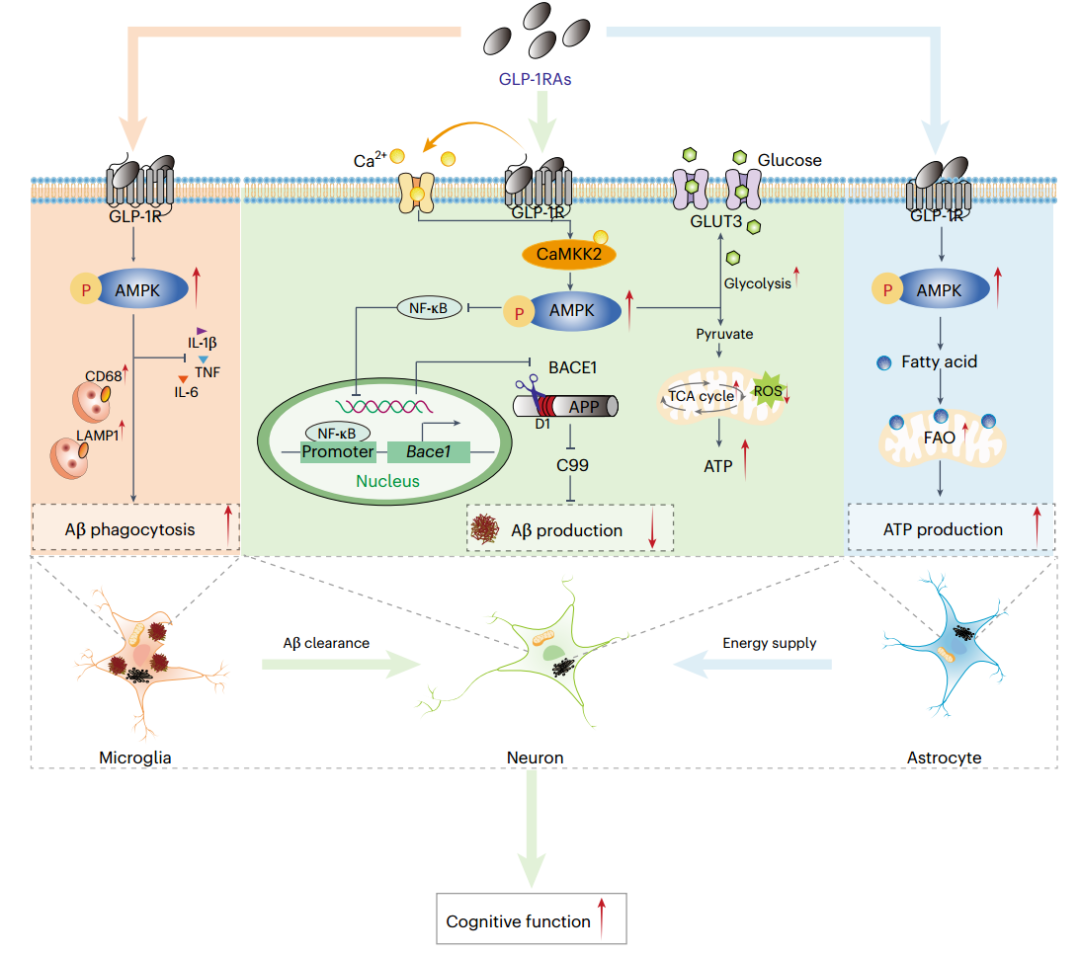
机理模式图(图源自Nature Aging)
在该研究中,研究人员发现AD患者的GLP-1水平降低,血浆GLP-1水平与AD患者的脑能量代谢和神经病理学之间存在相关性。施用GLP-1RAs增加钙/钙调素依赖性蛋白激酶激酶(CaMKK)活性,其进一步激活5’AMP-激活的蛋白激酶(AMPK)信号,以增加脑细胞中的脂肪酸氧化(FAO)、氧化磷酸化(OXPHOS)、糖酵解和三磷酸腺苷(ATP)合成。GLP-1RA诱导的AMPK激活通过核因子κB(NF-κB)信号调节BACE1表达来减少Aβ的产生。GLP-1受体激动剂通过激活小胶质细胞中的AMPK促进Aβ吞噬。因此,GLP-1RA治疗减少了AD转基因小鼠的神经炎性斑块形成并改善了认知缺陷,提供了通过GLP-1RA激活AMPK可能是AD的有效治疗策略的证据。
参考信息:
https://www.nature.com/articles/s43587-025-00869-3#Sec38
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#阿尔茨海默病# #GLP-1受体激动剂#
5