【指南与共识】|抗EGFR单抗联合免疫检查点抑制剂治疗头颈部鳞状细胞癌专家共识(2025年版)
19小时前 中国癌症杂志 中国癌症杂志 发表于上海
本共识能够为临床医师提供更为明确和实用的指导,进一步推动该联合方案在临床实践中的合理应用,为HNSCC患者提供更多的治疗选择。
[摘要] 头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是头颈部肿瘤最为常见的一种类型,其治疗效果及患者的预后并不理想,随着抗表皮生长因子受体(epidermal growth factor receptor,EGFR)单抗和免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的广泛应用,HNSCC患者的生存期虽有所延长但仍存在较大的改善空间。近年来多项研究提示,抗EGFR单抗联合ICIs治疗可带来良好的效果及安全性,已获得美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)和中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)等发布的权威性指南推荐。然而,抗EGFR单抗联合ICIs治疗方案的应用仍处于早期探索阶段,如何在临床中规范使用仍存在诸多待解答的问题,包括其协同作用机制、在不同类型患者中的治疗价值及安全性等。CSCO头颈肿瘤专家委员会组织专家基于循证医学证据及临床实践探索,经过多轮讨论,最终形成《抗EGFR单抗联合免疫检查点抑制剂治疗头颈部鳞状细胞癌专家共识(2025年版)》,对抗EGFR单抗与ICIs联合治疗的作用机制、分层治疗、在特殊人群中的应用及安全性等方面提出指导建议。本共识已在国际实践指南注册与透明化平台(Practice guideline REgistration for transPAREncy,PREPARE)上注册,注册号为PREPARE-2025CN666。期望本共识能够为临床医师提供更为明确和实用的指导,进一步推动该联合方案在临床实践中的合理应用,为HNSCC患者提供更多的治疗选择。
[关键词] 头颈部鳞状细胞癌;抗表皮生长因子受体单抗;免疫检查点抑制剂;联合治疗;安全性;专家共识
[Abstract] Head and neck squamous cell carcinoma (HNSCC) is the most common type of head and neck cancer, and its treatment prognosis remains suboptimal. Although the survival of HNSCC patients has improved with the widespread use of anti-epidermal growth factor receptor (EGFR) monoclonal antibodies and immune checkpoint inhibitors (ICIs), there is still significant room for further improvement. Recent studies have suggested that the combination of anti-EGFR monoclonal antibodies and ICIs offers promising efficacy and safety, earning recommendations from authoritative guidelines such as the National Comprehensive Cancer Network (NCCN) and the Chinese Society of Clinical Oncology (CSCO). However, the application of this combination therapy is still in the early exploratory stage, numerous questions regarding the standardized clinical use of this combination therapy remain unanswered, including the mechanisms of synergy associated with the combination treatment, its therapeutic value in different patient populations, and safety considerations. Committee of Head and Neck Cancer, Chinese Society of Clinical Oncology organized an expert panel to develop “Expert consensus on the combination of anti-EGFR monoclonal antibodies and immune checkpoint inhibitors in the treatment of head and neck squamous cell carcinoma (2025 edition)”, based on evidence-based medicine and clinical practice exploration through multiple rounds of discussions. This consensus addressed the mechanisms of the combination of anti-EGFR monoclonal antibodies and ICIs, stratified treatment approaches, applications in special populations, and safety considerations. The consensus has been registered on Practice guideline REgistration for transPAREncy (PREPARE) with the registration number PREPARE-2025CN666. It is hoped that this consensus will provide clearer and more practical guidance for clinicians, further promoting the rational application of this combination therapy in clinical practice and offering more treatment options for HNSCC patients.
[Key words] Head and neck squamous cell carcinoma; Anti-epidermal growth factor receptor monoclonal antibodies; Immune checkpoint inhibitors; Combination treatment; Safety; Expert consensus
《抗EGFR单抗联合免疫检查点抑制剂治疗头颈部鳞状细胞癌专家共识(2025年版)》
专家组
组 长
-
胡超苏 | 复旦大学附属肿瘤医院放疗科
-
郭 晔 | 同济大学附属东方医院肿瘤科
执笔人
-
薛丽琼 | 同济大学附属东方医院肿瘤科
-
许婷婷 | 复旦大学附属肿瘤医院放疗科
编 委
(以姓名汉语拼音字母为序)
-
曹国春 | 江苏省肿瘤医院肿瘤内科
-
陈晓钟 | 浙江省肿瘤医院放疗科
-
方美玉 | 浙江省肿瘤医院头颈及罕见肿瘤内科
-
冯 梅 | 四川省第三人民医院肿瘤科
-
桂 琳 | 中国医学科学院肿瘤医院肿瘤内科
-
韩 非 | 中山大学肿瘤防治中心放疗科
-
韩亚骞 | 湖南省肿瘤医院头颈放疗科
-
郝春成 | 哈尔滨医科大学附属肿瘤医院头颈放疗科
-
胡 漫 | 山东第一医科大学附属肿瘤医院头颈放疗科
-
黄文孝 | 湖南省肿瘤医院头颈外科
-
季冬梅 | 复旦大学附属肿瘤医院肿瘤内科
-
江 浩 | 蚌埠医科大学第一附属医院放疗科
-
林少俊 | 福建省肿瘤医院放疗科
-
刘 磊 | 四川大学华西医院头颈肿瘤科
-
刘志刚 | 南方医科大学第十附属医院(东莞市人民医院)肿瘤中心
-
陆海军 | 青岛大学附属医院肿瘤放疗科
-
曲 颂 | 广西医科大学附属肿瘤医院放疗科
-
任国欣 | 上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科
-
宋 明 | 中山大学肿瘤防治中心头颈科
-
王佩国 | 天津医科大学肿瘤医院放疗科
-
王孝深 | 复旦大学附属眼耳鼻喉科医院放疗科
-
杨坤禹 | 华中科技大学同济医学院附属协和医院肿瘤中心
-
于爱民 | 苏北人民医院耳鼻咽喉头颈外科
-
张 杰 | 北京大学口腔医院口腔颌面外科
-
张石川 | 四川省肿瘤医院放疗中心
-
张欣欣 | 中国人民解放军总医院第一医学中心头颈外科
-
张 烨 | 中国医学科学院肿瘤医院放疗科
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是头颈部肿瘤最为常见的一种类型,常发生于口腔、咽部和喉部等部位,具有高度的异质性。国家癌症中心最新统计数据[1]显示,2022年中国头颈部肿瘤新增患者数达14.56万例,死亡患者数达8.05万例,占癌症总死亡人数的3.1%,居所有癌症种类的第7位。由于HNSCC的发病部位隐蔽,早期症状不典型,大多数患者在确诊时已处于局部晚期。即便采用多模式治疗,局部晚期HNSCC(locally advanced HNSCC,LA HNSCC)患者的整体预后不良,5年生存率仅为30%~50%,并且有50%~60%的LA HNSCC患者在2年内会发生复发或远处转移[2]。随着抗表皮生长因子受体(epidermal growth factor receptor, EGFR)单抗和免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的广泛应用,复 发/转移性HNSCC(recurrent/metastatic HNSCC,R/M HNSCC)患者的中位总生存期(overall survival,OS)达12~15个月,但仍有较大的改善空间[3]。
对于R/M HNSCC的一线治疗,基于EXTREME、TPEXTREME、CHANGE-2研究[4-7]数据,西妥昔单抗联合化疗成为一线标准治疗方案。其后,KEYNOTE-048研究[8]结果显示,帕博利珠单抗单药或联合化疗,分别在程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)联合阳性评分(combined positive score,CPS)≥1的患者群和全人群中对比EXTREME方案显示出OS的优势,从而促使免疫治疗也成为目前R/M HNSCC的一线标准治疗方案选择。然而,免疫治疗仍然存在以下3个问题,部分限制了其在临床上的广泛应用[9]。首先,对于CPS为1~19的患者,经帕博利珠单抗单药治疗的患者的OS与接受EXTREME方案治疗的患者的OS类似,但无进展生存(progression-free survival,PFS)和总体缓解率(overall response rate,ORR)明显较差。其次,对于CPS<1的患者,帕博利珠单抗联合化疗组患者的OS与EXTREME方案组的结果类似,但PFS和ORR仍处于劣势。最后,在均联合化疗的条件下,帕博利珠单抗和西妥昔单抗两组的≥3级不良反应的发生率并无显著差异(85% vs 83%),虽然帕博利珠单抗单药的安全性具有明显优势,但似乎最佳的获益人群多局限为CPS≥20的患者。
对于R/M HNSCC的二线治疗,纳武利尤单抗和帕博利珠单抗分别基于CheckMate-141和KEYNOTE-040研究[10-11]成为目前的标准治疗方案。但由于ICIs的治疗前移,对于一线接受过ICIs治疗的患者,目前缺乏标准的后续治疗方案。以往对于一线铂类药物治疗失败的患者,西妥昔单抗是常用的挽救治疗药物[12]。近期的两项前瞻性Ⅱ期临床研究[13-14]提示,对于一线ICIs治疗失败的患者,西妥昔单抗联合紫杉醇具有很好的挽救治疗效果,患者的中位OS达14个月。此外,对于在局部晚期多模式治疗阶段接受过铂类药物治疗并且在6个月内疾病进展的患者,通常被定义为铂类药物耐药人群。针对这部分患者,一线治疗的临床试验通常会予以排除,而二线治疗的临床试验例如CheckMate 141、 KEYNOTE-040[11,15]虽然纳入但显示其免疫治疗效果与一线铂类药物治疗失败的患者类似,因此仍需要更多的研究探索其最佳的治疗方案。
目前,LA HNSCC的治疗需要根据肿瘤分期、原发部位、器官保留的需求及人乳头状瘤病毒(human papilloma virus,HPV)感染状态等多种因素综合考虑,推荐多学科联合的治疗模式。对于可切除的LA HNSCC,手术继以辅助放疗/放化疗是标准的治疗手段,也是国内外最常用的治疗模式。对于不可切除或具有器官保留需求的患者,以顺铂为基础的同期放化疗(concurrent chemoradiotherapy,CCRT)是标准的治疗模式。诱导治疗特别是诱导化疗通常用于需要进行器官保留的喉癌/下咽癌患者,标准的治疗方案是TPF[多西他赛、顺铂和5-氟尿嘧啶(5-fluorouracil,5-FU)],与传统的PF(顺铂和5-FU)相比具有较高的保喉成功率[16]。Ⅱ期AGMT前瞻性随机对照研究[17]显示,TPE方案(多西他赛、顺铂和西妥昔单抗)用于诱导治疗具有与TPF方案相近的ORR和OS,并且骨髓毒性明显下降,因此,对于无法耐受5-FU毒性的患者,也可将TPE作为诱导方案的选择。近年来,术前新辅助免疫治疗针对LA HNSCC开展了探索性研究[18],初步结果提示有助于改善病理学完全缓解率(pathological complete response,pCR)和主要病理学缓解率(major pathological response,MPR)。近期,KEYNOTE-689研究[19]宣布达到了主要终点,针对可切除的LA HNSCC,给予2个周期的帕博利珠单抗术前新辅助治疗和15个周期的术后辅助治疗,可给患者带来无事件生存(event-free survival,EFS)的获益。CCRT是LA HNSCC的另一种根治性治疗模式,通常联合顺铂作为放疗增敏药物,对于无法耐受顺铂的患者,可以考虑联合西妥昔单抗。近年来,多项研究试图在CCRT基础上联合ICIs,但遗憾的是包括JAVELIN Head and Neck 100、KEYNOTE-412和NRG-HN004等多项随机对照研究[20-23]都呈现出阴性结果。
近年来多项研究结果提示,抗EGFR单抗联合ICIs治疗具有良好的协同效果和临床获益,并已获得美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)[24]和中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)[25]等发布的权威性指南的推荐,但研究多处于早期探索阶段,因此对该联合方案的临床合理应用仍需进行规范和指导。为进一步推动抗EGFR单抗联合ICIs在HNSCC患者中的合理应用,中国临床肿瘤学会头颈肿瘤专家委员会组织专家组制定《抗EGFR单抗联合免疫检查点抑制剂治疗头颈部鳞状细胞癌专家共识(2025年版)》(以下简称本共识),旨在提高临床医师对抗EGFR单抗联合ICIs方案的认识,促进HNSCC治疗的科学性和规范性。
本共识已在国际实践指南注册与透明化平台(Practice guideline REgistration for transPAREncy,PREPARE)上注册,注册号为PREPARE-2025CN666。
1 共识的制定方法
1.1 共识专家组构成
本共识专家组成员主要来自CSCO头颈肿瘤专家委员会,共有31位专家参与,涉及肿瘤科、放疗科及头颈外科等科室,地域涉及北京、上海、天津、江苏、浙江、四川、广东、湖南、黑龙江、山东、安徽、福建、广西、湖北共14个省、自治区或直辖市。所有专家均有使用抗EGFR单抗联合ICIs治疗HNSCC的相关经验。
1.2 共识文献检索
检索的英文数据库包括PubMed、Embase和Cochrane Library,中文数据库包括中国知网(CNKI)和万方数据库,检索时限均为建库至2025年3月。通过筛选和内容评估,最终纳入45篇文献,主要为前瞻性随机对照临床试验、非对照或观察性研究、综述、指南等。
1.3 形成共识的方法学
本共识专家组基于现有循证医学证据,采用共识会议法[26]对相关证据进行评估、讨论,结合中国临床实践经验,组织多轮专家讨论,形成初步的共识意见,并对共识意见的陈述进行投票,投票设置“非常同意”“基本同意”“不确定或不同意”3个选项,专家可对“草案” 的每个章节提出修改意见。专家共识度(即选择“非常同意”或“基本同意”的专家人数比例)≥80%的专家意见一致定义为达成共识,具体投票结果见附录1。基于专家投票结果,最终形成本共识。
1.4 共识的目标人群与使用人群
本共识的目标人群为HNSCC患者,特别是计划接受抗EGFR单抗联合ICIs治疗的HNSCC患者群体,使用人群为从事HNSCC治疗的医务工作者。
1.5 共识的传播与更新
共识专家组将采取多种形式对共识进行宣传和普及,具体包括:① 在核心医学期刊上进行全文发表;② 依托全国性的学术会议进行共识发布;③ 通过专业医学媒体进行多维度传播分享;④ 分阶段开展全国各区域共识分享讨论会议,确保不同地域医务工作者能充分了解抗EGFR单抗联合ICIs治疗HNSCC的相关进展数据并正确应用。共识专家组未来将根据循证医学证据的累积和临床实践需求的变化,定期对共识内容进行修订和更新。
2 抗EGFR单抗与ICIs联合治疗的协同机制
EGFR信号转导通路的异常激活在肿瘤的发生、发展与抗肿瘤免疫逃逸中具有双重作用,既能够驱动肿瘤细胞自主性增殖,又能够抑制抗肿瘤免疫应答。多项临床前研究[27-30]提示,抗EGFR单抗与ICIs联合可通过以下机制恢复免疫应答,实现协同抗肿瘤效应。
2.1 增强肿瘤抗原递呈
EGFR信号转导通路抑制可显著上调肿瘤细胞表面主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ和Ⅱ类分子的表达[29]。MHC分子作为抗原递呈的核心载体,能将肿瘤特异性抗原高效递呈至CD8+ T淋巴细胞(通过MHC Ⅰ类分子)和CD4+ T淋巴细胞(通过MHC Ⅱ类分子),从而激活适应性免疫应答。这种抗原递呈能力的增强与程序性死亡蛋白-1(programmed death-1,PD-1)抑制剂解除T淋巴细胞耗竭的作用形成互补,共同促进抗肿瘤免疫反应的启动和维持[29]。
2.2 重塑肿瘤微环境
抗EGFR单抗治疗可导致肿瘤微环境中两类关键免疫抑制细胞群的变化:
① Foxp3+调节性T(regulatory T,Treg)细胞浸润增加:Foxp3+Treg细胞通过分泌转化生长因子-β(transforming growth factor β,TGF-β)和白细胞介素-10(interleukin-10,IL-10)抑制树突状细胞成熟,并直接削弱细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)及自然杀伤(nature killer,NK)细胞的杀伤活性[27,29];② 髓系来源抑制细胞(myeloid-derived suppressor cell,MDSC)增加:MDSC通过高表达PD-L1、TGF-β及大量释放IL-10,进一步抑制免疫应答[27,30]。联合应用PD-1抑制剂可有效地阻断上述免疫抑制信号转导通路,逆转肿瘤微环境的免疫抑制状态,提示两者具有潜在的协同作用[27,29-30]。
2.3 调控PD-L1表达
抗EGFR单抗(如西妥昔单抗)Fc段通过与NK细胞表面CD16受体结合,可诱导干扰素-γ (interferon γ, IFN-γ)释放,IFN-γ通过激活JAK2/STAT1信号转导通路,诱导肿瘤细胞及肿瘤微环境中免疫细胞(如巨噬细胞、树突状细胞)的PD-L1表达上调[29-30]。这种PD-L1的适应性上调可增加ICIs结合位点密度,从而增强ICIs的治疗敏感性,提示EGFR抑制与ICIs具有协同作用基础[29-30]。
专家共识1:临床前研究提示,抗EGFR单抗可能通过增强肿瘤抗原递呈和影响免疫微环境等机制,实现与ICIs的协同增效作用(非常同意率为74%,基本同意率为26%)。
3 抗EGFR单抗联合ICIs治疗R/M HNSCC
基于抗EGFR单抗与ICIs的协同作用机制,该联合治疗策略近几年已成为HNSCC领域的重要研究方向。目前,多项研究[31-37]提示抗EGFR单抗联合ICIs治疗在R/M HNSCC不同类型患者中的获益可能存在差异,在一线治疗患者、铂类药物耐药或治疗失败患者中均获得较好的疗效,在ICIs治疗失败患者中的疗效不及预期(表1)。
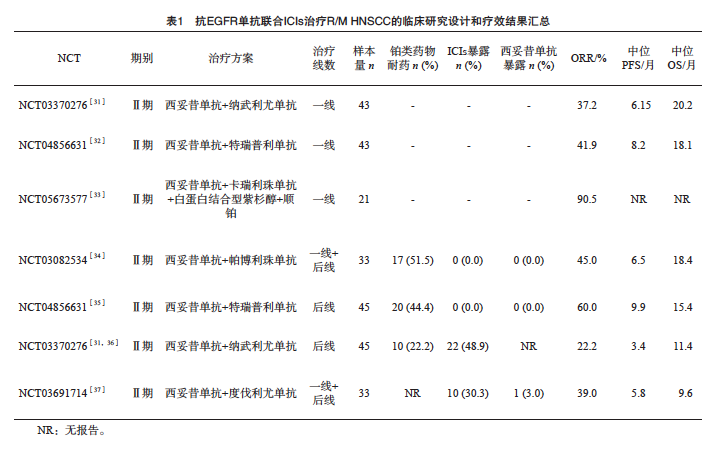
3.1 一线治疗患者
目前R/M HNSCC一线治疗可选方案较多,但对于不耐受或拒绝化疗的患者,目前常用的一线治疗方案为单药免疫治疗,疗效仍存在较大提升空间。KEYNOTE-048研究[8,38]中帕博利珠单抗单药组的ORR仅为16.9%,中位PFS为2.3个月,中位OS为11.5个月。近期两项针对初治R/M HNSCC患者的临床研究[31-32]相继公布数据,初步证实抗EGFR单抗(西妥昔单抗)联合ICIs在一线治疗中具有良好的疗效,可能为该人群提供新的治疗选择。
一项多中心Ⅱ期临床研究[31]旨在评估西妥昔单抗联合纳武利尤单抗用于一线治疗的效果。该研究共纳入43例R/M HNSCC初治患者,其中14例(33%)为口咽癌/不确定原发部位且p16免疫组织化学(immunohistochemical,IHC)检测结果为阳性,20例(47%)为PD-L1 CPS≥20,患者入组后在首个周期前14 d单次接受西妥昔单抗500 mg/ m2作为导入期治疗,随后接受西妥昔单抗(500 mg/m2,每2周1次)联合纳武利尤单抗(240 mg,每2周1次)治疗,每28 d为1个周期,持续至疾病进展、出现不可耐受的不良反应或完成最长24个治疗周期。结果显示,该联合治疗方案的ORR为37.2%(16/43),中位PFS为6.15个月,中位OS为20.2个月,1年OS率为66%,亚组分析结果显示,p16状态及PD-L1 CPS表达水平对患者的PFS和OS获益均未产生显著影响。
鉴于PD-L1表达水平与ICIs的疗效具有明确的相关性,一项多中心Ⅰb/Ⅱ期CT37研究[32]队列B在PD-L1 CPS≥1的患者中探索了西妥昔单抗联合特瑞普利单抗一线治疗的效果,共纳入43例R/M HNSCC初治患者,接受特瑞普利单抗(240 mg,每3周1次)联合西妥昔单抗(第1周400 mg/m2,后续每周250 mg/m2,每周1次)治疗,特瑞普利单抗最长治疗2年,结果显示,中位随访12个月,该联合治疗方案的ORR为41.9%[其中完全缓解(complete response,CR) 2例,部分缓解(partial response,PR)16例)],中位缓解持续时间(duration of response,DOR)为15.8个月,中位PFS为8.2个月,1年PFS率为44.0%,预估中位OS为18.1个月,1年OS率为62.2%。值得注意的是,研究纳入的患者均为PD-L1 CPS≥1的患者,该设定是基于西妥昔单抗联合特瑞普利单抗后线治疗队列(队列A)中亚组分析结果(PD-L1 CPS≥1的患者较CPS<1的患者的获益率更高)作出的人群选择。
上述两项Ⅱ期临床研究结果提示,西妥昔单抗联合ICIs一线治疗R/M HNSCC可获得较高的ORR和较长的中位PFS及中位OS,尤其是相较于免疫单药治疗方案,该靶免“去化疗”联合方案的疗效数据似乎更具有优势。在临床实践中,对于不耐受或拒绝化疗的R/M HNSCC初治患者,或可考虑接受抗EGFR单抗联合ICIs以提升治疗获益。
专家共识2:对于不耐受或拒绝化疗的R/M HNSCC,可以考虑ICIs联合抗EGFR单抗作为一线治疗方案(非常同意率为81%,基本同意率为19%)。
针对初治R/M HNSCC患者的靶免“去化疗”方案显示初步获益,而对于可以耐受化疗的患者,联合化疗的效果是否可以进一步提高亦值得探索。一项单中心Ⅱ期临床研究[33]评估了在西妥昔单抗联合卡瑞利珠单抗治疗的基础上再联合顺铂与白蛋白结合型紫杉醇的“靶免化”四药联合方案一线治疗的疗效及安全性。该第二阶段研究的第一阶段共入组21例R/M HNSCC初治患者,所有入组患者均为美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)状态评分(performance status,PS)1分,患者的中位年龄为65岁(34~72岁),9例(42.9%)患者存在远处转移。患者入组后接受卡瑞利珠单抗(200 mg,每3周1次)联合西妥昔单抗(第1周400 mg/m2,后续每周250 mg/m2,每周1次)、顺铂(75 mg/m2,每3周1次)及白蛋白结合型紫杉醇(125 mg/m2,第1和8天)治疗,21 d为1个周期,6个周期后予卡瑞利珠单抗(200 mg,每2周1次)和西妥昔单抗(500 mg/m2,每2周1次)维持治疗,直至出现无法耐受的不良反应或疾病进展。对于第一阶段入组患者,中位随访9.2个月的结果显示,该联合治疗方案经确认的ORR高达90.5%(19/21,其中CR 1例,PR 18例),疾病控制率(disease control rate,DCR)为100.0%,6个月PFS率为90.2%,1年PFS率为70.3%,6个月OS率为90.2%,1年OS率为82.7%[33]。符合预先计划的继续试验标准,继续第二阶段入组。该研究使用粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)预防性用药,安全性数据显示,47.6%的患者出现3级及以上治疗相关不良反应(treatment-related adverse events,TRAE),主要包括反应性皮肤毛细血管增生症(23.8%)、中性粒细胞减少症(19.0%)、皮疹(9.5%)等;1例患者因肺炎停止卡瑞利珠单抗治疗,2例患者因痤疮样皮疹停止西妥昔单抗治疗;3例患者报告致死性不良反应(分别由再放疗部位的肿瘤出血、严重的感染性肺炎以及因吞咽导致的窒息所引起)[33]。
与前述“去化疗”的靶免联合方案相比,该“靶免化”联合方案显示出更高的ORR(90.5%),提示化疗的加入可能进一步提高短期有效率,值得注意的是,四药联用导致3级及以上TRAE发生率较高,临床上可考虑在高度选择(如ECOG PS 0~1分、年龄<70岁、身体状况良好)的患者中使用。
专家共识3:抗EGFR单抗、ICIs和化疗的联合方案一线治疗R/M HNSCC初步显示出很高的ORR,但不良反应有所增加,可以考虑在高度选择的患者中使用(非常同意率为65%,基本同意率为35%)。
3.2 铂类药物耐药或治疗失败患者
针对铂类药物耐药或铂类药物治疗失败的R/M HNSCC患者,既往治疗方案的疗效有限。CheckMate 141研究[15]亚组分析结果显示,纳武利尤单抗治疗铂类药物耐药患者的ORR为19.2%,中位PFS为2.3个月,中位OS仅为7.7个月。近期研究[34-35]提示,抗EGFR单抗联合ICIs可能为该类人群提供新的治疗选择。
一项开放标签、多中心Ⅱ期临床研究[34]共纳入33例既往未接受过PD-1/PD-L1抑制剂或西妥昔单抗治疗的患者,其中铂类药物耐药患者17例(52%),铂类药物不耐受患者12例(36%),铂类药物治疗失败患者4例(12%),接受帕博利珠单抗(200 mg,每3周1次)联合西妥昔单抗(第1周400 mg/m2,后续每周250 mg/m2,每周1次)持续治疗,结果显示,中位随访7.3个月,6个月的ORR为45%(15/33),中位DOR为13.1个月,DCR为61%(20/33),中位PFS为6.5个月,中位OS为18.4个月。需注意的是,该研究是首个评估抗EGFR单抗联合ICIs治疗R/M HNSCC的研究,88%的参与者在复发或转移期未接受过系统治疗,即一线治疗接受了该联合治疗方案。同时该研究也是首个在靶免联合治疗探索中纳入铂类药物不耐受患者的研究,尽管未针对该特殊亚组进行分层分析,但全人群获益良好,提示抗EGFR单抗联合ICIs可能为铂类药物不耐受等虚弱患者提供新的治疗选择。
另一项Ⅱ期研究(CT37研究)[35]的后线治疗队列(队列A)在铂类药物耐药或治疗失败患者中评估了特瑞普利单抗联合西妥昔单抗的疗效,共纳入45例患者,所有患者既往未接受过ICIs或抗EGFR单抗治疗,铂类药物耐药患者占44.4%,铂类药物治疗失败患者占55.6%。患者入组后接受特瑞普利单抗(240 mg,每3周1次)联合西妥昔单抗(第1周400 mg/m2,后续每周250 mg/m2,每周1次)治疗,结果显示,中位随访10个月,ORR为60%,其中1例患者CR,26例患者PR,中位DOR为17.9个月,中位PFS为9.9个月,12个月PFS率为40.7%,中位OS为15.4个月,12个月OS率为54.4%;亚组分析显示,PD-L1 CPS≥1的患者较CPS<1的患者的获益更佳(ORR:64.5% vs 40.0%,中位PFS:10.4个月 vs 4.0个月,中位OS:15.4个月 vs 11.7个月)。这一结果提示铂类药物暴露(铂类药物耐药或治疗失败)可能并不影响抗EGFR单抗联合ICIs的疗效,为此类患者的治疗提供了新的思路。
上述两项研究提示,在铂类药物耐药或治疗失败的患者中,相较于历史数据,抗EGFR单抗联合ICIs似乎可以获得较高的ORR以及较长的PFS和OS。因此,对于铂类药物耐药或治疗失败的R/M HNSCC患者,抗EGFR单抗联合ICIs是可选的治疗方案。
专家共识4:对于铂类药物耐药或治疗失败的R/M HNSCC,可以考虑抗EGFR单抗联合ICIs的治疗方案(非常同意率为74%,基本同意率为26%)。
3.3 ICIs治疗失败患者
随着ICIs在R/M HNSCC一线治疗中的广泛应用,如何为ICIs治疗后进展的患者选择有效的后续方案成为亟待解决的临床难题。近期有研究探索了抗EGFR单抗联合ICIs在该人群中治疗的效果,以下为两项关键临床研究结果。
一项Ⅱ期研究[31]纳入一线及以上治疗后疾病进展的45例R/M HNSCC患者,接受西妥昔单抗联合纳武利尤单抗治疗,其中22例(49%)患者既往接受过ICIs治疗,31例(69%)患者既往接受过ICIs或西妥昔单抗治疗,结果显示,ORR为22.2%(其中CR 2例,PR 9例),中位PFS为3.4个月,1年的PFS率为19%,中位OS为11.4个月,1年OS率为50%。考虑到既往ICIs治疗可能影响二线治疗获益,该研究进行了亚组分析[36],结果显示,ICIs未治患者(23/45,51%)较ICIs经治患者(22/45,49%)的PFS具有更优趋势,然而1年OS率的改善差异无统计学意义。
另外一项Ⅱ期临床研究[37]纳入33例R/M HNSCC患者,其中10例(30%)既往接受过ICIs治疗,11例(33%)既往接受过含铂药物的化疗。患者入组后接受西妥昔单抗(第1周400 mg/m2,后续每周250 mg/m2,每周1次)联合度伐利尤单抗(1 500 mg,每4周1次)持续治疗,每28 d为1个周期,结果显示,ORR为39%(13/33),中位DOR为8.6个月,中位PFS为5.8个月,中位OS为9.6个月。进一步亚组分析结果显示,ICIs未治患者显示出比ICIs经治患者更优的OS获益(中位OS:13.9个月 vs 7.1个月,P=0.03),提示ICIs暴露可能影响后线抗EGFR单抗联合ICIs治疗的效果,在ICIs治疗失败的患者中,该靶免联合方案的疗效不及预期。
对于一线接受ICIs治疗失败的R/M HNSCC,既往两项前瞻性Ⅱ期临床研究[13-14]提示,西妥昔单抗联合紫杉醇具有良好的挽救治疗效果。一项前瞻性、国际多中心的Ⅱ期临床研究[13]纳入57例ICIs经治的R/M HNSCC患者,接受西妥昔单抗联合紫杉醇治疗,结果显示,ORR为47.4%,其中8例(14.0%)患者达到CR,中位DOR为5.5个月,DCR为71.9%,中位PFS为5.9个月,中位OS为14.0个月,6个月PFS率和OS率分别为48%和74%。另一项Ⅱ期临床研究[14]纳入35例ICIs经治的R/M HNSCC患者,接受紫杉醇联合西妥昔单抗治疗,结果显示,在33例可评估疗效的患者中,ORR为69.6%,在中位随访16.6个月的存活患者中,中位PFS和OS分别为5.5和13.3个月,DCR达到93.7%。此外,基于一项Ⅱ期临床研究[12]数据,西妥昔单抗单药二线治疗方案也获得CSCO指南及NCCN指南推荐。相比之下,上述抗EGFR单抗联合ICIs的方案(中位OS:9.6~11.4个月)[31,36-37]未显示出优势,提示对于ICIs治疗失败患者,西妥昔单抗为基础的治疗可能是更优选择,再次联合ICIs获益尚不明确。
专家共识5:对于一线接受ICIs治疗失败的R/M HNSCC,抗EGFR单抗单药或联合化疗是常用的挽救治疗方案,再次联合ICIs的获益尚不明确(非常同意率为65%,基本同意率为32%)。
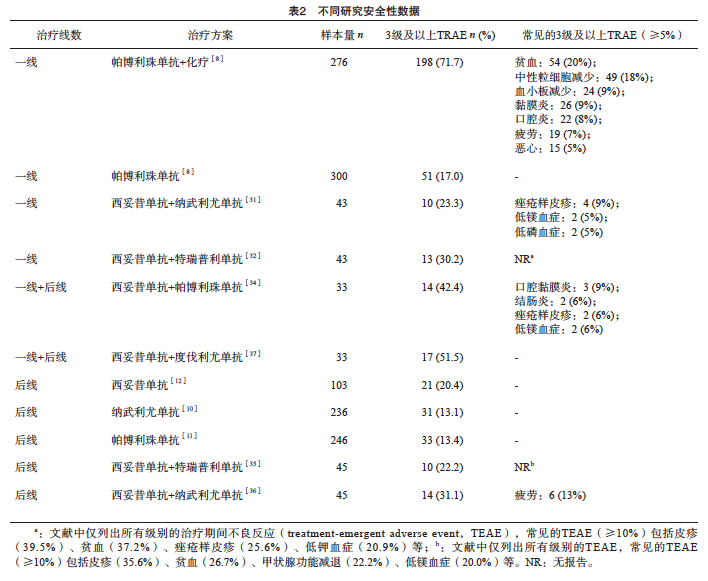
3.4 不良反应和相关管理
抗EGFR单抗联合ICIs治疗R/M HNSCC获得较好的效果的同时,也展现出可控的安全性特征(表2):① 抗EGFR单抗联合ICIs治疗方案的3级及以上TRAE发生率低。在一线治疗中,西妥昔单抗+纳武利尤单抗的3级及以上TRAE发生率为23.0%[31],西妥昔单抗+特瑞普利单抗为30.2%[32],西妥昔单抗+帕博利珠单抗(88%为一线治疗患者)为42.4%[34],而KEYNOTE-048研究[8]中,帕博利珠单抗联合化疗为72%。在后线治疗中,西妥昔单抗联合特瑞普利单抗的3级及以上TRAE发生率为22.2%[35],西妥昔单抗联合纳武利尤单抗为31%[36],与后线传统治疗方案(纳武利尤单抗为13.1%[10],帕博利珠单抗为13%[11],西妥昔单抗为20%[12])相近。需注意西妥昔单抗联合PD-L1抑制剂度伐利尤单抗(54%为后线治疗患者)的3级及以上TRAE发生率较高(51.5%)[37]。② 靶向治疗联合免疫治疗方案的不良反应叠加效应有限,未明显增加抗EGFR单抗及ICIs单药毒性,基于既往ICIs单药治疗的安全性数据(3级及以上TRAE发生率:帕博利珠单抗一线治疗为17%[8],纳武利尤单抗二线治疗为13.1%[10])和抗EGFR单抗单药治疗的安全性数据(西妥昔单抗二线治疗为 20%[12]),抗EGFR单抗联合ICIs治疗方案的3级及以上TRAE发生率为23.0%~30.2%[31-32],与单药治疗数据接近,提示二者联合未导致累积性不良反应。
此外,抗EGFR单抗联合ICIs治疗方案的不良反应谱与传统ICIs联合化疗方案存在差异。靶向治疗联合免疫治疗方案一线治疗的3级及以上TRAE主要为口腔黏膜炎、痤疮样皮疹等,未观察到骨髓毒性及消化系统毒性。传统ICIs联合化疗的3级及以上TRAE主要包括血液系统毒性(贫血、中性粒细胞减少症、血小板减少症等)、消化系统毒性(恶心、呕吐、食欲减退)等。这种差异提示靶向治疗联合免疫治疗方案可能更适用于存在骨髓功能受损或胃肠道耐受性较差的虚弱患者群体。
综上所述,抗EGFR单抗联合ICIs治疗方案的3级及以上TRAE发生率低,未增加抗EGFR单抗及ICIs单药的毒性,同时规避了传统ICIs联合化疗方案的骨髓毒性和消化系统毒性,可能更适用于特定器官功能受限的患者。
专家共识6:抗EGFR单抗联合ICIs治疗方案的安全性良好,联合治疗并没有明显增加抗EGFR单抗或ICIs单药的毒性(非常同意率为65%,基本同意率为35%)。
4 抗EGFR单抗联合ICIs治疗LA HNSCC
在R/M HNSCC中,抗EGFR单抗联合ICIs获得了良好的疗效及安全性。与此同时,该联合策略也在LA HNSCC患者中进行了探索,包括靶向治疗联合免疫治疗和放疗的GORTEC 2017-01 REACH Ⅲ期同步治疗研究,以及靶向治疗联合免疫治疗和化疗方案在LA HNSCC新辅助治疗的探索。
4.1 同步治疗
LA HNSCC的标准治疗方案为高剂量顺铂联合放疗,对于顺铂不耐受的患者,基于BONNER研究[39-40]结果,西妥昔单抗联合放疗已成为标准治疗方案。近年来,随着免疫治疗的发展,一项Ⅲ期临床研究[41]进一步探索了在上述同步治疗的基础上联合ICIs的疗效及安全性。
基于阿维鲁单抗与西妥昔单抗及放疗的潜在协同作用,Ⅲ期临床研究GORTEC 2017-01 REACH[41]旨在评估该联合治疗方案与标准治疗(standards of care,SOC)在LA HNSCC患者中的疗效,该研究包括顺铂不耐受和顺铂耐受两个队列,在顺铂不耐受队列中,试验组接受西妥昔单抗联合调强适形放疗(intensity-modulated radiation therapy,IMRT)及阿维鲁单抗(10 mg/kg,每2周1次),随后继续使用阿维鲁单抗(每2周1次)维持治疗12个月,对照组接受每周西妥昔单抗联合IMRT。在顺铂耐受队列中,试验组仍接受西妥昔单抗联合IMRT及阿维鲁单抗方案,对照组接受顺铂(100 mg/ m2)联合IMRT;主要终点为PFS。顺铂不耐受队列共纳入275例患者,中位随访47.7个月,试验组(n=140)相对于对照组(n=135)的4年PFS率有升高趋势[33.7% vs 18.4%,原始风险比(hazard ratio,HR)=0.75,P=0.022;基于中心、淋巴结N分期和p16表达状态调整的HR=0.80,P=0.059],远处转移率显著降低(9/140 vs 29/135,亚分层HR=0.24,P< 0.000 1),4年OS率差异无统计学意义(42.6% vs 39.4%,HR=1.05,P=0.77)。顺铂耐受队列共纳入426例患者,中位随访50.8个月,试验组(n=212)相对于对照组(n=214)的4年PFS率(42.3% vs 54.7%,HR=1.40)及4年OS率(55.1% vs 67.1%,HR=1.43)均未显示获益。
因此,对于顺铂耐受患者,标准治疗方案仍为大剂量顺铂联合放疗,REACH研究中西妥昔单抗联合阿维鲁单抗及放疗方案并未实现获益;对于顺铂不耐受患者,西妥昔单抗联合放疗是标准治疗方案,REACH研究数据提示西妥昔单抗联合阿维鲁单抗及放疗方案较标准治疗方案能够显著降低远处转移率且PFS有改善趋势,但OS未获益,整体安全性良好,3级及以上不良反应在两组患者间的发生率相同。
专家共识7 :对于不耐受顺铂的L A HNSCC,放疗联合抗EGFR单抗是常用的非手术治疗方案,初步证据显示在此基础上再联合ICIs有助于改善PFS和降低远处转移发生率(非常同意率为39%,基本同意率为61%)。
4.2 新辅助治疗
新辅助治疗是当前LA HNSCC研究的热点,可能有助于缩小肿瘤、缓解症状、实现手术降级及保护重要器官组织功能等。基于ICIs与抗EGFR单抗的协同作用机制,近年来靶向治疗药物与免疫治疗药物联合的新辅助治疗也成为新的探索方向。
一项单臂研究[42]旨在评估西米普利单抗联合西妥昔单抗及含铂双药化疗新辅助治疗LA HNSCC的安全性及可行性,共纳入30例符合手术切除标准且需要接受术后辅助放疗的LA HNSCC患者,患者入组后接受首剂西妥昔单抗负荷剂量(400 mg/m2)联合西米普利单抗(350 mg)治疗,随后进行3个周期西妥昔单抗(250 mg/m2,每周1次)联合西米普利单抗(350 mg,每3周1次)、顺铂(75 mg/m2,每3周1次)/卡铂[曲线下面积(area under curve,AUC)=5,每3周1次]及多西他赛(75 mg/m2,每3周1次)治疗后进行手术。主要终点为安全性和耐受性,次要终点包括治疗相关毒性导致的根治性手术延期的患者数量,临床至病理学分期降低,以及是否允许省略辅助放疗。基线数据显示,共29例患者可评估,大部分患者为口腔癌(n=26),其中T3期患者17例(59%),T4期患者10例(35%)。研究结果显示,前10例患者未观察到剂量限制毒性,达到了主要研究终点。29例患者接受了手术且未发生手术延期(1例患者在放射学CR后拒绝手术),28例原本需要游离皮瓣的患者在新辅助治疗后17例(61%)不再需要游离皮瓣。20例(69%)患者符合省略辅助放疗的条件。同时,西米普利单抗联合西妥昔单抗及含铂双药化疗显示出良好的疗效,MPR率为66%(T3期为71%,T4期为30%),pCR率为31%(T3期为35%,T4期为10%),中位随访7.5个月,所有患者均处于无疾病状态,前10例患者无疾病状态超过2年。最常见不良反应为皮疹(78%)、恶心(74%)、低镁血症(57%)和疲劳(49%);4例患者(13%)发生3或4级免疫相关不良反应。该研究数据提示西米普利单抗联合西妥昔单抗及含铂双药化疗的新辅助治疗方案具有可接受的安全性,且没有引起手术延迟,能够在部分患者中实现手术方式调整和省略辅助放疗。
另一项回顾性研究[43]评估了帕博利珠单抗联合西妥昔单抗及含铂化疗新辅助治疗LA HNSCC的疗效和安全性,共纳入21例适合进行完全手术切除的患者,接受帕博利珠单抗(200 mg,第1天)、西妥昔单抗(800 mg,第1天)、紫杉醇(175 mg/m2,第1天)及顺铂(75 mg/m2,第1天),每3周1次,治疗3个周期,新辅助治疗结束4周后进行手术。主要终点为MPR,次要终点为pCR、ORR及安全性。基线特征显示,原发肿瘤部位以口咽部(42.9%)占比最高,cT3~cT4期患者占47.6%,cN2期患者占76.2%。研究结果显示,原发肿瘤部位及颈部淋巴结均获得了良好疗效,原发肿瘤部位ORR为90.5%(CR率为28.6%,PR率为61.9%),MPR率为66.7%,pCR率为52.4%,颈部淋巴结的MPR率为61.1%,pCR率为50%。47.6%(10/21)的患者观察到临床降期,其中12例患者T分期下降, 10例患者N分期下降。在手术方面,新辅助治疗后原发肿瘤体积显著缩小,10例口咽癌和口腔癌患者均进行微创手术治疗,如经口机器人手术而非常规手术,实现器官和功能保留。3例喉癌患者中1例喉癌患者因喉软骨侵犯接受全喉切除术,2例喉癌患者行喉部分切除术。8例下咽癌患者中,6例接受喉部分切除联合下咽部分切除,2例分别行梨状窝切除术或咽后壁切除术,总体喉功能保留率达90.9%(10/11),18例患者进行了颈淋巴结清扫[3例患者由于正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)提示阴性拒绝清扫],9例(50%)患者的病理学检查结果显示淋巴结阴性。所有在新辅助免疫化疗后手术的患者均达到切缘阴性,且手术过程中未发生严重的并发症或死亡。该联合方案整体安全可控:3例患者(14.3%)出现3级不良反应,包括2例3级白细胞减少(9.5%)和1例3级痤疮样皮疹(4.7%)。最常见的1~2级不良反应为贫血(13/21,61.9%),其次为乏力(9/21,42.9%)和体重下降(6/21,28.6%)。未发生4级不良反应或因治疗导致的手术延迟。提示帕博利珠单抗联合西妥昔单抗和含铂药物化疗有望成为新辅助治疗方案的新选择。
上述两项研究显示抗EGFR单抗联合ICIs及含铂化疗方案在LA HNSCC的新辅助治疗中能够获得较高的病理学缓解率,缩小肿瘤后部分手术方式调整,有助于器官功能保留,且安全性良好,未观察到因治疗导致的手术延迟,值得进一步开展大样本研究。
专家共识8:对于适合接受根治性手术的LA HNSCC,抗EGFR单抗联合ICIs和化疗的新辅助治疗方案初步显示出很高的病理学缓解率,具有潜在的器官功能保留价值和可接受的安全性(非常同意率为55%,基本同意率为45%)。
5 总结及展望
综上所述,多项前瞻性Ⅱ期临床研究提示抗EGFR单抗联合ICIs具有良好的抗肿瘤活性和安全性,特别是针对R/M HNSCC,这一治疗模式已被国内外权威指南所推荐。但不可否认的是,单臂小样本研究具有潜在的选择性偏倚,仍需随机对照临床试验的验证。目前,一项Ⅲ期临床研究正在入组中,旨在评估西妥昔单抗联合帕博利珠单抗对比帕博利珠单抗单药在铂类药物耐药且CPS≥1的R/M HNSCC患者中的疗效和安全性。而对于LA HNSCC,这一联合治疗模式仍处于探索阶段,同时也期待围手术期免疫治疗的临床试验(KEYNOTE-689研究)能够提供更多的证据及获益人群的线索。对于在靶向治疗联合免疫治疗的基础上联合化疗的多药物组合,初步结果提示能够提高肿瘤缓解率,但基于其较高的不良反应发生率,似乎在有限周期的新辅助治疗领域更具有临床探索价值。
近年来,EGFR作为头颈部鳞癌的重要靶点,也衍生出包括抗体药物偶联物(antibody drug conjugate,ADC)或双特异性抗体在内的新型抗体类药物。MRG003作为一种靶向EGFR的ADC药物,已经在标准治疗失败的R/M HNSCC中显示出一定的疗效[44],其与免疫治疗在一线治疗领域的研究正在开展中。BCA101作为包含EGFR和TGF-β的双特异性抗体,其在联合帕博利珠单抗的一线治疗中显示出针对HPV阴性的R/M HNSCC持久的抗肿瘤活性[45],而相关的全球性Ⅲ期临床研究正在开展中。未来期待能够开展更多的临床研究并进一步提高HNSCC患者的整体疗效。
第一作者:
薛丽琼,博士,副主任医师;许婷婷,博士,副主任医师。
通信作者:
郭晔,博士,主任医师;胡超苏,博士,主任医师。
[参考文献]
[1] HAN B F, ZHENG R S, ZENG H M, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[2] MODY M D, ROCCO J W, YOM S S, et al. Head and neck cancer[J]. Lancet, 2021, 398(10318): 2289-2299.
[3] SHAIKH H, KARIVEDU V, WISE-DRAPER T M. Managing recurrent metastatic head and neck cancer[J]. Hematol Oncol Clin North Am, 2021, 35(5): 1009-1020.
[4] VERMORKEN J B, MESIA R, RIVERA F, et al. Platinumbased chemotherapy plus cetuximab in head and neck cancer[J]. N Engl J Med, 2008, 359(11): 1116-1127.
[5] MESÍA R, RIVERA F, KAWECKI A, et al. Quality of life of patients receiving platinum-based chemotherapy plus cetuximab first line for recurrent and/or metastatic squamous cell carcinoma of the head and neck[J]. Ann Oncol, 2010, 21(10): 1967-1973.
[6] GUO Y, LUO Y, ZHANG Q Y, et al. First-line treatment with chemotherapy plus cetuximab in Chinese patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck: efficacy and safety results of the randomised, phase Ⅲ CHANGE-2 trial[J]. Eur J Cancer, 2021, 156: 35-45.
[7] GUIGAY J, AUPÉRIN A, FAYETTE J, et al. Cetuximab, docetaxel, and cisplatin versus platinum, fluorouracil, and cetuximab as first-line treatment in patients with recurrent or metastatic head and neck squamous-cell carcinoma (GORTEC 2014-01 TPExtreme): a multicentre, open-label, randomised, phase 2 trial[J]. Lancet Oncol, 2021, 22(4): 463-475.
[8] BURTNESS B, HARRINGTON K J, GREIL R, et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study[J]. Lancet, 2019, 394(10212): 1915-1928.
[9] BURTNESS B, RISCHIN D, GREIL R, et al. Pembrolizumab alone or with chemotherapy for recurrent/metastatic head and neck squamous cell carcinoma in KEYNOTE-048: subgroup analysis by programmed death ligand-1 combined positive score[J]. J Clin Oncol, 2022, 40(21): 2321-2332.
[10] FERRIS R L, BLUMENSCHEIN G Jr, FAYETTE J, et al. Nivolumab for recurrent squamous-cell carcinoma of the head and neck[J]. N Engl J Med, 2016, 375(19): 1856-1867.
[11] COHEN E E W, SOULIÈRES D, LE TOURNEAU C, et al. Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label, phase 3 study[J]. Lancet, 2019, 393(10167): 156-167.
[12] VERMORKEN J B, TRIGO J, HITT R, et al. Open-label, uncontrolled, multicenter phase Ⅱ study to evaluate the efficacy and toxicity of cetuximab as a single agent in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck who failed to respond to platinum-based therapy[J]. J Clin Oncol, 2007, 25(16): 2171-2177.
[13] FUEREDER T, KLINGHAMMER K, HAHN D A, et al. Paclitaxel plus cetuximab for the treatment of recurrent and/ or metastatic head and neck cancer after first-line checkpoint inhibitor failure: primary analysis from the pace ace trial[J]. Ann Oncol, 2024, 35: S629.
[14] KOYAMA T, KIYOTA N, BOKU S, et al. A phase Ⅱ trial of paclitaxel plus biweekly cetuximab for patients with recurrent or metastatic head and neck cancer previously treated with both platinum-based chemotherapy and anti-PD-1 antibody[J]. ESMO Open, 2024, 9(6): 103476.
[15] GILLISON M L, BLUMENSCHEIN G Jr, FAYETTE J, et al. CheckMate 141: 1-year update and subgroup analysis of nivolumab as first-line therapy in patients with recurrent/ metastatic head and neck cancer[J]. Oncologist, 2018, 23(9): 1079-1082.
[16] POINTREAU Y, GARAUD P, CHAPET S, et al. Randomized trial of induction chemotherapy with cisplatin and 5-fluorouracil with or without docetaxel for larynx preservation[J]. J Natl Cancer Inst, 2009, 101(7): 498-506.
[17] KEIL F, HARTL M, ALTORJAI G, et al. Docetaxel, cisplatin and 5-FU compared with docetaxel, cisplatin and cetuximab as induction chemotherapy in advanced squamous cell carcinoma of the head and neck: results of a randomised phase Ⅱ AGMT trial[J]. Eur J Cancer, 2021, 151: 201-210.
[18] KÜRTEN C H L, FERRIS R L. Neoadjuvant immunotherapy f o r head and neck squamous c e l l c a rc i noma[J]. Laryngorhinootologie, 2024, 103(s 01): S167-S187.
[19] Merck’s KEYTRUDA® (pembrolizumab) Met primary endpoint of event-free survival (EFS) as perioperative treatment regimen in patients with resected, locally advanced head and neck squamous cell carcinoma[EB/OL]. [2025-04-15]. https://www.merck.com/news/mercks-keytrudapembrolizumab-met-primary-endpoint-of-event-freesurvival-efs-as-perioperative-treatment-regimen-inpatients-with-resected-locally-advanced-head-and-necksquamous-c/.
[20] LEE N Y, FERRIS R L, PSYRRI A, et al. Avelumab plus standard-of-care chemoradiotherapy versus chemoradiotherapy alone in patients with locally advanced squamous cell carcinoma of the head and neck: a randomised, double-blind, placebocontrolled, multicentre, phase 3 trial[J]. Lancet Oncol, 2021, 22(4): 450-462.
[21] MACHIELS J P, TAO Y G, LICITRA L, et al. Pembrolizumab plus concurrent chemoradiotherapy versus placebo plus concurrent chemoradiotherapy in patients with locally advanced squamous cell carcinoma of the head and neck (KEYNOTE-412): a randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2024, 25(5): 572-587.
[22] ME L L L K , T O R R E S - S A A V E D R A P A , WONG S J , et al. Radiotherapy with cetuximab or durvalumab for locoregionally advanced head and neck cancer in patients with a contraindication to cisplatin (NRG-HN004): an open label, multicentre, parallel-group, randomised, phase 2/3 trial[J]. Lancet Oncol, 2024, 25(12): 1576-1588.
[23] TAO Y, AUPERIN A, SUN X, et al. Avelumab-cetuximabradiotherapy versus standards of care (SoC) in patients (pts) with locally advanced squamous cell carcinoma of head and neck (LA-SCCHN): safety phase of randomized trial GORTEC 2017-01 (REACH)[J]. Ann Oncol, 2019, 30: v454.
[24] National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN guidelines) for head and neck cancers. Version 2.2025[EB/OL]. [2025-04-15]. https://www.nccn.org/professionals/physician_gls/pdf/headand-neck.pdf.
[25] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)头颈部肿瘤诊疗指南-2024[M]. 北京: 人民卫生出版社, 2024.
Guidelines Working Committee, Chinese Society of Clinical Oncology. Guidelines and Chinese Society of Clinical Oncology (CSCO): head and neck cancer (2024)[M]. Beijing: People’s Medical Publishing House, 2024.
[26] 中国抗癌协会肿瘤整体评估专业委员会, 福建省抗癌协会癌痛专业委员会. 奥沙利铂超敏反应全程管理中国专家共识(2024年版)[J]. 中国癌症杂志, 2024, 34(8): 785-805.
Cancer Assessment Society of China Anti-Cancer Association, Cancer Pain Society of Fujian Anti-Cancer Association. Chinese expert consensus on whole-process management of oxaliplatininduced hypersensitivity reactions (2024 edition)[J]. China Oncol, 2024, 34(8): 785-805.
[27] FERRIS R L, LENZ H J, TROTTA A M, et al. Rationale for combination of therapeutic antibodies targeting tumor cells and immune checkpoint receptors: harnessing innate and adaptive immunity through IgG1 isotype immune effector stimulation[J]. Cancer Treat Rev, 2018, 63: 48-60.
[28] SABA N F, CHEN Z G, HAIGENTZ M, et al. Targeting the EGFR and immune pathways in squamous cell carcinoma of the head and neck (SCCHN): forging a new alliance[J]. Mol Cancer Ther, 2019, 18(11): 1909-1915.
[29] KUMAGAI S, KOYAMA S, NISHIKAWA H. Antitumour immunity regulated by aberrant ERBB family signalling[J]. Nat Rev Cancer, 2021, 21(3): 181-197.
[30] TIAN X, ZHANG H Y, HAN Y M, et al. Current status and future prospects of combined immunotherapy and epidermal growth factor receptor inhibitors in head and neck squamous cell carcinoma[J]. Cancer Treat Rev, 2025, 132: 102864.
[31] CHUNG C H, LI J N, STEUER C E, et al. Phase Ⅱ multiinstitutional clinical trial result of concurrent cetuximab and nivolumab in recurrent and/or metastatic head and neck squamous cell carcinoma[J]. Clin Cancer Res, 2022, 28(11): 2329-2338.
[32] GUO Y, LI D Z, LIN J, et al. 872P Safety and efficacy of toripalimab combined with cetuximab in PD-L1 positive untreated recurrent or metastatic head and neck squamous cell carcinoma (R/M HNSCC): a phase Ⅰb/Ⅱ study[J]. Ann Oncol, 2024, 35: S625.
[33] JI D, SANG Y, LIU X, et al. A phase Ⅱ clinical trial of camrelizumab combined with cetuximab and chemotherapy in recurrent or metastatic head and neck squamous cell carcinoma (R/M HNSCC)[J]. Ann Oncol, 2024, 35: S626.
[34] SACCO A G, CHEN R F, WORDEN F P, et al. Pembrolizumab plus cetuximab in patients with recurrent or metastatic head and neck squamous cell carcinoma: an open-label, multi-arm, nonrandomised, multicentre, phase 2 trial[J]. Lancet Oncol, 2021, 22(6): 883-892.
[35] GUO Y, LI Z D, HU D S, et al. Updated safety and efficacy of toripalimab combined with cetuximab in platinumrefractory recurrent or metastatic head and neck squamous cell carcinoma (R/M-HNSCC): a phase Ⅰb/Ⅱ clinical trial[J]. J Immunother Cancer, 2023, 11(Suppl 1): A769.
[36] CHUNG C H, BONOMI M, STEUER C E, et al. Concurrent cetuximab and nivolumab as a second-line or beyond treatment of patients with recurrent and/or metastatic head and neck squamous cell carcinoma: results of phase Ⅰ/Ⅱ study[J]. Cancers (Basel), 2021, 13(5): 1180.
[37] GULATI S, CRIST M, RIAZ M K, et al. Durvalumab plus cetuximab in patients with recurrent or metastatic head and neck squamous cell carcinoma: an open-label, nonrandomized, phase Ⅱ clinical trial[J]. Clin Cancer Res, 2023, 29(10): 1906-1915.
[38] HARRINGTON K J, BURTNESS B, GREIL R, et al. Pembrolizumab with or without chemotherapy in recurrent or metastatic head and neck squamous cell carcinoma: updated results of the phase Ⅲ KEYNOTE-048 study[J]. J Clin Oncol, 2023, 41(4): 790-802.
[39] BONNER J A, HARARI P M, GIRALT J, et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck[J]. N Engl J Med, 2006, 354(6): 567-578.
[40] BONNER J A, HARARI P M, GIRALT J, et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival[J]. Lancet Oncol, 2010, 11(1): 21-28.
[41] TAO Y, AUPERIN A, SUN X, et al. Avelumab-cetuximabradiotherapy (RT) versus standards of care in patients with locally advanced squamous cell carcinoma of head and neck (LA-SCCHN): final analysis of randomized phase Ⅲ GORTEC 2017-01 REACH trial[J]. Ann Oncol, 2024, 35: S616.
[42] DUNN L, CRACCHIOLO J, HO A L, et al. 859P Neoadjuvant cemiplimab with platinum-doublet chemotherapy and cetuximab to de-escalate surgery and omit adjuvant radiation in locoregionally advanced head & neck squamous cell carcinoma (HNSCC)[J]. Ann Oncol, 2024, 35: S619.
[43] YAO Z W, WANG J S, JIANG Y Q, et al. Pembrolizumab plus cetuximab with neoadjuvant chemotherapy for head and neck squamous cell carcinoma[J]. Head Neck, 2025, 47(1): 289-299.
[44] XUE L, HAN Y, ZHANG Q, et al. Efficacy and safety of a novel anti-EGFR ADC MRG003 in recurrent or metastatic squamous cell carcinoma of the head and neck patients[J]. Ann Oncol, 2023, 34: S590.
[45] HANNA G J, KACZMAR J, ZANDBERG D P, et al. Updated dose expansion results of a phase 1/1b study of the bifunctional EGFR/TGFβ inhibitor BCA101 with pembrolizumab in patients with recurrent, metastatic head and neck squamous cell carcinoma[J]. Int J Radiat Oncol, 2024, 118(5): e88.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#头颈部鳞状细胞癌# #抗表皮生长因子受体单抗#
3 举报