Nat Cancer:CHD1缺失促SPOP突变前列腺癌去势抵抗及联合治疗新策略
2025-05-26 MedSci原创 MedSci原创 发表于上海
本研究深入探讨了CHD1缺失在SPOP突变前列腺癌中的作用机制,揭示了CHD1通过抑制SREBP2来调控胆固醇生物合成,并通过促进肿瘤内雄激素合成来维持AR信号,从而导致去势抵抗性的发生。
前列腺癌(Prostate Cancer, PCa)是全球男性中最常见的恶性肿瘤之一。尽管手术去势(手术切除睾丸)或药物去势(使用促性腺激素释放激素激动剂或拮抗剂)是晚期前列腺癌的标准治疗方案,但大多数患者最终仍会进展为去势抵抗性前列腺癌(Castration-Resistant Prostate Cancer, CRPC)。在CRPC中,雄激素受体(Androgen Receptor, AR)仍然是重要的驱动因素。近年来,研究发现SPOP基因突变和CHD1基因缺失是前列腺癌中两种重要的遗传改变,它们共同定义了一种独特的前列腺癌亚型。然而,这两种基因改变在肿瘤进展和治疗反应中的相互作用尚不清楚。
近日,国际权威期刊Nature Cancer上在线发表了题为“CHD1 loss reprograms SREBP2-driven cholesterol synthesis to fuel androgen-responsive growth and castration resistance in SPOP-mutated prostate tumors”的最新研究成果,该研究揭示了CHD1在脂质代谢重编程中的非典型功能,即通过抑制SREBP2转录组来实现。CHD1的缺失会诱导胆固醇的产生,为肿瘤内雄激素生物合成提供原料,增强AR活性,从而导致SPOP突变前列腺癌的去势抵抗性。

研究者首先构建了一个包含CHD1缺失和SPOP突变的前列腺癌GEMM模型(PCSp),通过与仅携带SPOP突变(PSp)或CHD1缺失(PC)的小鼠模型进行对比,发现CHD1缺失与SPOP突变的组合显著加速了前列腺肿瘤的生长和疾病进展。MRI成像和组织病理学分析显示,PCSp小鼠的前列腺肿瘤表现出更高的癌变率、更多的癌灶以及更差的肿瘤分化程度,提示CHD1缺失在SPOP突变背景下对前列腺癌的恶性进展具有显著的促进作用。
进一步的研究发现,CHD1缺失的SPOP突变前列腺癌在去势手术后表现出明显的抵抗性。与对去势敏感的PSp小鼠相比,PCSp小鼠的肿瘤在去势后继续生长,肿瘤细胞的增殖和存活并未受到显著抑制。在体外细胞实验中,CHD1缺失的SPOP突变前列腺癌细胞在雄激素剥夺条件下仍能维持生长,而重新表达CHD1则可恢复其对雄激素剥夺的敏感性。这些结果表明,CHD1缺失是SPOP突变前列腺癌发展去势抵抗性的重要因素。
研究团队通过单细胞转录组学分析发现,CHD1缺失的SPOP突变前列腺癌细胞在去势后表现出胆固醇生物合成和雄激素反应相关基因的上调。脂质组学分析进一步证实,CHD1缺失导致细胞内胆固醇和胆固醇酯的积累。这些变化通过促进肿瘤内雄激素的生物合成,为AR提供了配体,从而维持了AR的核定位和转录活性,即使在去势条件下也能保持AR信号的活跃,进而促进了去势抵抗性的发展。
研究揭示了CHD1在调控胆固醇生物合成中的关键作用。CHD1缺失会诱导一系列胆固醇生物合成关键酶的表达,包括HMGCS、HMGCR、MVK、SQLE和DHCR等。这些酶的表达上调是由SREBP2(一种调控胆固醇摄取和生物合成的关键转录因子)的表达增加所驱动的。CHD1能够直接结合到SREBP2基因的启动子区域,并通过与SNF2H-ACF1染色质重塑复合体相互作用来抑制SREBP2的表达,从而发挥其对胆固醇生物合成的负向调控作用。这一发现揭示了CHD1在脂质代谢中的非典型功能,并为理解CHD1缺失如何促进前列腺癌进展提供了分子机制。
基于上述发现,研究者提出了将抗雄激素治疗与胆固醇降低药物联合使用的治疗策略。实验结果表明,这种联合治疗在CHD1缺失/SPOP突变的CRPC模型中表现出协同和持久的抗肿瘤效果。在体外细胞实验和体内肿瘤模型中,联合使用阿比特龙(一种CYP17A1抑制剂,用于阻断雄激素合成)和阿托伐他汀(一种他汀类药物,用于降低胆固醇合成)能够显著抑制肿瘤细胞的增殖,诱导细胞凋亡,并降低AR的核定位。此外,在CHD1缺失/SPOP突变的前列腺癌GEMM模型中,联合治疗也显示出显著的肿瘤缩小效果,进一步证实了这种联合治疗策略的潜力。
综上所述,本研究深入探讨了CHD1缺失在SPOP突变前列腺癌中的作用机制,揭示了CHD1通过抑制SREBP2来调控胆固醇生物合成,并通过促进肿瘤内雄激素合成来维持AR信号,从而导致去势抵抗性的发生。更重要的是,研究提出了将抗雄激素治疗与胆固醇降低药物联合使用的治疗策略,为携带CHD1缺失和SPOP突变的CRPC患者提供了新的治疗思路。这一发现不仅增进了我们对前列腺癌复杂分子机制的理解,还为开发基于生物标志物的精准治疗方案提供了重要的理论依据。未来的研究将进一步探索这种联合治疗策略在临床应用中的可行性和有效性,为改善前列腺癌患者的预后带来新的希望。
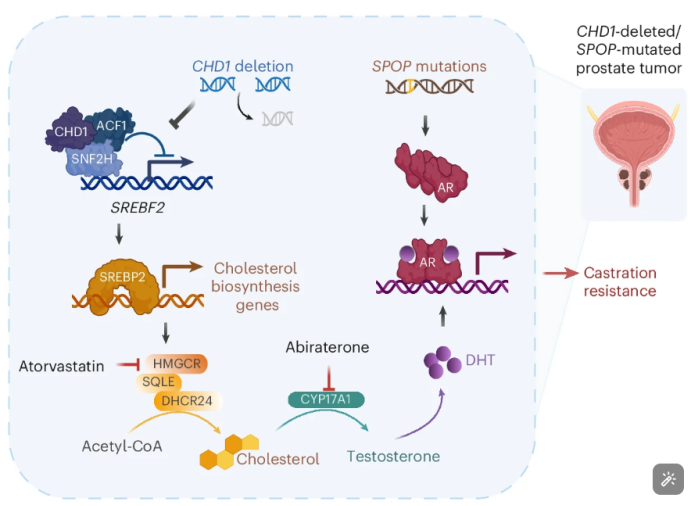
图 本研究模式图
原始出处:
CHD1 loss reprograms SREBP2-driven cholesterol synthesis to fuel androgen-responsive growth and castration resistance in SPOP-mutated prostate tumors. Nat Cancer. 2025 May 13. doi: 10.1038/s43018-025-00952-z. Epub ahead of print. PMID: 40360905.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#前列腺癌# #SPOP基因突变# #CHD1基因缺失#
10