Endocrine Reviews:运动如何逆转肥胖引发的代谢紊乱? 基于脂肪、肝脏及骨骼肌的多维解析
6小时前 MedSci原创 MedSci原创 发表于上海
本综述从分子、细胞到人体临床多个层次,系统解读了肥胖环境下运动对关键代谢器官的保护作用,尤其突出运动调控的线粒体功能、炎症状态及内分泌因子重塑。
导读
- 本文系统梳理了肥胖对代谢器官(白色和棕色脂肪组织、肝脏及骨骼肌)功能的多维影响,深入探讨了运动如何逆转这些病理性改变。
- 揭示运动不仅改善脂肪组织和肝脏的代谢功能,还通过调节分子信号(如KYNA、TGF-β2、FGF21等因子)促进代谢健康。
- 综合评述了运动与减肥药物(特别是GLP-1受体激动剂)及减重手术联用的潜力,强调多靶点组合疗法在肥胖治愈中的前景和挑战。
全球范围内肥胖率持续快速上升,预计至2030年美国约半数人口将走向肥胖。肥胖不仅引发多种代谢病如2型糖尿病(T2D)、代谢相关脂肪肝炎(MASH)和心血管疾病(CVD),还关联癌症及神经退行性疾病等多重健康风险。肥胖产生的机制复杂涉及脂肪组织(WAT、BAT)、肝脏和骨骼肌等多器官的代谢功能紊乱。运动作为减重和改善代谢功能的基石,被公认为高效且安全的干预手段,但其分子机制及与其他疗法的联合效果尚未被充分阐释。
近日,发表在Endocrine Reviews发表了一篇题为“Obesity and Exercise: New Insights and Perspectives”的综述论文,聚焦于肥胖与运动之间的相互作用,及其对代谢健康的影响。文章全面分析了肥胖诱导的代谢异常机制,解读了运动介导的代谢调节路径,并探讨了运动与现有减重疗法如GLP-1受体激动剂及减重手术的整合应用,力图为临床肥胖治疗提出新思路。

研究结果
1.肥胖对代谢组织的影响及运动的益处
(1)白色脂肪组织(WAT)
肥胖导致WAT显著炎症反应,M1型巨噬细胞浸润及促炎因子(TNF-α,IL-6)升高,引起胰岛素抵抗。肥大脂肪细胞伴随线粒体功能下降(PGC1α、NRF1、TFAM表达减少),活性氧(ROS)生成增加,扰乱能量代谢。运动可逆转炎症状态、促进脂肪酸氧化和线粒体生物合成,显著减轻胰岛素抵抗和代谢紊乱。此外,运动诱导的代谢中介物KYNA通过GPR35/AMPK/SIRT6途径,促进脂肪组织热量代谢转化及抗炎作用,改善糖脂代谢。
人群研究显示,3至12周的有氧或阻力训练降低BMI、体脂百分比与循环促炎细胞因子,提升肌肉及脂肪组织线粒体功能与代谢基因表达,尽管运动对WAT中UCP1和PRDM16的“褐化”效应在人类中不明显,动物模型中则表现突出,这与动物实验条件(如常温冷应激)及物种差异相关。
(2)棕色脂肪组织(BAT)
肥胖引起BAT线粒体功能障碍,ROS生成及炎症增加,影响热生成能力。运动在动物中提升BAT质量及促热基因表达(PGC1α、UCP1),促进脂肪酸摄取与氧化,释放数种功能性“棕脂细胞因子”,如12,13-diHOME促进肌肉脂肪酸摄取,FGF21介导脂质代谢调节。人类运动对BAT葡萄糖摄取影响有限,甚至可能降低,但运动增加batokine释放能力,提示BAT的内分泌作用是其代谢益处的重要机制。
(3)肝脏
肥胖导致肝脏脂代谢失衡,游离脂肪酸过载,促进脂肪肝、炎症及纤维化,形成MAFLD/MASH。运动能显著减少肝脏甘油三酯积累,改善胰岛素信号传导(激活AMPK、SIRT1、PPARα途径),降低脂质合成基因表达(SREBP1、FAS、CD36),促进脂质氧化,减轻肝脏炎症和氧化应激。临床研究表明,短期有氧或阻力训练降低肝脏脂肪含量及炎症因子,维持外周及肝脏胰岛素敏感性,且降低FGF21水平与脂肪肝严重度关联。
(4)骨骼肌
肥胖状态下,肌肉葡萄糖摄取受阻,胰岛素信号下调(IRS1、Akt磷酸化减少),脂代谢紊乱导致肌肉脂肪沉积,线粒体生物合成障碍。运动介入通过促进GLUT4转位,激活AMPK和TBC1D4,恢复胰岛素敏感性与线粒体功能,改善脂肪酸氧化,促进代谢健康。运动还调节肌肉分泌的多种myokines(如IL-6、metrl、irisin),参与抗炎和能量调节,缓解代谢性疾病。
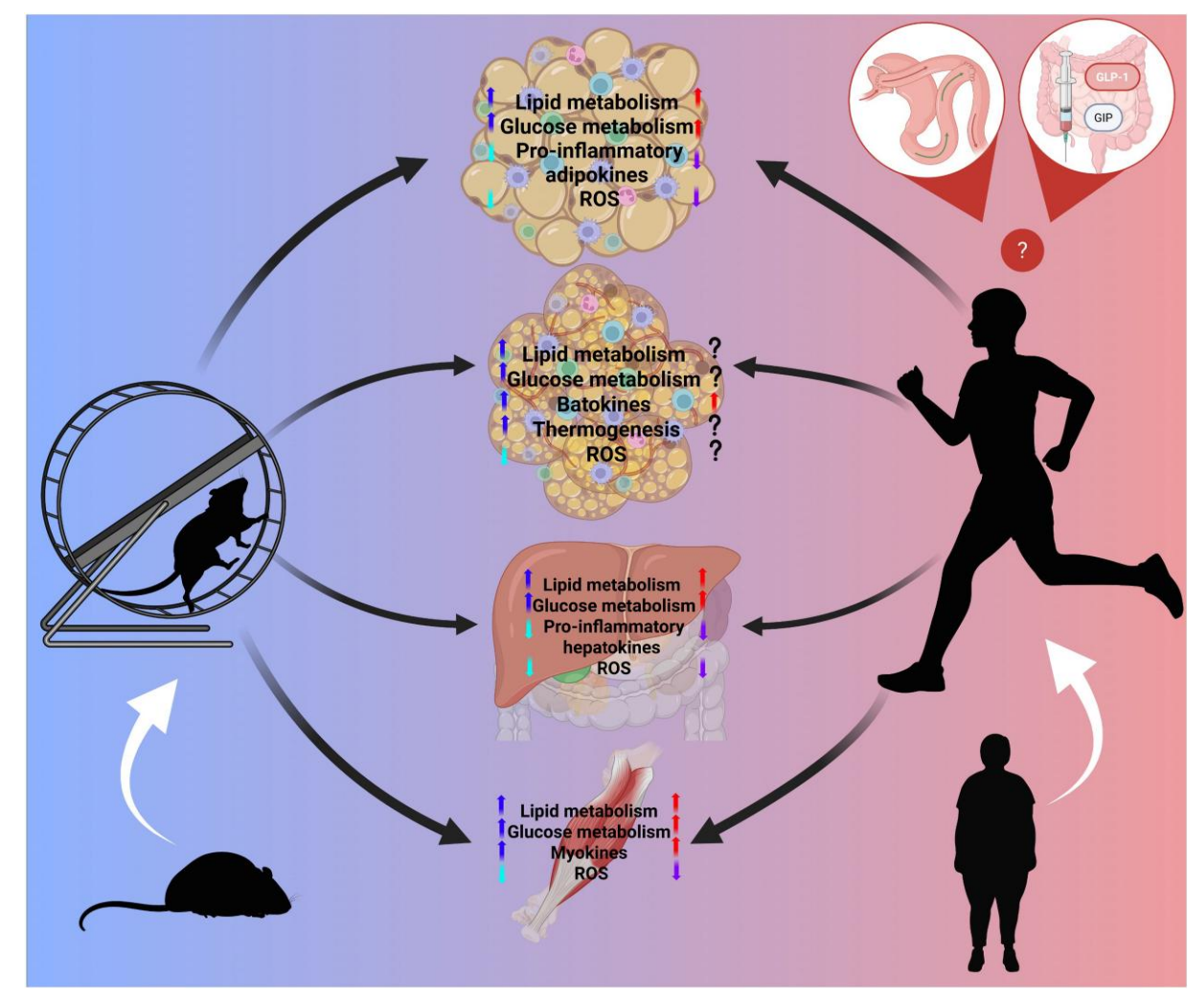
图:运动对代谢组织脂肪和肝肌功能的影响示意图
2.联合疗法新进展
(1)运动+GLP-1受体激动剂
GLP-1RA能显著促进体重下降和改善糖脂代谢,同时影响胃排空和食欲调控。研究证实,运动与GLP-1RA(liraglutide、semaglutide、tirzepatide)联合使用,可放大减重效果,降低脂肪比例,改善胰岛素敏感性及心血管风险。长期随访发现运动可延缓GLP-1RA停药后的体重反弹,维持部分疗效。尽管部分研究提示GLP-1RA单独使用可能增加骨质疏松风险,联合运动则有助于骨密度维持。不同人群、剂量和运动类型对疗效的影响还有待进一步深入探讨。
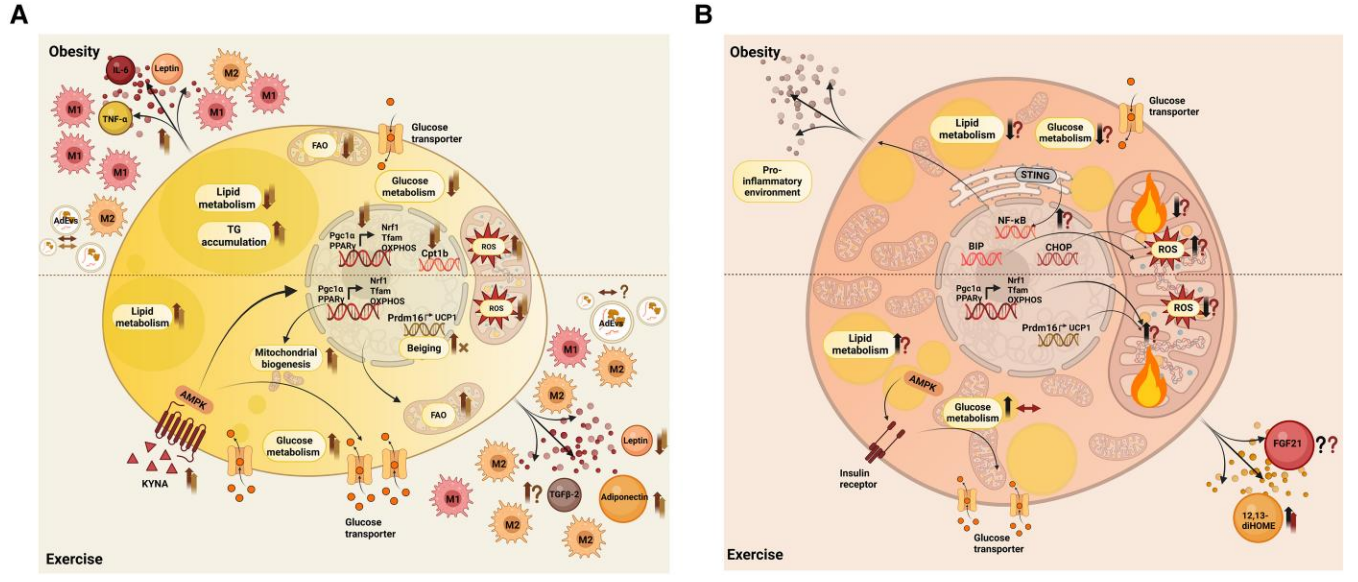
图:a) 肥胖状态下WAT的分子改变,以及运动对动物和人类中异常机制的影响;b) 肥胖状态下BAT的分子改变,以及运动对动物和人类中异常机制的影响
(2)运动+减重手术
减重手术(如Roux-en-Y胃旁路术和袖状胃切除)可实现10年以上的持续减重。术后常伴肌肉量丢失及体能衰退。研究显示术前及术后结合有氧及阻力训练,能增强肌力、耐力及功能,延长术后益处,减少体重反弹。此外,运动改善的代谢指标往往与体重变化无关,突出运动本身的治疗价值。术前运动能提升术中和术后恢复水平,建议形成手术整体管理多学科新模式。
3.遗传因素与运动的交互作用
肥胖的发生既有复杂的环境影响,也受多基因遗传调控。单基因(Leptin受体、FTO等)及多基因变异均可提高肥胖风险。部分遗传变异影响能通过运动“逆转”或缓解。运动可修饰表观遗传机制(DNA甲基化、miRNA表达)影响基因表达,改善脂肪分布和代谢健康。研究提示,运动不可能完全克服遗传缺陷,但可部分缓冲遗传易感性,发挥重要防治作用。
综上,本综述从分子、细胞到人体临床多个层次,系统解读了肥胖环境下运动对关键代谢器官的保护作用,尤其突出运动调控的线粒体功能、炎症状态及内分泌因子重塑。该文提升了我们对运动治疗肥胖及其复杂代谢异常的认识,强调了脂肪组织的异质性与动物-人类间代谢调控的差异,更提出运动与临床药物及手术联合应用的新理念。面对肥胖多元致病机制与日益严峻的公共卫生挑战,研究结果促使我们重新审视单一疗法的局限性,鼓励发展基于个体化代谢状态的综合干预策略。未来深入挖掘运动介导的信号分子网络及代谢器官间通讯,将有助于精准设计有效的肥胖管理方案,推动减少肥胖相关疾病负担,改善人群健康。
原始出处:
James NM, Stanford KI. Obesity and Exercise: New Insights and Perspectives. Endocrine Reviews, 2025, Vol. 00, No. 0, pp.1–27. Published by Oxford University Press on behalf of the Endocrine Society. https://doi.org/10.1210/endrev/bnaf017

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#肥胖# #运动#
4 举报