JHO:双重免疫检查点抑制在复发难治性鼻咽癌及实体瘤疗效探索——抗LAG-3抗体LBL-007联合抗PD-1抗体Toripalimab的临床进展
16小时前 吾乃喵大人 MedSci原创 发表于上海
该研究结果不仅对NPC免疫治疗策略优化具有重要指导意义,也为探索其他高LAG-3表达肿瘤的免疫治疗新组合提供有力证据。
亮点总结
- 首次报道抗LAG-3抗体LBL-007与抗PD-1抗体Toripalimab联合治疗晚期鼻咽癌(NPC)及其他实体瘤的安全性及有效性,展示对免疫治疗初治NPC患者显著的抗肿瘤活性。
- LAG-3高表达患者客观缓解率(ORR)显著优于低表达群体,提示LAG-3表达有潜力成为疗效预测生物标志物。
- 双免疫检查点抑制方案耐受性良好,3/4级治疗相关不良事件发生率低,未见治疗相关死亡,免疫相关不良事件可控。
免疫检查点抑制剂(ICI)革命性改变多种恶性肿瘤治疗格局,尤其是PD-1/PD-L1单抗取得突破性疗效。然而,单一PD-(L)1通路抑制在晚期实体瘤中整体缓解率有限,多数患者存在耐药或反应不足,亟需新的联合免疫策略优化疗效。LAG-3作为T细胞耗竭表面抑制分子,与PD-1常在肿瘤浸润淋巴细胞中共表达,抑制T细胞有效免疫功能。已有研究显示LAG-3和PD-1双重阻断能协同激活耗竭CD8+T细胞,增强其增殖及细胞毒性,从而提升抗肿瘤响应。RELATIVITY-047试验在黑色素瘤中证实了此机制的临床价值,获得FDA批准,但外推至鼻咽癌等高LAG-3表达实体瘤的疗效与安全性尚待验证。
一项放标签、单臂、多中心Ib/II期临床试验(注册号NCT05102006),评估了新型全人源抗LAG-3单克隆抗体LBL-007联合抗PD-1抗体Toripalimab疗法在晚期既往治疗失败的鼻咽癌(NPC)患者及多种实体瘤患者中的安全性和抗肿瘤活性。研究于2021年11月至2023年12月间完成,纳入80例患者,涵盖鼻咽癌、小细胞肺癌、非小细胞肺癌、食管癌、头颈鳞癌及宫颈癌等多种实体瘤。试验结果发表于Journal of Hematology & Oncology杂志。

本研究招募具有组织学/细胞学确诊的晚期(转移性和/或不可切除)恶性肿瘤患者。纳入患者必须既往接受过标准治疗且病情进展,免疫治疗状态分为初治(IO-naive)或既往免疫治疗失败(IO-treated)。参与者ECOG评分为0-1,具备可测量病灶,器官功能良好。
Ib期采取LBL-007 200 mg或400 mg(每3周静脉注射)联合Toripalimab 240 mg,10例剂量递增评估安全性及确定推荐Ⅱ期剂量(RP2D);Ⅱ期中选定LBL-007 400 mg联合Toripalimab 240 mg治疗70例患者。疗程最长达2年,至疾病进展或不可耐受毒性终止。疗效主要评估客观缓解率(ORR),安全性包括不良事件(AE)、治疗相关不良事件(TRAEs)、免疫相关不良事件(irAEs),并探索LAG-3及PD-L1表达对疗效的预测价值。
研究结果
患者特征与随访
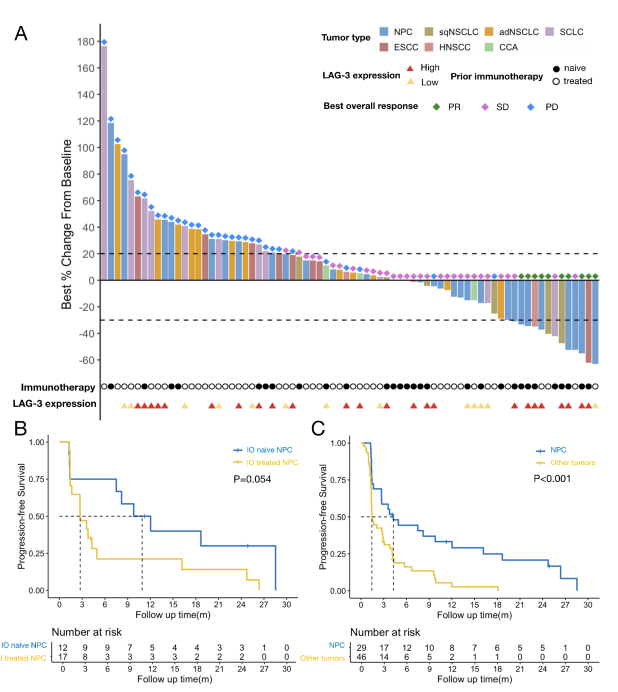
共80例患者入组,鼻咽癌30例(37.5%),其他实体瘤50例(62.5%),包括小细胞肺癌、非小细胞肺癌、食管鳞癌、头颈鳞癌及宫颈癌等。患者中58.8%接受既往免疫治疗,43.8%接受过≥2线化疗。截止随访(2024年7月),中位随访时间26.0个月,治疗中位持续时间5.0个月(0.3-24.7个月)。全部患者因疾病进展、同意撤回等原因停药,5例完成2年疗程。
安全性分析
Ib期未发现剂量限制性毒性(DLT),LBL-007 400 mg被确定为Ⅱ期推荐剂量。全部80名患者均纳入安全分析,76.3%发生治疗相关不良事件(TRAEs),11.3%为3/4级。常见3/4级TRAEs包括贫血(2.5%)、低钠血症(2.5%)、谷丙转氨酶升高(2.5%)、谷草转氨酶升高(1.3%)、及乏力(1.3%)。治疗相关严重不良事件发生率10%,7.5%因TRAEs停药,未见治疗相关死亡。免疫相关不良事件中以甲状腺功能减退(10%)、肝酶升高及乏力最常见。所有免疫相关不良事件均可通过糖皮质激素有效控制。
抗肿瘤活性
除5例无疗效评估资料患者外,75例患者可评估疗效,10例(13.3%)达部分缓解(PR),其中NPC患者6例占主导,其他肿瘤包括肺鳞癌、小细胞肺癌、头颈鳞癌、食管鳞癌各少数例。无完全缓解(CR)病例。病情控制率(DCR)达54.7%。
Kaplan-Meier 生存曲线:LBL-007 联合Toripalimab在晚期实体瘤患者中的疗效
值得注意的是,IO-naive NPC患者疗效明显优于既往IO治疗组。此外,83.3%的NPC缓解患者缓解持续超过12个月,显示联合免疫治疗持久抗癌能力。
LAG-3及PD-L1表达与疗效相关性
38名患者具有完整的基线肿瘤样本及免疫标志物数据。高LAG-3表达(2+及以上)者ORR达28.0%,低表达组仅7.7%。在NPC患者中,高表达组ORR为40%,低表达者为20%。PD-L1表达差异对ORR影响有限,表明LAG-3可能是更敏感的治疗反应预测因子。
表. LAG-3和PD-L1表达水平与治疗反应的关系

研究价值与意义
本研究统评估抗LAG-3抗体LBL-007联合抗PD-1抗体Toripalimab在晚期鼻咽癌及其他实体瘤患者中的临床应用,填补了抗LAG-3联合免疫治疗在NPC领域的空白。联合方案对于免疫治疗初治的NPC患者显示出明显优于既往单药PD-1抑制剂的客观缓解率及无进展生存期,缓解持续时间长,表明联合阻断LAG-3和PD-1可以有效逆转肿瘤免疫耐受、克服T细胞耗竭。
此外,数据提示高表达LAG-3肿瘤微环境的患者可能从该联合治疗中获益更多,这为后续患者筛选及个体化治疗提供了依据,推动精准免疫疗法的发展。安全性分析显示联合治疗总体耐受良好,不良事件发生率与此前报道相似,无新增安全隐患。
该研究结果不仅对NPC免疫治疗策略优化具有重要指导意义,也为探索其他高LAG-3表达肿瘤的免疫治疗新组合提供有力证据。结合未来大样本、多中心随机试验,有望进一步确立臨床价值及指导临床实践。
原始出处
Chen G, Sun DC, Ba Y, et al. Anti-LAG-3 antibody LBL-007 plus anti-PD-1 antibody toripalimab in advanced nasopharyngeal carcinoma and other solid tumors: an open-label, multicenter, phase Ib/II trial. Journal of Hematology & Oncology. 2025;18(15). https://doi.org/10.1186/s13045-025-01666-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















LAG-3高表达患者客观缓解率(ORR)显著优于低表达群体
0 举报
#鼻咽癌# #Toripalimab#
4 举报