JAMA 子刊:AI赋能黑色素瘤淋巴细胞浸润评估,提升诊断一致性与预后价值
23小时前 MedSci原创 MedSci原创 发表于上海
本研究代表着当前黑色素瘤TIL评估领域最大的多中心、多操作员AI验证项目,首度系统比较了AI算法与传统路径学家的评分一致性及临床预后价值。
黑色素瘤中的肿瘤浸润淋巴细胞(TILs)作为肿瘤微环境关键成分,是免疫治疗反应和生存预后的重要生物标志物。传统检验依赖病理学家肉眼读取染色切片进行TIL评估的方法,因缺乏标准化及高主观性,导致不同观察者间评估结果差异显著,影响临床决策的稳定性。随着数字病理与人工智能技术的进步,机器学习算法有望克服人工读取的偏差,实现标准化、可重复的TIL量化。然而,迄今为止尚缺乏大规模、多操作员参与的独立验证,特别是将AI工具的分析学作用与传统诊断路径进行直接对比的实证数据。
近日,发表在JAMA Network Open杂志的一项国际多中心预后研究中,研究团队通过对111例黑色素瘤患者及多达98名操作人员(涵盖专业病理学家与科学家)的60幅数字化切片,系统评估了AI驱动的TIL定量工具(ANNMAR_24算法)与传统病理分级读数的分析学及临床有效性。AI算法基于经过标准色彩归一化的全切片图像,自动识别并分类肿瘤细胞、免疫细胞和间质细胞,实现多维度TIL参数的定量输出。

本项研究纳入两个回顾性皮肤黑色素瘤患者队列:澳大利亚黑色素瘤研究所(MIA)训练集(103份全切片图像)及耶鲁大学测试集(111例患者,111幅切片)。研究通过国际公开招聘获取了包括病理学家与科学家共98名认证操作员参与,分为AI辅助组(58人)和传统手工评估组(40人),所有参与者均通过美国FDA指定的TIL评分培训。
AI辅助组操作员使用开放源代码工具QuPath运行 ANN_MLP多层感知分类器处理经过色彩标准化的千级像素级全切片图像,完成肿瘤区域标注后机器自动定量各类TIL指标,如eTILs(电子TIL百分比)、eaTILs(面积归一单位TIL密度)等。传统组病理学家依据Clark系统和TIL工作组评分准则完成人工半定量评估。
通过统计计算ICC(组内相关系数)和Kendall W值,分别衡量两个评分体系的操作员间一致性。同时,采用生存分析和多变量Cox回归,评估AI与人工TIL评分与临床随访数据(中位随访时间均超过5年)中疾病特异性生存的关联。
主要研究结果
1,参与者与队列特征:
测试集111名患者中男女比例近1:1,中位诊断年龄61岁,74.8%为I期疾病。两组操作员共39个机构参与,AI组中除11名病理学家外,包含多名非病理学背景科学家,体现多样化实际操作背景。
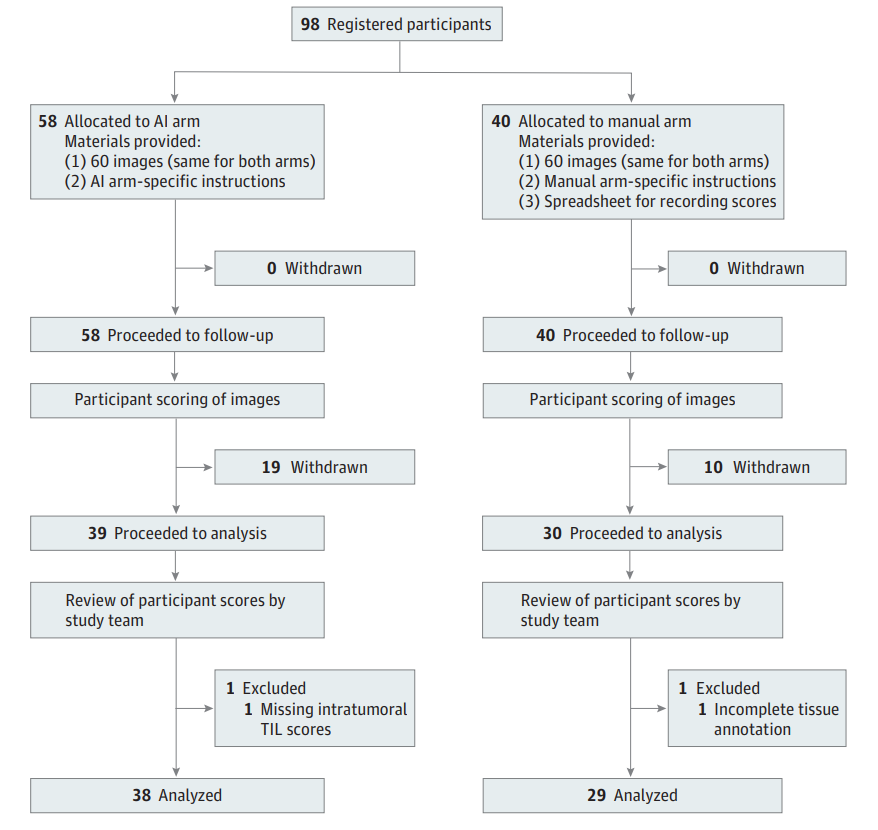
图:参与者流程图,展示参与者分组与筛选状况
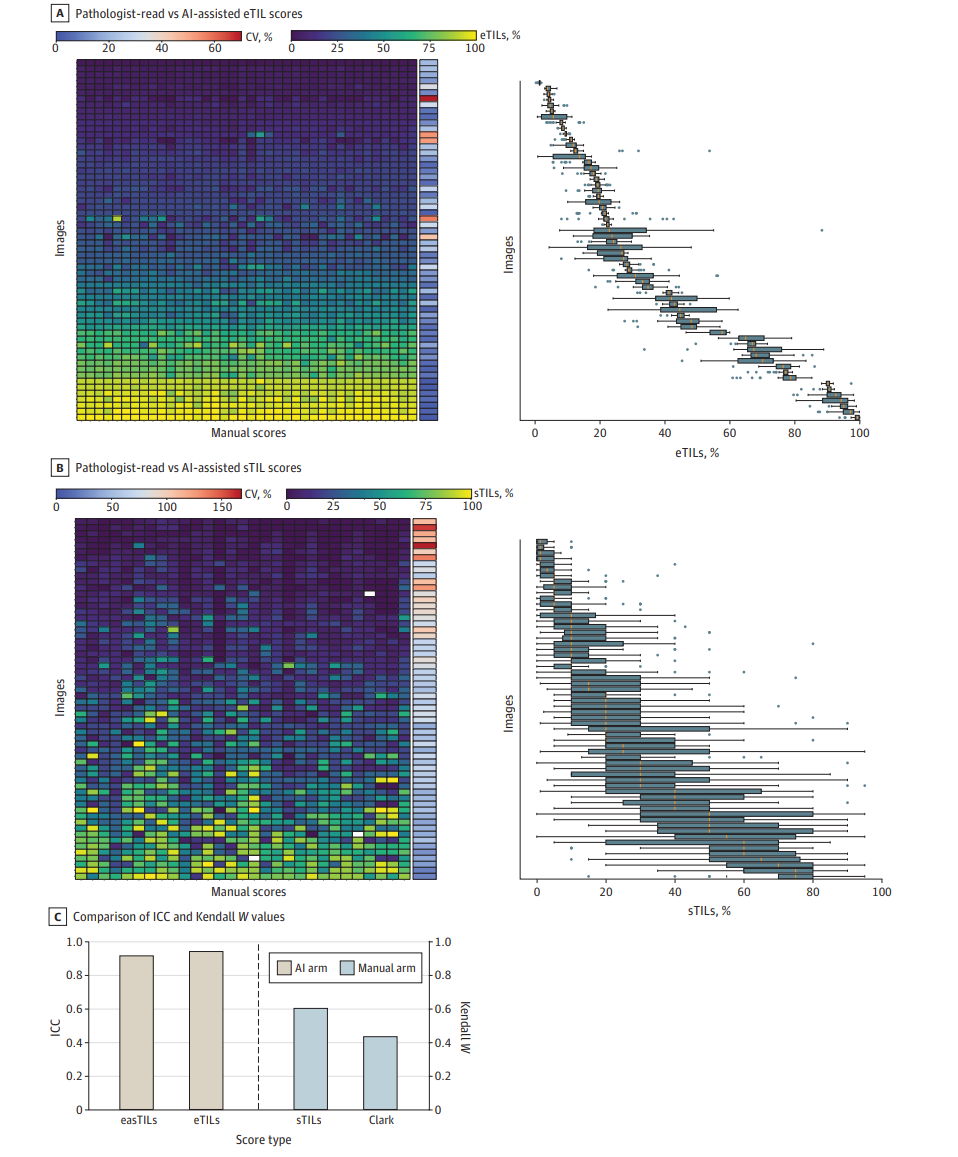
图:AI辅助组vs手工组的TIL评分一致性对比及变量表现
2,AI算法性能与 reproducibility
ANN_MLP算法对肿瘤及免疫细胞分类的F1评分分别为0.80及0.70,显示较高的检测准确率和召回率。AI辅助组多个TIL指标间ICC均超过0.90(如eTILs百分比ICC=0.94),明显高于手工评估中sTILs的ICC=0.60,以及Clark评分的Kendall W=0.44,显示出极其优异的操作员间一致性。
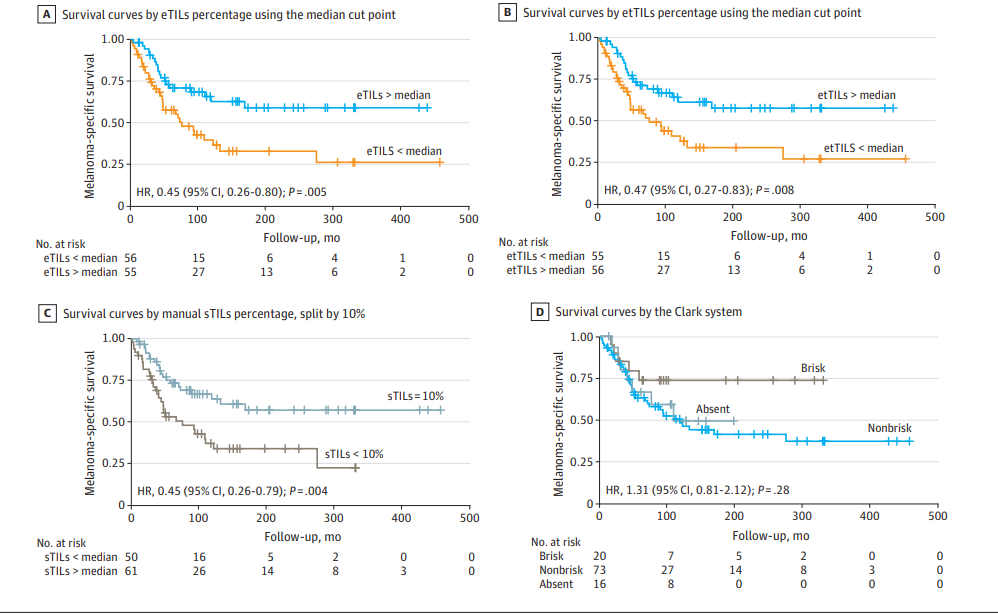
图:基于eTILs和手工sTILs评分的生存曲线对比,揭示AI分数的预后优势
3,不同背景操作员间表现一致:
AI组中,拥有病理学资质的和非资质操作员使用AI工具得到的ICC相近,表明算法操作门槛低且稳定。
4,临床预后关联:
- 使用AI定量eTILs指标,基于中位数切点分析,患者生存受益显著,HR=0.45(95%CI,0.26-0.80,P=0.005)。
- 采用此前文献定义的16.6%作为cutoff,依然表现统计学显著的预后意义(HR=0.56,P=0.04)。
- 传统Clark分级分类在预后中未见统计学显著关联(HR=1.31,P=0.28)。
- 多变量分析中,仅AI驱动的TIL评分及肿瘤分期对疾病特异性生存独立相关。
讨论与研究意义
本研究代表着当前黑色素瘤TIL评估领域最大的多中心、多操作员AI验证项目,首度系统比较了AI算法与传统路径学家的评分一致性及临床预后价值。AI驱动的ANNMAR_24算法通过标准色彩归一化和精准的细胞类型分类,有效降低了主观干扰,极大提升了TIL量化的再现性,终结了传统手工评分因个体经验差异而产生的波动。
鉴于免疫检查点抑制剂治疗仅部分患者获益,准确可靠的肿瘤免疫环境评估亟需稳定的生物标志物。AI定量TIL评分不仅与患者生存显著相关,展现独立预后能力,更为定量标准化免疫微环境提供坚实工具,未来有望指导精准免疫治疗决策。
尽管本研究基于回顾性数据,限制了对临床应用的直接证明,但公开共享了AI工具与数据,促进了后续多中心的验证和潜在临床试验,助力AI整合进日常黑色素瘤管理。该研究为数字病理和免疫肿瘤学领域树立了分析标准,推动数字化转型的临床落地。
原始出处:
Aung TN, Liu M, Su D, et al. Pathologist-Read vs AI-Driven Assessment of Tumor-Infiltrating Lymphocytes in Melanoma. JAMA Netw Open. 2025;8(7):e2518906. doi:10.1001/jamanetworkopen.2025.18906
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言



















随着数字病理与人工智能技术的进步,机器学习算法有望克服人工读取的偏差
0 举报
#TILs#黑色素瘤中的肿瘤浸润淋巴细胞(TILs)作为肿瘤微环境关键成分,是免疫治疗反应和生存预后的重要生物标志物。
6 举报
#黑色素瘤# #淋巴细胞浸润#
6 举报