杨浩/杨璐/王威亚/刘珊团队ACS Nano:化学亲和法捕获血浆细胞外囊泡实现前列腺癌蛋白标志物的深度鉴定与验证
2025-04-28 BioMed科技 BioMed科技 发表于陕西省
四川大学华西医院等团队针对血浆 EV 分离难题,构建 TiO₂亲和捕获结合非依赖型质谱的分析体系,发现前列腺癌 EV 蛋白标志物 GDF15,经多队列验证,可辅助无创精准诊断,为临床应用提供支撑。
近日,四川大学华西医院器官移植研究所杨浩研究员、泌尿外科杨璐教授、病理科王威亚教授团队联合四川省人民医院医学遗传与罕见病中心刘珊研究员团队在ACSNano发表文章"Chemical Affinity Capture of Plasma Extracellular Vesicles Enables Efficient and Large-Scale Proteomic Identification of Prostate Cancer Biomarkers"。本研究针对血浆细胞外囊泡(EV)分离的挑战和临床样本的大规模与复杂性,建立了一套高效的EV分析体系,该体系整合了TiO2化学亲和捕获与数据非依赖型质谱采集方法,可实现临床大队列样本EV的高通量分离和蛋白质组学检测。应用该方法,该研究从大规模血浆样本中寻找到了具有良好诊断效果的前列腺癌EV蛋白标志物—生长分化因子15(GDF15),进一步在多个独立队列中对该标志物进行了验证,确定了其对前列腺癌的诊断能力以及对不同分期前列腺癌的辨别能力,有望促进临床前列腺癌的无创精准诊断。

【研究要点】
前列腺癌(PCa)是威胁男性健康的常见恶性肿瘤,对其进行筛查有利于早期临床干预,降低疾病负担。目前,临床PCa的早期筛查手段,如血清前列腺特异性抗原(PSA)检测,其肿瘤特异性较差,极易导致过度诊断和不必要的活检。因此,寻找高特异灵敏且非侵入性的生物标志物来辅助PCa的早期精准诊断具有重要的临床价值。细胞外囊泡是液体活检领域的重要研究对象,其广泛存在于各类体液之中,具有良好的稳定性,包含丰富多样的分子内含物,并能反映早期病理变化,被视为新型生物标志物的重要来源。但目前尚缺乏标准可靠的方法来从大规模复杂的临床体液样本中获得EV,从而限制了EV来源标志物的临床应用。
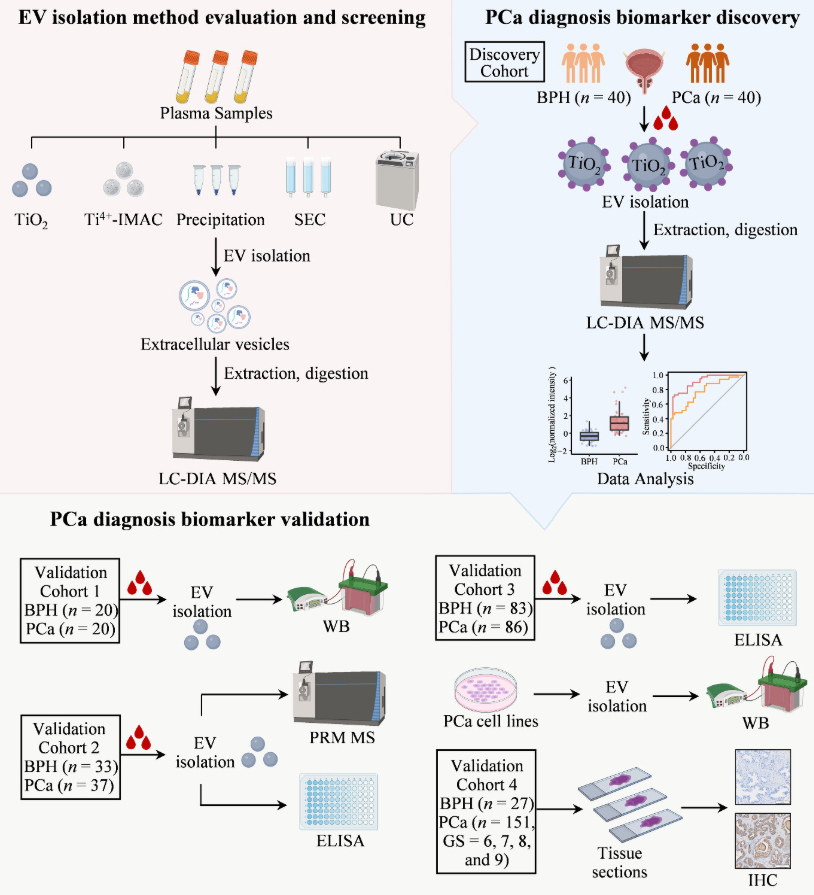
1.研究设计。
该研究结合文献综述和蛋白质组学分析,系统地考察了多种常用血浆EV分离方法的特点和效果,并筛选出了TiO2亲和捕获法作为临床大队列血浆EV富集的优选方法。该方法基于Ti(IV)与EV表面磷脂双分子层的磷酸发生螯合作用来分离EV,具备良好的EV分离回收率(~75%)和重现性(CV<20%),富集速度快(~30 min),通量高(可以处理上百例样品/天),成本低,物料用量少(100 μL血浆和约2mg TiO2微球),操作简单方便,无需特殊设备。并且与下游蛋白质组学检测兼容性好,在蛋白鉴定深度上优于常用的试剂盒沉淀法、体积排阻法、超速离心法以及其他化学亲和法,同时具有优良的蛋白定性和定量重现性,受血浆高丰度蛋白干扰小。进一步整合TiO2亲和捕获法和数据非依赖型蛋白质组学技术,该研究构建了一套简单、快速、稳定、低成本、高通量的血浆EV分析体系,适用于临床大队列样本的高效EV分离和检测。
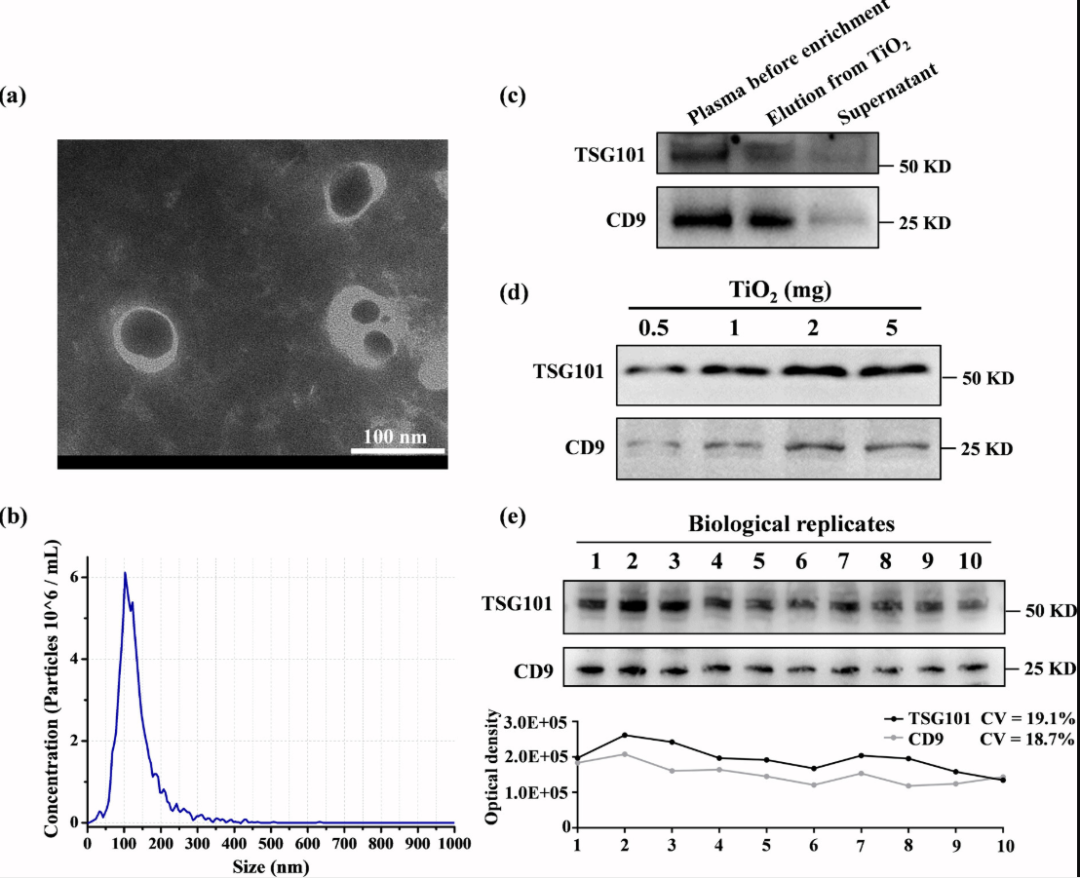
图2. TiO2亲和捕获法分离血浆EV的表征。
该研究进一步聚焦于PCa的体液检测,应用建立的血浆EV分析体系,对80例PCa和良性前列腺增生(BPH)患者的血浆EV进行富集和检测。共鉴定到1183个蛋白,其中87%归属为EV蛋白,且与前列腺和前列腺疾病密切相关,能准确地反映样本特征和疾病性质。进一步结合生物信息学分析,筛选出了系列潜在的EV蛋白质组诊断标志物,可显著地区分PCa和BPH。同时,定量评估了差异表达蛋白的诊断潜力,从中筛选出了具有良好诊断效果的候选EV蛋白标志物—生长分化因子15(GDF15),其预测AUC值可达0.908,优于临床PSA指标(AUC0.781)。
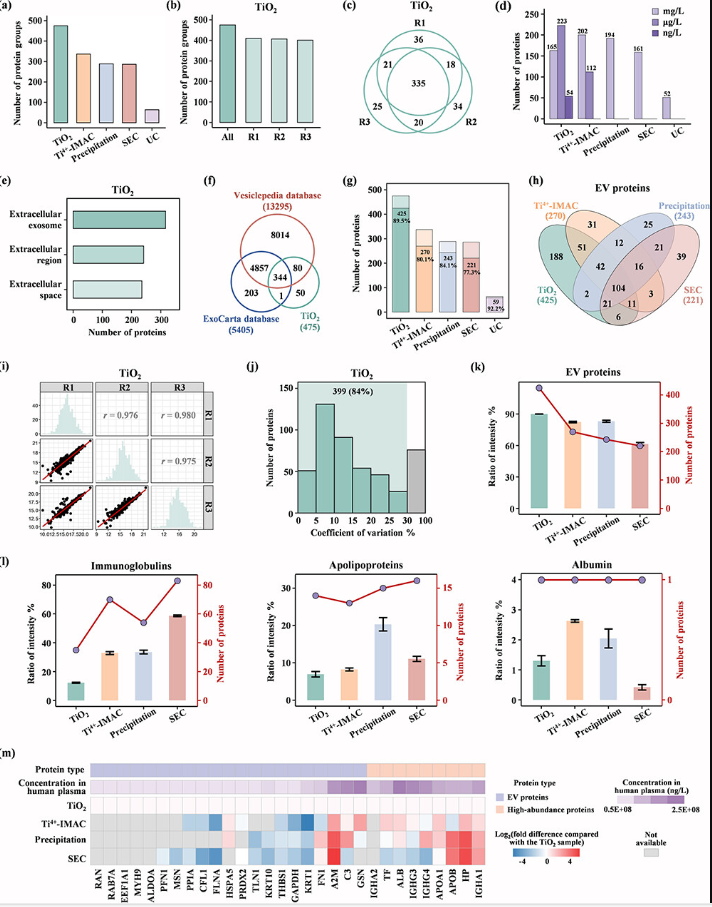
图3. 蛋白质组学分析比较五种EV分离方法的效果。
在包含457例样本的四组独立队列中,该研究进一步对GDF15的诊断能力进行了验证。首先,研究使用传统的WB初步验证了EV_GDF15对PCa和BPH的区分效果,其优于血浆GDF15和临床PSA指标。不仅如此,通过WB分析还发现血浆和EV中GDF15还存在着亚型的差异,血浆中主要为分泌的成熟亚型,而EV中同时包含了较多的成熟亚型和其未剪切的前体蛋白。随后在第二组队列中,同时使用两种高通量检测方法,即经典的ELISA和新兴的平行反应监测靶向定量质谱技术,证实了GDF15在PCa中的显著高表达,且二者的结果具有很强的相关性,也表明了这两种正交方法的可靠性。为了进一步验证GDF15的诊断能力及其与临床PSA的协同效果,本研究在更大的队列中使用ELISA对GDF15进行检测。结果显示,PCa组中血浆EV_GDF15的浓度为33.31pg/mL(中位数),而BPH组则为17.98pg/mL。使用机器学习算法来评估GDF15与临床PSA的联合诊断效果,发现二者联合能显著提高诊断的准确性(0.843)、灵敏度(0.875)、特异性(0.815)和AUC值(0.864),显示出了明显的协同效应。即使在临床PSA诊断灰区,GDF15与PSA的联合仍然能显著增强PSA的诊断能力。最后,该研究在前列腺癌细胞和组织中验证了GDF15的表达和对不同分期PCa的辨别能力。结果表明,PCa细胞和组织是血浆GDF15阳性EV的来源之一。而定量免疫组化分析显示,相较于BPH,GDF15在PCa组织中的表达显著上调,并且该蛋白在Gleason评分为7和8的PCa组织中的表达量明显高于评分为6的组织,显示出GDF15对不同分期PCa的辨别潜力,特别是对于低风险(6分)和高风险(≥7分)PCa的早期检测。
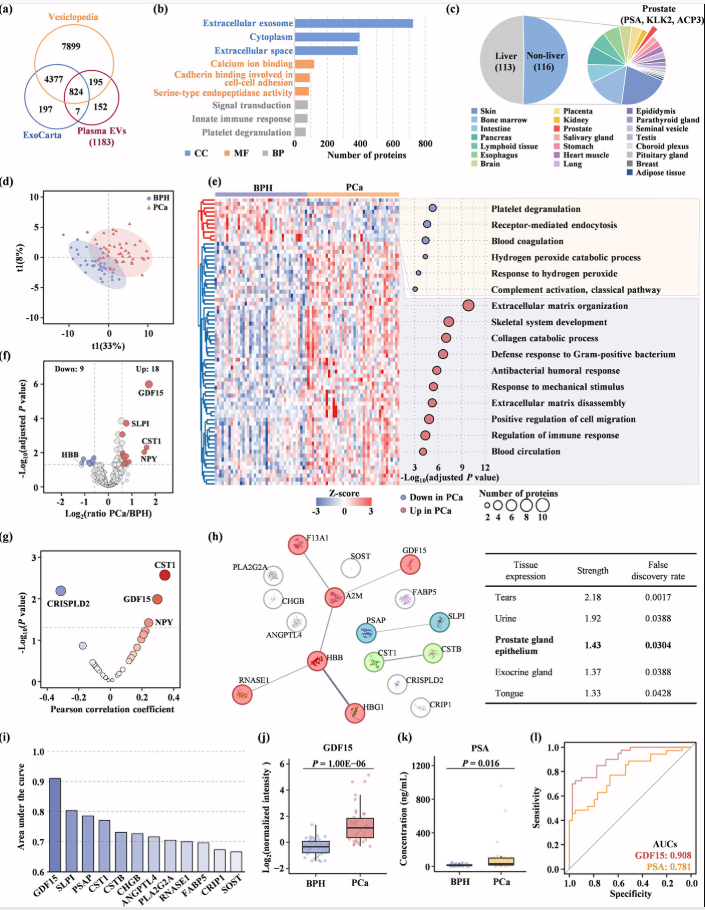
图4. TiO2亲和捕获与蛋白质组学检测前列腺癌和良性前列腺增生血浆EV。
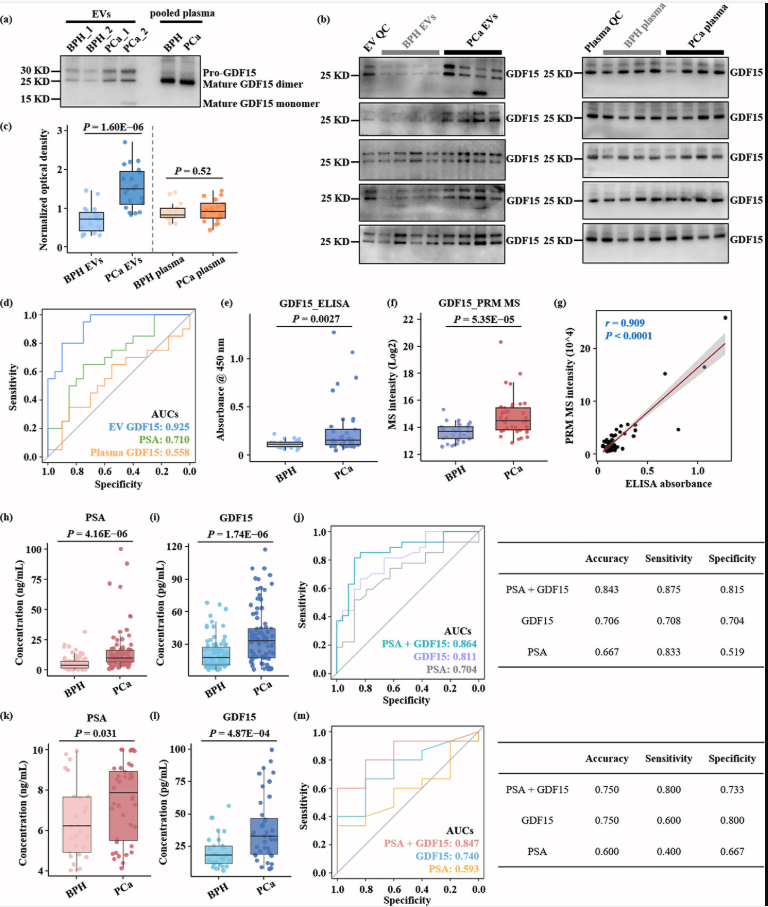
图5. GDF15蛋白对前列腺癌诊断能力的验证。
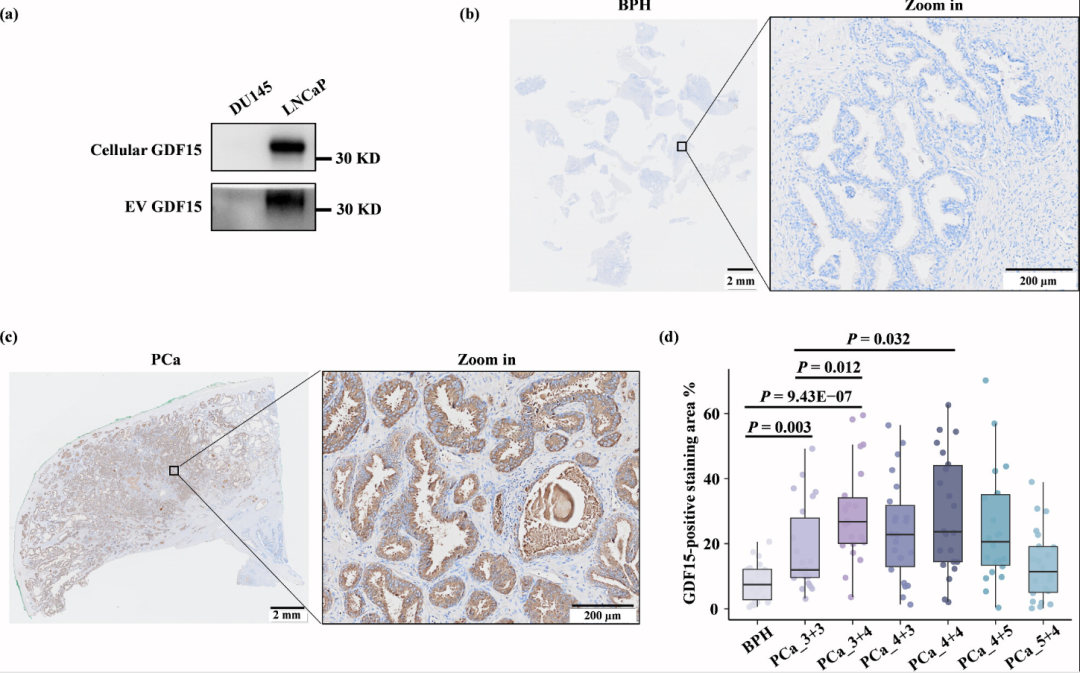
图6. GDF15蛋白在前列腺癌细胞和组织中的表达验证。
【总结展望】
为了解决大规模血浆EV蛋白质组学分析的技术难题,基于TiO2的化学亲和捕获法在现有EV分离技术中展现出显著优势。该方法具有通量高、重现性好、操作简便快速、蛋白覆盖度广、经济实用等关键特点。通过将其与数据非依赖型蛋白质组学技术联用,该研究成功鉴定出一组潜在的前列腺癌EV生物标志物,其中GDF15在区分PCa与BPH患者方面表现出优越的诊断潜力。随后在多个独立队列中,该蛋白作为独立生物标志物或与PSA联用的组合标志物均展现出稳健的预测效能。这些发现不仅证实了GDF15作为无创诊断标志物的临床应用前景,更为推动大规模多中心临床研究以验证其临床价值提供了理论依据。该研究所建立的EV富集与检测方案联合更为灵敏和高通量的Orbitrap Astral等质谱仪,将为EV生物标志物的发现及临床转化提供重要的技术支撑。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.5c01564
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#前列腺癌# #血浆细胞外囊泡#
11