【论著】|弥漫性大B细胞淋巴瘤基因变异特征与18F-FDG PET/CT SUVmax的关系解析及其临床意义
14小时前 中国癌症杂志 中国癌症杂志 发表于上海
本研究旨在分析DLBCL的分子遗传学特征与治疗前经18F-FDG PET/CT检测的基线SUVmax值之间的相关性,及其与临床病理学特征、R-CHOP治疗反应的相关性,并探讨其潜在的临床意义。
[摘要]背景与目的:弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)分子遗传学特征和患者治疗前18F-FDG PET/CT检查评估的SUVmax值均与患者预后密切相关,但两者的关系及其与R-CHOP治疗方案治疗反应的相关性尚不清楚。本研究旨在分析DLBCL分子遗传学特征与治疗前经18F-FDG PET/CT检测的SUVmax值的关系及其与临床病理学特征、R-CHOP治疗反应的相关性。方法:回顾性收集复旦大学附属肿瘤医院2022—2023年同时经淋巴瘤481基因DNA panel二代测序(next-generation sequencing,NGS)和治疗前经PET/CT检查的DLBCL患者225例,本研究通过复旦大学附属肿瘤医院医学伦理委员会的审查(伦理批号:050432-4-2307E)并获得患者知情同意;除基因突变特征外,同时收集荧光原位杂交法检测的BCL2、BCL6和MYC基因易位情况;另收集该组病例的临床病理学参数以及经R-CHOP治疗后的PET/CT检查结果。结果:总计191例DLBCL患者纳入最终分析,重要基因MYD88突变、TP53突变、CDKN2A/2B拷贝数异常、CD79B突变发生率分别为24.6%、27.2%、32.5%和16.8%。治疗前SUVmax值范围是5.10~63.10(24.44±10.70,中位22.80)。MYD88L265P突变型DLBCL的治疗前SUVmax值显著高于MYD88野生型DLBCL(P=0.039),SUVmax值与DLBCL其他基因变异类型包括TP53突变、CDKN2A/B拷贝数减少、CD79B突变、KMT2D突变、TNFAIP3突变、B2M突变、EZH2突变、BTG1/2突变、CREBBP突变、MYC、BCL2、BCL6基因重排之间无显著的相关性。治疗前高SUVmax值与高血清乳酸脱氢酶(lactate dehydrogenase,LDH)水平(P=0.012)及非生发中心(non-germinal center B-cell-like,non-GCB)亚型显著相关(P=0.040),但与R-CHOP治疗反应无显著的相关性(P=0.714)。DLBCL中TP53基因突变与R-CHOP治疗反应差显著相关(P=0.001),是R-CHOP治疗后非完全代谢缓解的独立预测因子。联合TP53基因突变、Ann Arbor分期、国际预后指数(International Prognostic Index,IPI)及血清LDH水平能够更好地预测患者对R-CHOP治疗的反应。结论:在DLBCL中,MYD88L265P突变型患者具有较高的治疗前SUVmax值。DLBCL治疗前SUVmax值与R-CHOP治疗反应无关,而TP53基因突变与R-CHOP治疗反应差显著相关,并且是独立预测因子。TP53基因突变联合临床病理学参数可更好地预测R-CHOP治疗反应。关于各基因变异特征及SUVmax值与患者预后的关系尚需作进一步随访研究。
[关键词] 弥漫性大B细胞淋巴瘤;基因变异特征;18F-FDG PET/CT;SUVmax;R-CHOP;治疗反应
[Abstract] Background and purpose: Next generation sequencing-identified genetic alterations of diffuse large B cell lymphoma (DLBCL) and baseline SUVmax detected by 18F-FDG PET/CT were correlated with patients’ prognosis. However, their relationship and the associations with R-CHOP response of DLBCL are still unclear. This study aimed to analyze the association bewteen genetic alterations and 18F-FDG PET/CT SUVmax and their correlations with clinicopathological characteristics and R-CHOP response of DLBCL. Methods: A total of 225 cases of primary DLBCL detected by next generation sequencing using 481 lymphoma gene panel and examined by 18F-FDG PET/CT before treatment between 2022 and 2023 were collected. This study was approved by the Ethics Committee of Fudan University Shanghai Cancer Center (Ethical No.: 050432-4-2307E) and acquired the informed consent of the patients. The translocations of BCL2, BCL6 and MYC were identified by fluorescence in situ hybridization. The clinicopathological characteristics and the PET/CT scan after R-CHOP chemotherapy were collected. Results: Finally, 191 patients were enrolled in this study. The frequency of MYD88 mutation, TP53 mutation, copy number variations of CDKN2A/2B, CD79B mutation in the 191 DLBCL patients were 24.6%, 27.2%, 32.5% and 16.8%, respectively. The range of baseline SUVmax was 5.10-63.10 (24.44±10.70, median 22.80). The baseline SUVmax of MYD88L265P DLBCL was significantly higher than that of MYD88 wild type (P=0.039). There were no significant associations of SUVmax with other gene alterations including TP53 mutation, CDKN2A/B loss, CD79B mutation, KMT2D mutation, TNFAIP3 mutation, B2M mutation, EZH2 mutation, BTG1/2 mutation, CREBBP mutation, gene translocations of MYC, BCL2 and BCL6. The higher SUVmax before treatment was correlated with higher serum lactate dehydrogenase (LDH) level (P=0.012) and non-germinal center B-cell-like (non-GCB) DLBCL (P=0.040). However, there was no significant association of SUVmax with R-CHOP response (P=0.714). TP53 mutation was significantly associated with the poor response of R-CHOP (P=0.001) and was an independent predictor of non-complete metabolic response (non-CMR). TP53 mutation combined with Ann Arbor stage, International Prognostic Index (IPI) score and serum LDH level could better predict R-CHOP response than each factor alone. Conclusion: MYD88L265P DLBCL had higher baseline 18F-FDG PET/CT SUVmax. The baseline SUVmax was not associated with R-CHOP response. However, TP53 mutation was significantly correlated with poor response of R-CHOP in DLBCL patients. TP53 mutation combined with clinicopathological characteristics could better predict R-CHOP response. The associations of gene alterations and SUVmax with prognosis of DLBCL patients needed to be explored in the future.
[Key words] Diffuse large B cell lymphoma; Genetic alterations; 18F-FDG PET/CT; SUVmax; R-CHOP; Therapeutic response
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(non-Hogkin’s lymphoma,NHL)最常见的组织学类型,也是成年人最常见的淋巴瘤类型[1]。 DLBCL具有高度侵袭性,在临床病理学特征、免疫表型、基因异常、化疗反应性及患者预后方面具有显著的异质性[1]。接近40%的患者对现有的利妥昔单抗与环磷酰胺、阿霉素、长春新碱、泼尼松(rituximab combined with cyclophosphamide, hydroxydaunorubicin, oncovin, and prednisone,R-CHOP)治疗方案不敏感,预后较差[1]。因此,早期预测R-CHOP治疗效果差的患者,对于及时更换治疗方案、应用其他的靶向治疗药物以及指导分层治疗等具有重要意义。
PET/CT是DLBCL诊断过程中不可或缺的影像学检查手段,在DLBCL的诊断、分期、疗效评估及预后预测中发挥着重要作用[2]。放射性标记葡萄糖类似物18F-FDG(氟代脱氧葡萄糖)是目前应用最广泛的示踪剂。PET/CT显示的18F-FDG摄取水平可反映肿瘤细胞的糖代谢水平,标准化摄取值(standard uptake value,SUV)是评估18F-FDG摄取水平的半定量指标。SUVmax值是病灶中的最大摄取值。已有研究[3]显示,治疗前高的SUVmax值与DLBCL患者接受R-CHOP治疗和嵌合抗原受体T细胞疗法(chimeric antigen receptor T-cell therapy, CAR-T)后的预后差相关。R-CHOP治疗结束后的PET/CT结果可以预测患者的无病生存和总体生存情况[4]。然而,DLBCL治疗前SUVmax值与R-CHOP治疗效果的关系尚不清楚。
有研究[1]表明,DLBCL在分子遗传学特征上具有高度异质性。通过基因表达谱分析,根据恶性B细胞的起源可以将DLBCL分为生发中心B细胞样亚型(germinal center B cell,GCB型)和活化的B细胞亚型(activated B cell,ABC型)。此外,DLBCL包含多种多样的基因突变类型,GCB型DLBCL主要富含染色质修饰相关基因突变,如EZH2、CREBBP等,而ABC型则富含具有活化核因子κB(nuclear factor kappa-B,NF-κB)信号转导通路和B细胞受体信号转导通路相关的基因突变,如MYD88、CD79B等。每个DLBCL平均有7~17种突变类型,多种突变类型会聚类出现[1]。近年来,多项研究[5-6]通过分析DLBCL的基因变异谱特征,包括基因突变、体细胞拷贝数变异及结构变异,将DLBCL分成不同的分子分型。DLBCL中的基因变异特征是否与治疗前SUVmax及治疗后代谢缓解相关值得深入研究。
18F-FDG摄取反映肿瘤细胞糖代谢的状态,与肿瘤的增殖能力和恶性程度密切相关。肿瘤细胞中不同的遗传学改变可能进一步导致代谢活性的不同,因此肿瘤细胞18F-FDG摄取可能与肿瘤相关基因异常相关[4]。有研究[7-8]证实,SUVmax值与肿瘤中特定的基因异常相关。然而,DLBCL中的分子遗传学特征与18F-FDG PET/CT SUVmax值的相关性,及其与R-CHOP治疗反应的相关性尚不清楚。本研究旨在分析DLBCL的分子遗传学特征与治疗前经18F-FDG PET/CT检测的基线SUVmax值之间的相关性,及其与临床病理学特征、R-CHOP治疗反应的相关性,并探讨其潜在的临床意义。
1 资料和方法
1.1 病例选择和临床资料收集
收集复旦大学附属肿瘤医院2022年1月—2023年12月经淋巴瘤481基因panel DNA二代测序(next-generation sequencing,NGS)检测的DLBCL患者。该组病例的入组标准为:① 经2位病理科医师根据2022年第5版世界卫生组织(World Health Organization,WHO)造血与淋巴组织肿瘤分类标准诊断为DLBCL,主要为非特指型(DLBCL not specified,DLBCL NOS),少部分为双打击高级别B细胞淋巴瘤;② 治疗前经淋巴瘤481基因panel DNA NGS检测;③ 治疗前接受影像学18F-FDG PET/CT检查;④ 未接受化疗、放疗或靶向治疗的初治患者。排除标准为:① 未收集到临床病理学资料的患者;② 病理学诊断不是DLBCL;③ PET/CT检查前接受过化疗的患者。收集该组病例的临床病理学参数,包括患者年龄、性别、血清乳酸脱氢酶(lactate dehydrogenase,LDH)水平、原发部位、Ann Arbor分期、国际预后指数(International Prognostic Index,IPI)结外器官累犯情况以及免疫组织化学检查结果。收集该组病例治疗前经PET/CT检测的18F-FDG摄取SUVmax值以及经R-CHOP治疗后PET/CT的检查结果。样本的采集经由复旦大学附属肿瘤医院医学伦理委员会批准(伦理批号:050432-4-2307E)并获得患者知情同意。
1.2 NGS和生物信息学分析
福尔马林固定石蜡包埋(formalin-fixed paraffin-embedded,FFPE)组织用于基因组DNA提取。组织脱蜡后,采用QIAamp DNA FFPE 组织试剂盒[凯杰企业管理(上海)有限公司]提取DNA。测序文库制备使用 KAPA Hyper Prep 文库构建试剂盒(美国KAPA Biosystems公司),靶向富集使用针对481个淋巴血液系统肿瘤相关基因定制的xGen锁定探针(美国Integrated DNA Technologies公司)来富集DNA文库并进行杂交,在Illumina NextSeq 550平台(美国Illumina公司)上进行双末端读取测序,平均测序深度大于1 000倍。使用Trimmomatic处理FASTQ文件以进行质量控制,使用Burrows-Wheeler Aligner将测序数据对应到人类基因组hg19版本。所有突变均使用IGV(Integrative Genomics Viewer v2.3,RRID:SCR_011793)确认。对于MYC、BCL2和BCL6基因重排,荧光原位杂交(fluorescence in situ hybridization,FISH)检测或 NGS有任意一种方法检测结果为阳性,则判定为重排阳性。
1.3 FISH检测
在FFPE切片上进行FISH检测。探针分别使用Vysis LSI MYC, BCL2或BCL6双色分离探针(美国Abbott Molecular公司)。采用Bioview 软件进行图像捕获。由2位病理科医师对每个病例选取至少50个分裂间期细胞核进行独立评分。大于15%的肿瘤细胞内可见红绿信号分离定义为重排阳性。
1.4 PET/CT检查
所有患者均在复旦大学附属肿瘤医院核医学科进行PET/CT检查。患者禁食6 h 以上,空腹血糖控制在10 mmol/L以内,静脉注射18F-FDG(3.7 MBq/kg),休息1 h后使用Biograph mCT Flow PET/CT机(德国Siemens公司)进行全身扫描(从头颅顶部至股中上段)。采用低剂量CT扫描用于衰减和散射校正,并在低剂量CT扫描的同时进行覆盖相同空间范围的PET扫描;使用高斯滤波器迭代重建图像并进行分析。PET/CT显像结果由2位经验丰富的核医学科医师进行独立评估,每位医师都具有5年以上的工作经验。使用Syngo PET/CT工作站(德国Siemens公司)处理和分析图像;应用三维感兴趣区体积(volume of interest,VOI)技术测定病灶的SUVmax值。收集治疗前基线的SUVmax值,以及6~8个周期R-CHOP治疗后的PET/CT检查结果,根据Deauville五分量表和Lugano 2014淋巴瘤治疗效果评价标准评估R-CHOP治疗反应:PET/CT检查结果评分1、2、3分伴或不伴有残存肿块影为完全代谢缓解(complete metabolic response,CMR);评分4或5分,与基线相比摄取降低,影像残存病灶可为任意大小为部分代谢缓解(partial metabolic response, PMR);评分为4或5分,与基线相比摄取值无明显变化为疾病稳定(stable disease,SD);评分4或5分,摄取较基线升高和(或)在中期或治疗结束评价时出现新的FDG摄取增高病灶为疾病进展(progressive disease,PD)。
1.5 统计学处理
SUVmax值作为连续性变量进行分析,为计量资料;DLBCL基因变异特征及临床病理学参数作为分类变量进行分析,为定性资料。对于组间比较,如独立样本数据符合正态分布且方差齐,则采用t检验;如方差不齐,则采用校正t检验;非正态分布则采用Mann–Whitney U检验比较两组分类变量间的差异。使用卡方检验分析分类变量间相关性。DLBCL基因变异特征及SUVmax值与治疗反应的关系采用二元logistic回归模型。使用受试者工作特征曲线(receiver operating characteristic curve,ROC)法分析基因变异特征及临床病理学参数预测R-CHOP治疗反应的能力。上述统计学分析使用SPSS 29.0软件及GraphPad Prism 10.0软件。P<0.05为差异有统计学意义。
2 结 果
2.1 基本临床病理学资料
总计191例DLBCL按照纳入和排除标准筛选后入组本研究的分析(图1)。患者的平均年龄为56岁(范围16~85岁),男性占55.0%(105/191),女性占45.0%(86/191)。有的病例没有收集到原发部位、Ann Arbor分期或血清LDH水平等临床病理学参数,因此,不同的临床病理学参数对应的病例数不同(图1)。原发部位位于淋巴结内的病例有56例(31.1%,56/180),位于淋巴结外的有124例(68.9%,124/180),Ann Arbor分期为Ⅰ、Ⅱ期的有70例(39.1%,70/179),Ⅲ、Ⅳ期的有63例(60.9%,109/179),IPI指数为0~2分(低危)的有106例(59.6%,106/178),3~5分(高危)的有72例(40.4%,72/178),血清LDH水平正常(<250 U/L)的有106例(59.6%, 106/178),高于正常(≥250 U/L)的有72例(40.4%,72/178)。根据Hans法则将DLBCL分为生发中心(germinal center B-cell-like,GCB)型和非生发中心(non-germinal center B-cell-like,non-GCB)型,其中GCB型占47.7%(84/176),non-GCB型占52.3%(92/176)。超过2个(≥2个)结外器官受累的病例有115例(64.6%,115/178),<2个结外器官受累的有63例(35.4%,63/178,表1)。
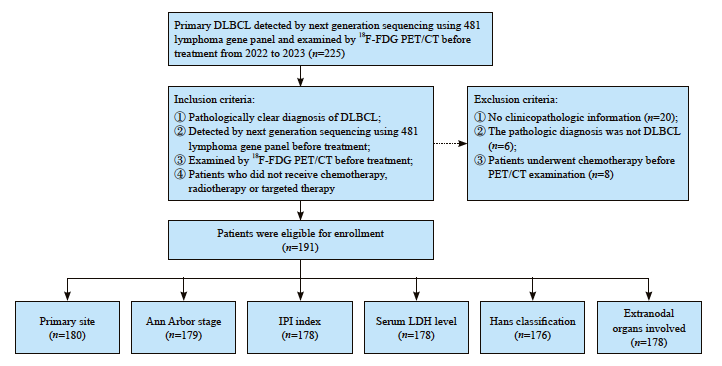
图1 患者纳入和排除标准的流程图
Fig. 1 Flow diagram of participant selection
2.2 DLBCL NGS检测和18F-FDG PET/CT SUVmax结果及两者的相关性
在本组191例经NGS检测的DLBCL中,发生频率较高的基因变异特征依次是CDKN2A/B拷贝数减少(62/191,32.5%)、BCL6基因重排(61/191,31.9%)、TP53突变(52/191,27.2%)、MYD88L265P突变(47/191,24.6%)、KMT2D突变(42/191,22.0%)、CD79B突变(32/191,16.8%)、MYC基因重排(25/191,13.1%)、BTG1/2突变(23/191,12.0%)、TNFAIP3突变(23/191,12.0%)和B2M突变(15/191,7.9%)(图2)。伴有BCL2和MYC基因重排的双打击高级别B细胞淋巴瘤的发生率为3.1%(6/191)(表2)。SUVmax值范围是5.10~63.10(24.44±10.70,中位22.80)。进一步分析各基因变异与SUVmax的关系,Mann-Whitney U检验分析显示MYD88L265P突变型DLBCL的SUVmax值显著高于MYD88野生型DLBCL(P<0.05,图3),其余高频基因变异包括TP53突变、CDKN2A/B拷贝数减少、CD79B突变、KMT2D突变、TNFAIP3突变、B2M突变、EZH2突变、BTG1/2突变、CREBBP突变、MYC、BCL2、BCL6基因重排均与SUVmax无显著的相关性(P均>0.05,表2)。
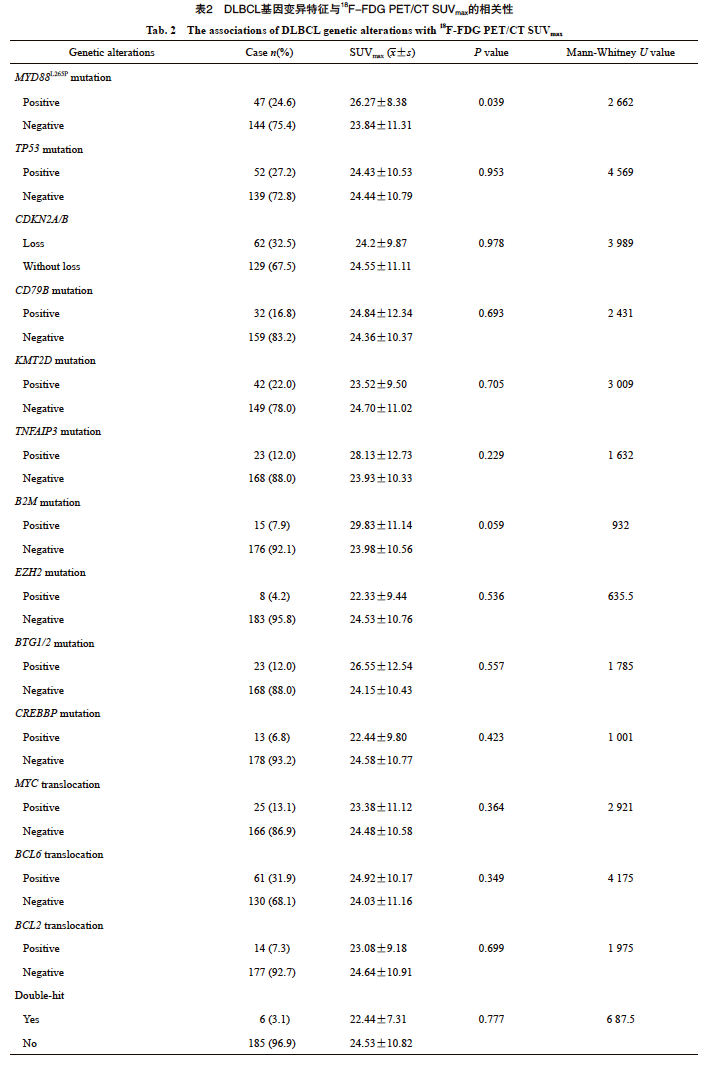
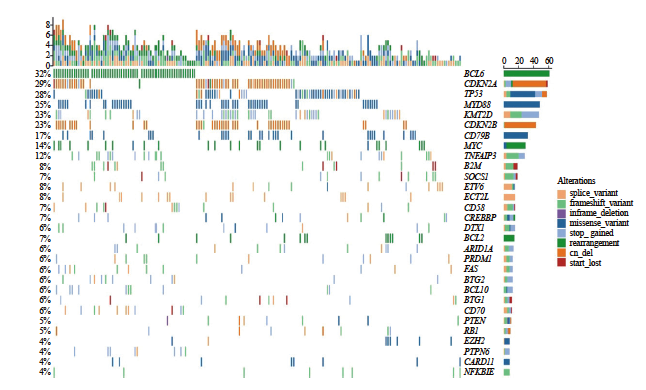
图2 191例DLBCL患者的基因变异分布图
Fig. 2 The genetic alterations of 191 DLBCL patients
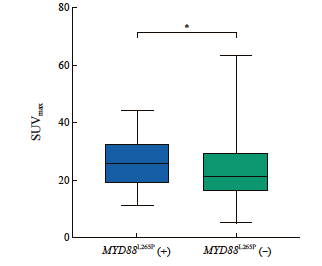
图3 DLBCL MYD88突变与18F-FDG PET/CT SUVmax的相关性
Fig. 3 The association of MYD88L265Pmutation with 18F-FDG PET/CT SUVmax in DLBCL
The baseline SUVmax of MYD88L265P DLBCL was significantly higher than that of MYD88 wild type DLBCL (*: P=0.039).
研究[9]显示,TP53突变型蛋白会促进葡萄糖转运蛋白1/4(GLUT1/4)的表达,增加葡萄糖的摄取,促进肿瘤细胞的有氧糖酵解。TP53突变在多种肿瘤包括胰腺癌、肺癌等的代谢重编程中发挥重要作用,促进肿瘤恶性进展[10-11]。因此,本研究进一步纳入其他肿瘤类型,分析TP53突变与18F-FDG PET/CT SUVmax值的关系,以了解本研究中两者分析方法和结果的可靠性。我们选取了复旦大学附属肿瘤医院2023—2025年治疗前经NGS和PET/CT检测的上皮源性恶性肿瘤94例,包括肺癌(52例)、胰腺癌(25例)、肠癌(9例)、胃癌(1例)、胆管细胞癌(3例)、卵巢癌(2例)及子宫内膜癌(2例),其中TP53突变的肿瘤有48例(48/94,51.1%)。Mann-Whitney U检验分析显示,TP53突变型肿瘤的SUVmax值(13.86±6.46)显著高于TP53突变阴性的肿瘤(8.14±5.09,P<0.001,图4)。
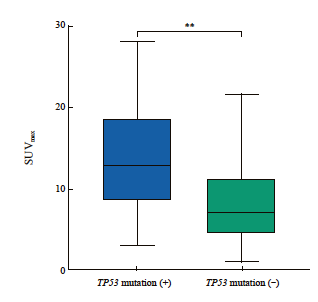
图4 TP53突变与上皮性恶性肿瘤18F-FDG PET/CT SUVmax的相关性
Fig. 4 The association of TP53 mutation with 18F-FDG PET/CT SUVmax of epithelial tumors
The baseline SUVmax of epithelial tumors with TP53 mutation was significantly higher than that of TP53 wild type tumors (**: P<0.001).
2.3 DLBCL 18F-FDG PET/CT SUVmax与临床病理学特征的相关性
本研究将18F-FDG PET/CT SUVmax值作为连续性变量,Mann-Whitney U检验分析得出DLBCL高的SUV max值与高血清LDH水平(≥250 U/ L,P<0.05)及non-GCB亚型(P< 0.05)显著相关,而与患者年龄(P<0.05)、性别(P<0.05)、原发部位 (P<0.05)、Ann Arbor分期(P<0.05)、IPI指数(P<0.05)、结外器官受累(P<0.05)无显著的相关性(P均>0.05,表1)。
2.4 DLBCL基因变异特征及18F-FDG PET/CT SUVmax值与R-CHOP治疗反应的相关性
本组病例中接受一线R-CHOP 化疗并于治疗结束后经PET/CT检测的DLBCL有154例,根据Deauville五分量表及Lugano 2014淋巴瘤治疗效果评价标准评价患者的治疗反应,其中119例为完全代谢缓解(complete metabolic response,CMR),25例为部分代谢缓解(partial metabolic response,PMR),9例为疾病进展(progression disease,PD),1例为疾病稳定(stable disease,SD)。卡方检验分析得出TP53突变的DLBCL患者R-CHOP治疗后达到CMR的比例显著低于TP53野生型DLBCL(60% vs 84%,P=0.001,图5),双打击高级别B细胞淋巴瘤达到CMR的比例低于非双打击高级别B细胞淋巴瘤(40% vs 79%),然而由于双打击高级别B细胞淋巴瘤病例数较少(n=5),差异并无统计学上的显著性意义(P>0.05)。其他基因变异类型与患者治疗反应无显著的相关性(图5)。单因素二元logistic回归分析显示TP53基因突变,高Ann Arbor分期(Ⅲ、 Ⅳ期),高IPI指数(3~5分)及高血清LDH水平(≥250 U/L)的DLBCL患者R-CHOP治疗后非完全代谢缓解(PMR+PD+SD,non-CMR)的风险显著增加(表3)。多因素二元logistic回归分析显示TP53基因突变,高Ann Arbor分期(Ⅲ、Ⅳ 期)是患者化疗后非完全代谢缓解(non-CMR)的独立预测因子。接着,我们使用ROC曲线分析TP53基因突变,Ann Arbor分期预测R-CHOP治疗反应的能力,结果显示与单独变量相比,联合TP53基因突变,Ann Arbor分期,IPI指数及血清LDH水平能够更好地预测DLBCL患者R-CHOP差的治疗反应即non-CMR[曲线下面积(area under curve,AUC)=0.782,P<0.001,图6]。
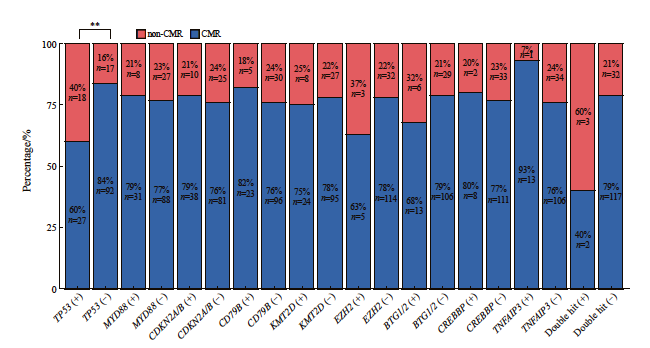
图5 DLBCL基因变异特征与R-CHOP治疗反应的关系
Fig. 5 The associations of DLBCL genetic alterations with R-CHOP response
A significantly higher percentage of TP53 mutation DLBCLs did not reach CMR compared with TP53 wild type DLBCLs (**:P=0.001). There were no significant associations between other gene alterations of DLBCLs and R-CHOP response.
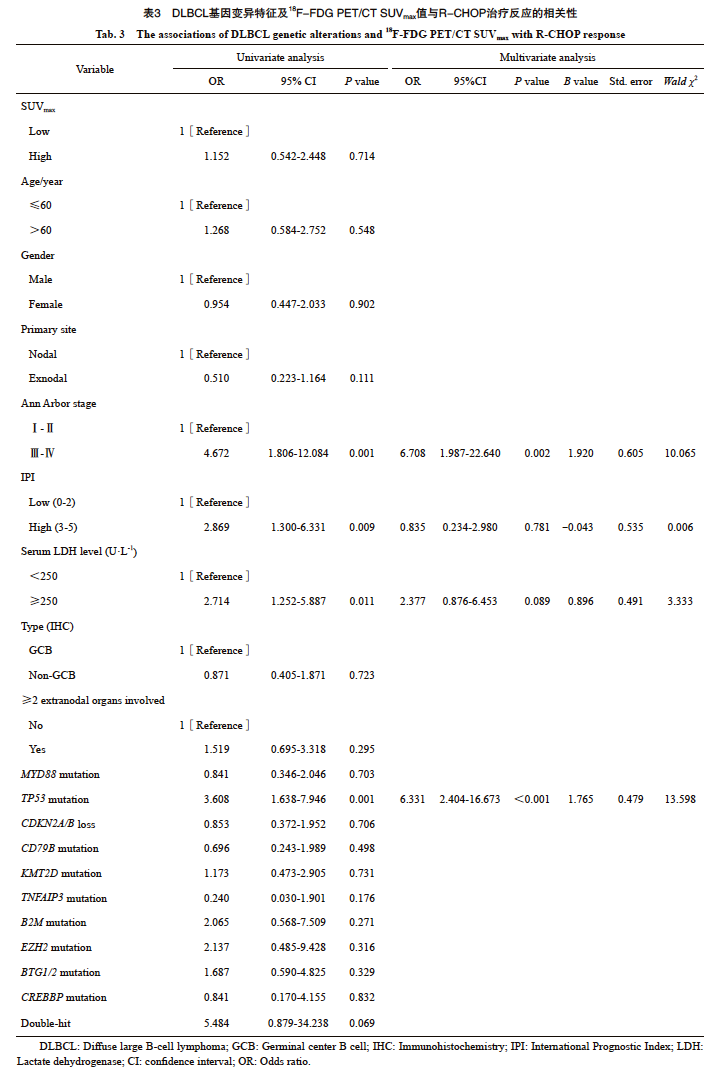
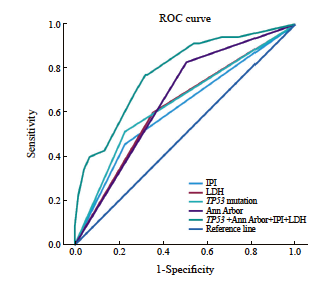
图6 ROC曲线分析TP53突变联合临床病理学参数预测R-CHOP治疗反应的能力
Fig. 6 ROC curve analysis of the predictive ability of TP53 mutation combined with clinicopathological characteristics to R-CHOP response
ROC curve showed that the area under the ROC curve (AUC) of TP53 mutation combined with Ann Arbor stage, IPI score and serum LDH level to predict R-CHOP response was higher than those of each factor alone (AUC=0.782,P<0.001).
3 讨 论
DLBCL经NGS检测的分子遗传学特征和患者治疗前18F-FDG PET/CT检查的SUVmax值在预测患者预后及治疗反应中具有潜在的临床价值,而寻找早期预测R-CHOP治疗反应的分子标志物对于指导患者分层治疗具有重要意义。本研究中我们分析了DLBCL的分子遗传学特征与18F-FDG PET/CT SUVmax值的关系及其与临床病理学特征、R-CHOP治疗反应的相关性。对191例DLBCL的回顾性研究表明,DLBCL MYD88L265P突变与高SUVmax值显著相关;DLBCL治疗前高SUVmax值与高血清LDH水平(≥250 U/L)及non-GCB亚型显著相关;本研究通过R-CHOP治疗后的PET/CT检测评估治疗反应,结果显示,DLBCL中TP53基因突变与R-CHOP治疗反应差显著相关,且是预测治疗反应的独立预测因子。
MYD88基因编码一种胞质接头蛋白,介导IL-1受体激酶激活和下游NF-κB信号转导通路活化。MYD88L265P突变促进MYD88蛋白多聚化,使得NF-κB信号转导通路持续活化,进而促进肿瘤增殖[12]。多项研究[13-14]结果显示,MYD88L265P突变与DLBCL患者预后差相关。Mohamed等[13]报道,MYD88突变与DLBCL高IPI指数相关。 Ebid等[14]的研究结果显示,MYD88突变与患者预后差相关,可以预测患者的总体死亡率。本研究显示MYD88L265P突变与高SUVmax值显著相关,该突变可提示肿瘤细胞具有高糖代谢状态和高增殖活性。未来,我们期待更多深入的机制研究探讨MYD88基因突变与DLBCL糖代谢调控之间的内在联系,为DLBCL的精准治疗提供更多的 线索。
MYD88L265P突变可使B 细胞受体(B lymphocyte receptor,BCR)信号转导通路持续活化,而Bruton酪氨酸激酶(Bruton tyrosine kinase,BTK)将BCR信号转导通路与NF-κB信号转导通路连接,其对于DLBCL细胞的持续生存至关重要。因此靶向BTK的抑制剂依布替尼(ibrutinib)可以阻断NF-κB信号转导通路,抑制携带MYD88L265P突变的DLBCL细胞的生存。多项临床试验显示依布替尼在以MYD88L265P突变和(或)CD79B突变为特征的ABC型DLBCL或MCD/C5亚型的DLBCL中显示出较好的疗效。“Phoenix”Ⅱ期临床试验及GUIDANCE-01临床试验均显示在MCD型DLBCL中,R-CHOP联合依布替尼组患者的完全缓解率及无病生存期优于R-CHOP组[15-16]。Mandato等[12]的研究结果显示,MYD88L265P突变型蛋白通过招募DOCK8激活SYK,进一步增强近端BCR信号转导通路,促进DLBCL的增殖。抑制DOCK8可以增加MYD88L265P突变型DLBCL对于BTK抑制剂的敏感性。因此明确MYD88L265P突变及其作用机制对于DLBCL患者新型治疗方案的制订至关重要。本研究结果显示,18F-FDG PET/CT SUVmax值与其他DLBCL常见的突变类型及BCL2、BCL6、MYC基因易位之间无显著的相关性,提示这些基因异常可能对DLBCL的糖代谢调控无显著影响。
有研究[9]报道TP53突变型蛋白会促进葡萄糖转运蛋白1/4(GLUT1/4)的表达,增加葡萄糖的摄取,促进肿瘤细胞的有氧糖酵解。Liao等[11]研究显示TP53野生型蛋白促进FRMD4A基因的转录,促进circFRMD4A的形成,而circFRMD4A抑制PKM2的作用,进而抑制肿瘤的有氧糖酵解。Ryu等[17]报道,TP53突变型进展期卵巢癌的治疗前SUVmax值显著高于TP53野生型卵巢癌。Jahromi等[18]的一项研究纳入乳腺癌、胃癌、肠癌及肺癌患者,分析得出TP53突变的肿瘤SUVmax平均值显著高于TP53突变阴性者。以上研究提示,TP53突变在肿瘤的代谢重编程中发挥重要作用,促进肿瘤的恶性进展。为进一步明确本研究中基因突变与糖代谢关系分析的可靠性,本研究纳入常见上皮性恶性肿瘤类型,分析TP53突变与18F-FDG PET/CT SUVmax值的关系,显示TP53突变型肿瘤的SUVmax值显著高于TP53突变阴性的肿瘤。该结果与上述文献报道一致,印证本研究DLBCL基因变异与治疗前18F-FDG PET/CT SUVmax分析结果的可靠性。与常见的上皮性恶性肿瘤不同,在DLBCL中,除MYD88突变外,TP53基因突变及其他基因变异与治疗前SUVmax均无显著相关性。
18F-FDG PET/CT SUVmax值反映肿瘤细胞的糖代谢水平,高SUVmax值与肿瘤高增殖能力和侵袭性相关。有研究[19]显示,高SUVmax值与DLBCL高的Ann Arbor分期及LDH水平相关。本研究结果证实,SUVmax值与高LDH水平显著相关。此外,本研究结果还显示,non-GCB型DLBCL的SUVmax值显著高于GCB型,提示non-GCB型DLBCL具有更高的糖代谢活性和肿瘤增殖活性。
本研究通过R-CHOP一线治疗后DLBCL的 PET/CT检测结果评估R-CHOP治疗反应,发现TP53基因突变的DLBCL患者中存在较高比例没有达到完全代谢缓解,提示对R-CHOP治疗反应差。双打击高级别B细胞淋巴瘤也存在较高比例的患者没有达到完全代谢缓解,但由于病例数较少,差异并无统计学意义。而MYD88等其他基因突变型DLBCL显示较好的R-CHOP治疗反应。DLBCL治疗前SUVmax值与患者R-CHOP治疗反应无显著的相关性。Mendeville等[20]的研究显示C2/A53型DLBCL患者对R-CHOP治疗反应差,存在较高比例的患者未达到完全代谢缓解,提示C2/A53型的难治性,而C5/MCD等其他亚型显示较好的R-CHOP治疗反应,我们的研究结果与上述研究结果一致。该项研究同时发现在达到完全代谢缓解的DLBCL中,C5/MCD型患者的无病生存期和总体生存期较短,提示这一亚型存在较高的疾病复发率和进展率。Ebid等[14]的研究结果也显示,TP53突变及MYD88突变与DLBCL患者R-CHOP治疗后短的无进展生存期及总体生存期显著相关,本研究结果提示,DLBCL分子遗传学特征与治疗前SUVmax相关,并在患者的分层治疗及疗效预测中具有重要的临床意义。
本研究也存在着一定的局限性。首先,本文未进行DLBCL基因变异特征及SUVmax值与预后的相关性分析,无法证实基因变异特征及SUVmax值对DLBCL患者长期预后的影响,未来有待完善随访信息后进一步研究。其次,本研究纳入的样本量较小,样本选择可能存在偏倚,未来有待扩大样本量,进一步明确DLBCL基因变异特征及SUVmax值的预测价值。
综上所述,本研究回顾性分析了191例DLBCL中NGS测序获得的分子遗传学特征与18F-FDG PET/CT检测的基线SUVmax值之间的相关性及其与临床病理学特征、R-CHOP治疗反应的相关性。我们发现MYD88L265P突变与高SUVmax值显著相关;治疗前SUVmax值与R-CHOP治疗反应无显著的相关性,而TP53基因突变与R-CHOP治疗反应差显著相关,是R-CHOP治疗后非完全代谢缓解的独立预测因子。联合TP53突变、Ann Arbor分期、IPI指数及血清LDH水平能够更好地预测DLBCL患者对R-CHOP方案治疗的反应。
第一作者:
田田,博士,住院医师。
通信作者:
周晓燕,主任医师,教授。
作者贡献声明:
田田:设计选题,收集并分析数据,撰写文章;陈晨:收集病例,数据分析;魏然,包龙龙:进行实验,生信分析;顾丙新,张群岭,曹军宁:提供临床治疗信息;于宝华,李小秋:提供临床病理学信息;周晓燕:总体设计研究思路,确定研究方案,参与文章的修订及终版文章的审核。
[参考文献]
[1] CUTMORE N H, KRUPKA J A, HODSON D J. Genetic profiling in diffuse large B-cell lymphoma: the promise and the challenge[J]. Mod Pathol, 2023, 36(1): 100007.
[2] CHEN Y, CHEN Z J, TAN X Y, et al. Role of body composition and metabolic parameters extracted from baseline 18F-FDG PET/CT in patients with diffuse large B-cell lymphoma[J]. Ann Hematol, 2023, 102(10): 2779-2789.
[3] GUI J B, LI M T, XU J, et al. 18F-FDG PET/CT for prognosis and toxicity prediction of diffuse large B-cell lymphoma patients with chimeric antigen receptor T-cell therapy[J]. Eur J Nucl Med Mol Imaging, 2024, 51(8): 2308-2319.
[4] IKEDA D, OURA M, UEHARA A, et al. Prognostic relevance of tumor-infiltrating CD4+ cells and total metabolic tumor volumebased risk stratification in diffuse large B-cell lymphoma[J]. Haematologica, 2024, 109(9): 2822-2832.
[5] WRIGHT G W, HUANG D W, PHELAN J D, et al. A probabilistic classification tool for genetic subtypes of diffuse large B cell lymphoma with therapeutic implications[J]. Cancer Cell, 2020, 37(4): 551-568.e14.
[6] LACY S E, BARRANS S L, BEER P A, et al. Targeted sequencing in DLBCL, molecular subtypes, and outcomes: a Haematological Malignancy Research Network report[J]. Blood, 2020, 135(20): 1759-1771.
[7] KIM G, KIM J, CHA H, et al. Metabolic radiogenomics in lung cancer: associations between FDG PET image features and oncogenic signaling pathway alterations[J]. Sci Rep, 2020, 10(1): 13231.
[8] LEE D Y, OH J S, KIM J W, et al. Pre-operative dual-timepoint[18F] FET/PET differentiates CDKN2A/B loss and PIK3CA mutation status in adult-type diffuse glioma: a singlecenter prospective study[J]. Eur J Nucl Med Mol Imaging, 2025, 52(2): 669-682.
[9] SCHWARTZENBERG-BAR-YOSEPH F, ARMONI M, KARNIELI E. The tumor suppressor p53 down-regulates glucose transporters GLUT1 and GLUT4 gene expression[J]. Cancer Res, 2004, 64(7): 2627-2633.
[10] HINDES M T, MCELLIGOTT A M, BEST O G, et al. Metabolic reprogramming, malignant transformation and metastasis: lessons from chronic lymphocytic leukaemia and prostate cancer[J]. Cancer Lett, 2025, 611: 217441.
[11] LIAO Q, DENG J, TONG J, et al. p53 induces circFRMD4A to suppress cancer development through glycolytic reprogramming and cuproptosis[J]. Mol Cell, 2025, 85(1): 132-149.e7.
[12] MANDATO E, YAN Q S, OUYANG J, et al. MYD88L265Paugments proximal B-cell receptor signaling in large B-cell lymphomas via an interaction with DOCK8[J]. Blood, 2023, 142(14): 1219-1232.
[13] MOHAMED A H, ELFEKY M A, ELSHORBAGY S, et al. Prognostic values of myeloid differentiation factor 88 (MYD88) and transducin (β)-like receptor 1 (TBLR1) expression in tissues of diffuse large B-cell non-Hodgkin lymphoma patients- an immunohistochemical study[J]. Contemp Oncol (Pozn), 2022, 26(1): 49-58.
[14] EBID O A E H, EZZ EL ARAB L R, SAAD A S, et al. Prognostic impact of MYD88 and TP53 mutations in diffuse large B cell lymphoma[J]. Ann Hematol, 2023, 102(12): 3477-3488.
[15] YOUNES A, SEHN L H, JOHNSON P, et al. Randomized phase Ⅲ trial of ibrutinib and rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone in non-germinal center B-cell diffuse large B-cell lymphoma[J]. J Clin Oncol, 2019, 37(15): 1285-1295.
[16] ZHANG M C, TIAN S, FU D, et al. Genetic subtype-guided immunochemotherapy in diffuse large B cell lymphoma: the randomized GUIDANCE-01 trial[J]. Cancer Cell, 2023, 41(10): 1705-1716.e5.
[17] RYU J M, JEONG Y Y, LEE S J, et al. Association between preoperative 18-FDG PET-CT SUVmax and next-generation sequencing results in postoperative ovarian malignant tissue in patients with advanced ovarian cancer[J]. J Clin Med, 2023, 12(6): 2287.
[18] HAGHIGHAT JAHROMI A, CHANG G, KURZROCK R, et al. Standardized uptake value (SUVmax) in 18F-FDG PET/CT is correlated with the total number of main oncogenic anomalies in cancer patients[J]. Cancer Biol Ther, 2020, 21(11): 1067-1071.
[19] MICHAUD L, BANTILAN K, MAUGUEN A, et al. Prognostic value of 18F-FDG PET/CT in diffuse large B-cell lymphoma treated with a risk-adapted immunochemotherapy regimen[J]. J Nucl Med, 2023, 64(4): 536-541.
[20] MENDEVILLE M S, JANSSEN J, TJITSKE LOS-DE VRIES G, et al. Integrating genetic subtypes with PET scan monitoring to predict outcome in diffuse large B-cell lymphoma[J]. Nat Commun, 2025, 16(1): 109.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















前往app查看评论内容
3 0 举报