天津大学刘哲教授团队《ACS AMI》:近红外介导的热电催化用于持续生成ROS/RNS及可注射水凝胶的癌症治疗
2025-02-12 BioMed科技 BioMed科技 发表于陕西省
生物电可调节肿瘤相关生理过程,外源性电刺激有望成肿瘤治疗新策略。天津大学刘哲团队构建 BAG 复合物,能热电动力产 ROS/RNS,体外及小鼠实验显示其抑癌效果好,生物相容性与安全性佳。
生物电是生物体的基本属性之一,在胚胎发育和肿瘤进展过程中能够调节组织修复与新生血管生成。因此,基于干扰电微环境和独特的生物学效应,包括钙波动、肌动蛋白重组和活性氧(ROS)生成,外源性电刺激调节生物电平衡可能成为肿瘤治疗的新策略。热电催化分解水分子产生ROS被用于肿瘤治疗领域,并因其高特异性和精确时空选择性的内在优势而备受关注。ROS作为一种重要的细胞内稳态调节因子,在肿瘤发生、发展中起着重要作用,肿瘤微环境中大量产生ROS可攻击肿瘤细胞,使其成为癌症治疗的有用工具。另一方面,一氧化氮(NO)作为一种重要的内源性信使,负责下调耐药蛋白的表达以逆转多药耐药(如p-糖蛋白),并在癌症治疗中发挥凋亡和细胞毒性诱导剂的作用。光动力与光电动力治疗(PDT和PEDT)可与NO气体治疗相结合,热电动力产生的超氧离子(•O2-)可以与NO反应生成过氧亚硝酸盐阴离子(ONOO-),与ROS相比,活性氮ONOO-的产生通过硝化生物分子清除肿瘤细胞的能力更强。
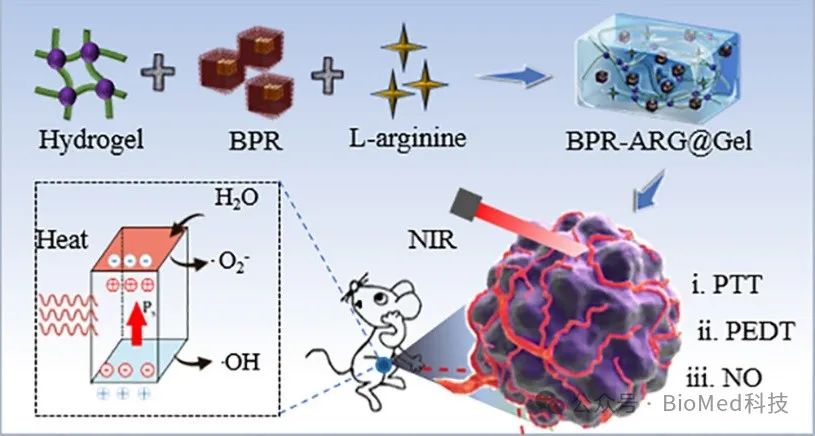
天津大学刘哲教授团队构建了负载精氨酸(ARG),热释电BPR纳米粒子的可注射水凝胶纳米粒子复合物BPR-ARG@Gel(BAG),用于热电动力促进一氧化氮产生级联反应清除肿瘤。研究发现,在808 nm激光照射下,该材料能将光能转化为热能,产生显著的热电效应产生超氧自由基(•O2-)和羟基自由基(•OH)。体外细胞与活体小鼠治疗研究证明,在激光照射下显著抑制乳腺癌MCF-7细胞增殖并诱导细胞凋亡,该协同治疗显示出较高的肿瘤抑制率(高达89.9%),呈现良好的生物相容性和可靠的生物安全性。相关工作以“NIR-mediated Pyroelectric Catalysis for Sustained ROS/RNS Generation and Advanced Cancer Therapy In Vivo via Injectable Hydrogel”为题发表在期刊ACS Applied Materials & Interfaces。

【文章要点】
本课题组通过钛酸钡改性,制备了热释电水凝胶纳米粒子复合物(BAG),由于激光引发温度变化,进一步促进带正电的空穴和带负电的电子分离,原位产生微电场。在非中心对称的钛酸钡晶体中,自发极化导致表面累积大量电荷催化水分子产生ROS。图1A-B表明纳米粒子(BPR)与精氨酸(ARG)被负载在水凝胶,构建BAG水凝胶纳米粒子复合体物的实物图,以及成胶前后的紫外吸收变化。水凝胶的稳定性和流变实验验证了BAG复合物在含血清的培养基下具有良好的稳定性和可注射性(图1C-F)。此外,在808激光照射下,BAG复合物表现出明显的温度升高的能力(超过46 ℃),在三次重复循环光照射的温度升高实验中,BAG复合物表现出良好的光稳定性(图1G-I)。在激光照射引发的温度变化中,温差导致电子-空穴分离,产生氧化还原反应,诱导产生羟基自由基 (•OH)和超氧阴离子(•O2−)活性氧(ROS)(图 1J-K)。
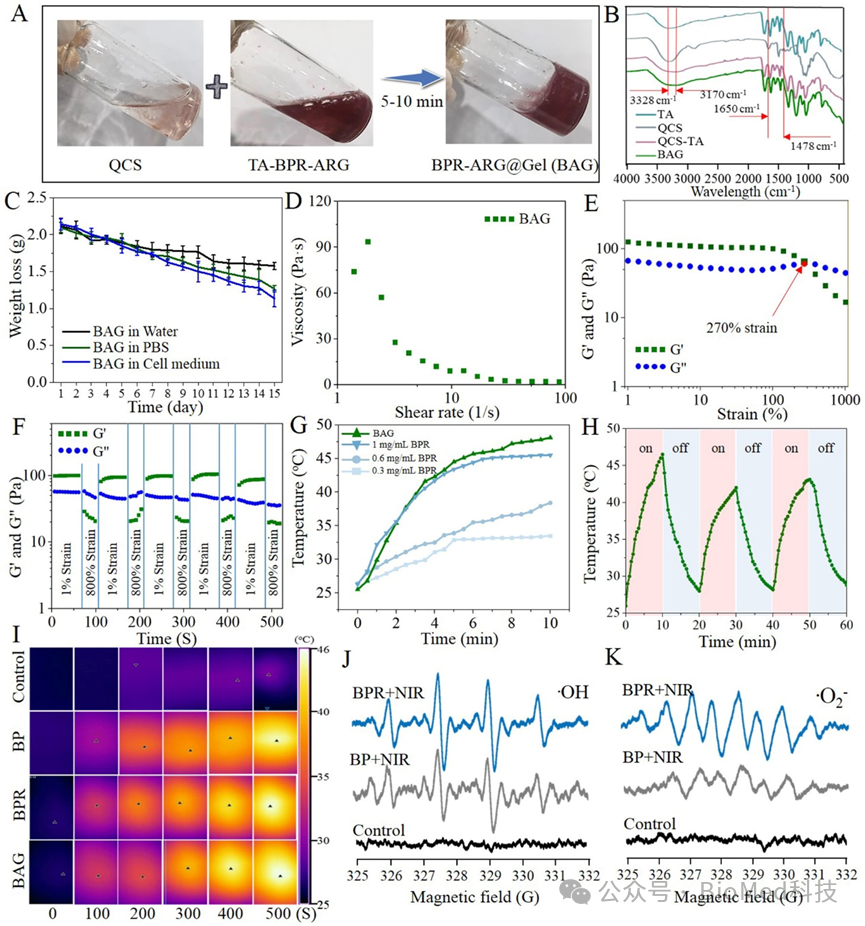
图1.水凝胶纳米离子复合物(BAG)的构建及其热释电效应活性氧产生评价。
将BAG与MCF-7细胞共孵育,激光照射后,观察BAG对MCF-7细胞的杀伤作用和抗肿瘤效果。BAG在肿瘤细胞周围的持续释放BPR纳米粒子,促进肿瘤细胞的积累和内吞,光热和热电动力效应有助于肿瘤细胞的消除(图2A)。为此,将MCF-7细胞与BPR、Gel、NIR、BAG和BAG+NIR共孵育,通过CCK-8法检测不同BPR浓度下MCF-7细胞生存率。BPR浓度达到1.2 mg/mL时,未发现明显的细胞毒性(图2B)。然而,激光照射后BAG+NIR组只有20%的MCF-7细胞存活,提示显著的NIR诱导抑制肿瘤细胞的活性(图2C)。相比之下,BPR组、NIR组和BAG组几乎没有明显的细胞毒性。通过倒置荧光显微镜观察calcein-AM/PI对MCF-7细胞的染色评估肿瘤细胞的生存状态。在BAG+NIR组中,可以清楚地观察到红色的死亡细胞,表明NIR介导的肿瘤细胞死亡(图2D)。激光照射后,BAG+NIR组的ROS产生量最高,有显著的绿色荧光信号,代表细胞中有相当多的ROS存在(图2E)。如图2F所示,在没有激光照射时,活细胞保持高水平。激光照射后BAG+NIR的凋亡水平高达58.5%,定量分析显示,BAG+NIR组的肿瘤细胞凋亡比其他组强5倍(图2G)。
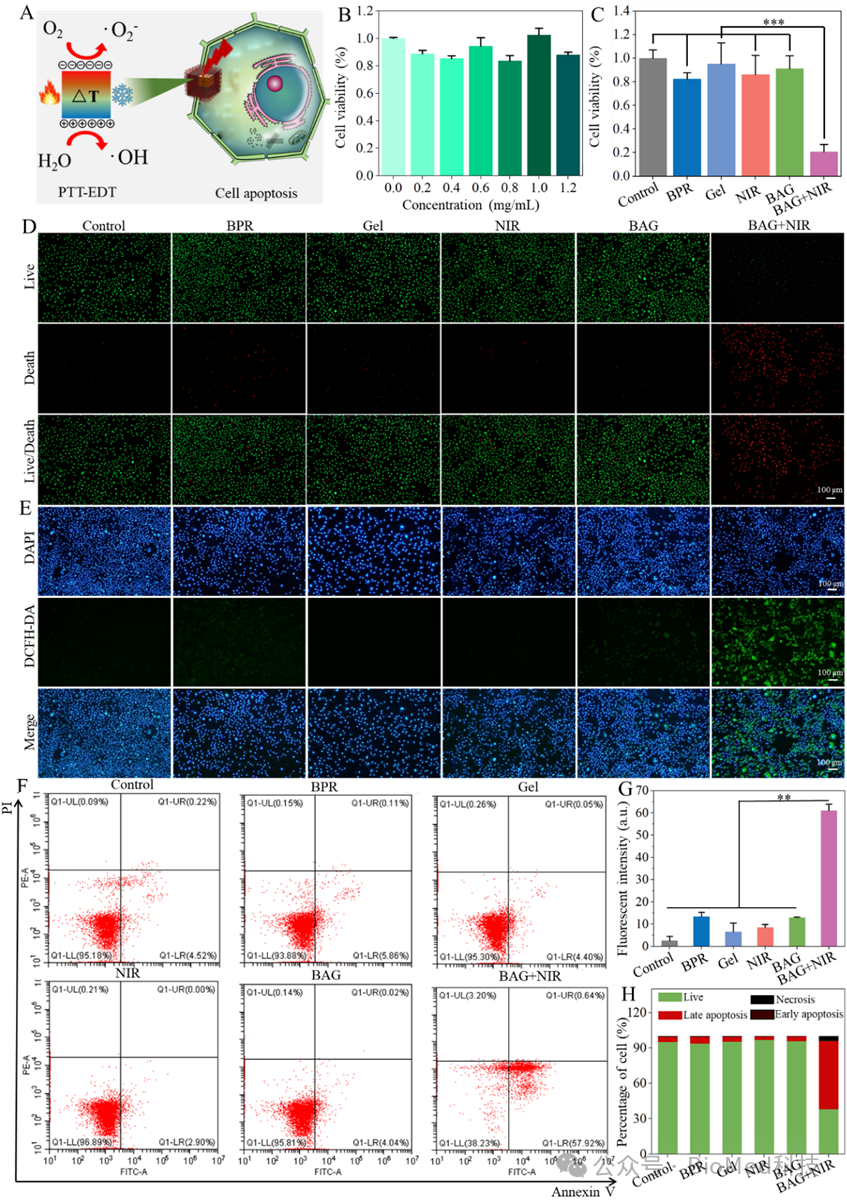
图2.水凝胶复合物BAG在激光照射后的MCF-7肿瘤细胞的毒性评价。
根据热释电机制,BAG水凝胶被认为是一个良好的药物池和热场,在激光照射时持续产生ROS/RNS,抑制热休克蛋白(HSP 70)的过表达(图3A)。治疗前,对含有不同浓度BPR(0.5、1.0、1.5、2.0 mg/mL)的BAG样本进行成像,以筛选荧光灵敏度最强的最佳注射剂量。随后将BAG注射到MCF-7荷瘤裸鼠瘤体内,荧光成像监测BAG的原位缓释和降解情况。实验表明,荧光强度在注射后24 h达到最大荧光强度,之后BAG水凝胶复合物在肿瘤区域的荧光强度逐渐减弱(图3B)。同时,肿瘤经激光照射后,BAG+NIR组温度显著升高,表明BAG具有较高的光热转换效果(图3C)。在15天的治疗周期中,记录裸鼠的体重和肿瘤大小,结果显示BAG+NIR组的肿瘤生长抑制作用最强,比BAG组和NIR组更明显(图3D-E)。在裸鼠体重方面,BAG+NIR组相较于控制组无明显不良反应。通过分析离体组织样本评估肿瘤生长抑制效率,如图3F和3G所示,BAG+NIR组的肿瘤增殖抑制显著(高达89.9%)。
为了深入研究抑瘤机制,我们对选定的生物标志物、免疫细胞及代表性细胞因子进行了分析。活性氧(ROS)的生成通常诱发肿瘤内部的氧化应激反应,进而导致核因子E2相关因子-2(Nrf2,即II相酶)的过表达,以及线粒体超氧化物生成或膜去极化功能的紊乱。作为经典的II相酶,血红素加氧酶-1(HO-1)的表达通过Western blot进行了检测。结果显示,与对照组、BAG组和NIR组相比,BAG+NIR组的HO-1表达上调最为显著,这突出了肿瘤内存在显著的氧化应激状态(图3H)。热休克蛋白(HSPs)被视作反映肿瘤增殖、肿瘤细胞坏死及自我防御状态的典型生物标志物,BAG+NIR组中HSP70的表达强度显著低于其他组(0.369 vs. 0.646, 0.954和1.0),验证了其耐热性的显著降低及肿瘤生长抑制的增强(图3H)。在光动力治疗(PDT)过程中,单线态氧(1O2)的生成常伴随显著的氧消耗及HIF-1α表达的上调。然而,BAG+NIR组中HIF-1α的表达仍维持在较低水平,这可能与H2O热电催化生成羟基自由基(•OH)有关,即ROS的主要来源为H2O而非O2的消耗(图3H)。这一发现表明了BAG+NIR策略的优势,其克服了传统O2依赖性ROS生成的限制,并通过肿瘤微环境中的水热电催化生成ROS,为癌症治疗提供了新的策略。此外,我们对血常规及淋巴细胞、单核细胞、中性粒细胞、白细胞等免疫细胞进行了检测。如图3I所示,BAG+NIR组中多数免疫细胞指标均处于较高水平,表明治疗后出现了免疫细胞的募集及免疫系统的激活,为BAG+NIR的肿瘤治疗提供了辅助支持。代表性细胞因子白细胞介素-6(IL-6)和干扰素-γ(IFN-γ)分析表明,BAG+NIR组的IFN-γ水平显著高于其他组,约为其他组的5倍,这进一步支持了通过免疫增强途径有效抑制肿瘤生长的机制(图3J)。
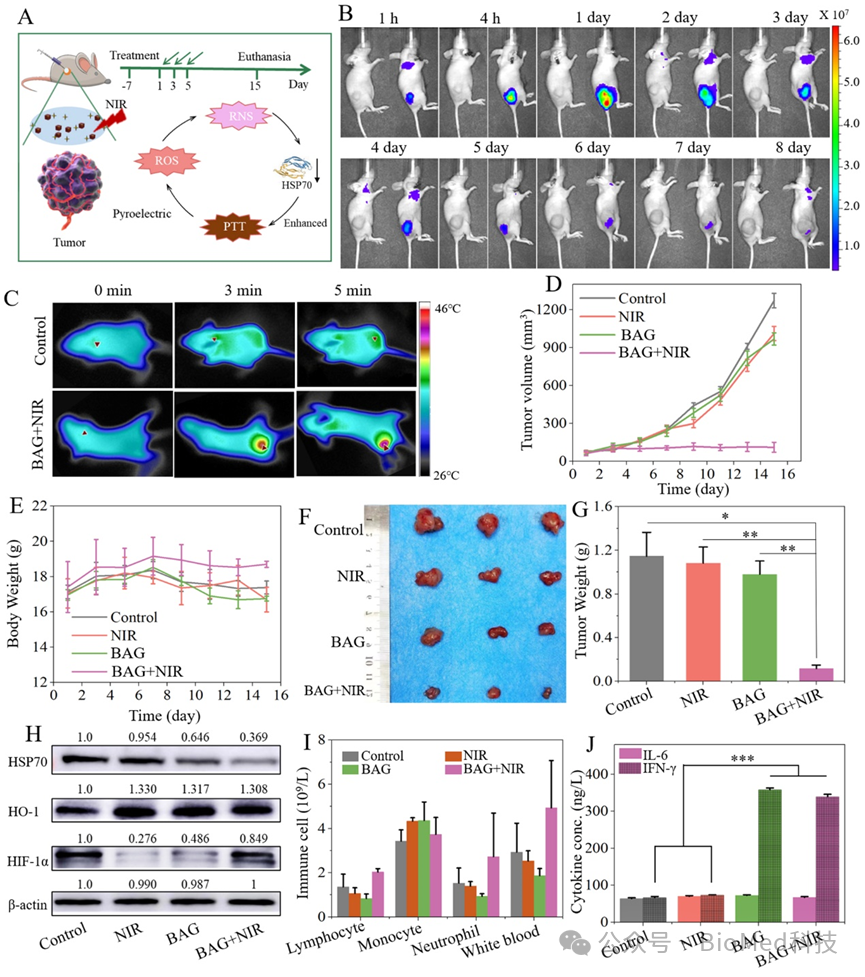
图3. 近红外激光照射下瘤内注射BAG水凝胶复合物的肿瘤治疗与免疫机制。
【结论与展望】
在本项研究中,我们制备了一种新型的可注射水凝胶BPR-ARG@Gel (BAG),作为一种先进的癌症治疗模式用于体内ROS/RNS的持续生成和热电催化。这些热电生物材料利用了热引发电子-空穴分离产生开路电压,从而促进了H2O的催化和大量ROS的产生。该模式克服了缺氧微环境的限制,实现了一种高效的活性氧生成途径。同时,产生的活性氧可以氧化ARG进一步产生NO来协同治疗肿瘤。我们对其抗肿瘤机制进行了探索,发现热释电产生的活性氧对肿瘤产生强大的氧化应激效应,这种氧化应激能够抑制热休克蛋白的表达,抑制肿瘤对热的耐受能力。此外这种氧化应激没有提升乏氧因子的表达,表明该热电催化产生的活性氧不会加剧肿瘤乏氧的微环境。这种治疗模式促进了免疫细胞的募集及免疫系统的激活,增强了白细胞介素-6(IL-6)和干扰素-γ(IFN-γ)的分泌,能够极大促进肿瘤的治疗效果,为肿瘤的治疗干预提供了温和、微创的有效途径。
【课题组简介】
天津大学刘哲教授:天津大学“北洋英才”长聘教授、博士生导师、英国皇家医学会会士(FRSM)、英国皇家化学会会士(FRSC)、英国皇家生物学会会士(FRSB),先后在美国斯坦福大学医学院分子影像研究中心(MIPS)、德国亚琛工业大学亥姆霍兹生物医学工程研究所从事博士后研究,聚焦智能疾病诊疗、可视化医学、影像导航手术等方向,开展基于智能医学材料的疾病干预与治疗新方法、新策略研究,主编中、英、德文学术专著6部(Springer Nature、Elsevier、化学工业出版社),参编中国肿瘤整合诊治技术等临床医学指南三项,兼任Intelligence-Based Medicine(Elsevier)、VIEW(Wiley)、Cancer Letters等国际学术期刊编委。
原文链接:
https://doi.org/10.1021/acsami.4c05836
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肿瘤治疗# #生物电#
0