重庆医科大学刘国栋教授/重庆大学蔡开勇教授《AFM》:自体纳米疫苗诱导免疫多米诺效应以预防胶质母细胞瘤术后复发
2025-02-09 BioMed科技 BioMed科技 发表于陕西省
胶质母细胞瘤切除难、易复发且免疫治疗效果差。重庆医科大学和重庆大学团队设计LLGA-Gel纳米疫苗,能诱导免疫原性多米诺效应,将免疫抑制微环境转变为活化免疫环境,显著预防原位GBM术后复发。
目前胶质母细胞瘤(GBM)的高侵袭性使得肿瘤完全切除极为困难,而且往往容易术后复发。同时GBM 组织富含免疫抑制因子,缺乏细胞毒性T淋巴细胞,从而形成了 “冷 ”免疫抑制肿瘤微环境(TME),阻碍了免疫疗法的疗效。因此重庆医科大学刘国栋教授团队/重庆大学蔡开勇教授团队创造性设计一款纳米疫苗,该疫苗通过将脂多糖(LPS)和GBM细胞裂解物(GCL)共载到层状双氢氧化物(LDH)纳米片中,然后整合到可注射的藻酸盐水凝胶中形成LLGA-Gel。该纳米疫苗利用 GCL 的免疫原性和 LPS 的免疫刺激特性,诱导细胞凋亡,增强树突状细胞成熟,促进巨噬细胞向 M1 表型极化,从而增加 CD8+ T 细胞浸润,减少肿瘤部位的 Foxp3+ Tregs。体内实验表明,这种纳米疫苗不仅提高了免疫原性细胞死亡的效力,还大大增强了免疫反应,从而显著预防了原位 GBM 的术后复发。相关工作以“Autologous Nanovaccine Induces Immunogenic Domino Effect to Prevent Postoperative Recurrence of Orthotopic Glioblastoma“为题发表在《Advanced Functional Materials》上。

【文章要点】
胶质母细胞瘤(GBM)是颅内原发性肿瘤的主要形式,其高度侵袭性,手术无法完全切除肿瘤[1],免疫疗法由于GBM “冷”肿瘤的免疫微环境和基因组的不稳定性导致肿瘤的高度异质性[2],给治疗带来了巨大挑战。为此本研究中,作者创造性设计一款纳米疫苗。如图1所示,LPS 和胶质母细胞瘤细胞裂解物(GCL)共同负载到 MgAl-LDH 纳米片中,形成 LDH-LPS-GCL(LLG),然后将其包裹在可注射的Alg凝胶中,直接应用于GBM的术后腔内。这种配置,尤其是LLG中负载的肿瘤裂解蛋白,具有双重功能。它不仅通过免疫原性肿瘤抗原促进GL261细胞的吸收,而且由于裂解物的免疫原性和特异性粘附分子的表达,还增强了巨噬细胞和树突细胞对纳米材料的内化。由此产生的细胞死亡和抗原释放与 LPS 协同作用,促进DC 细胞成熟和 CD8+ T细胞活化,通过促进巨噬细胞向 M1 表型极化,进一步提高对残余肿瘤细胞的疗效。本研究的纳米疫苗能将免疫抑制微环境转变为活化的免疫环境,从而阻止 GBM 术后复发。
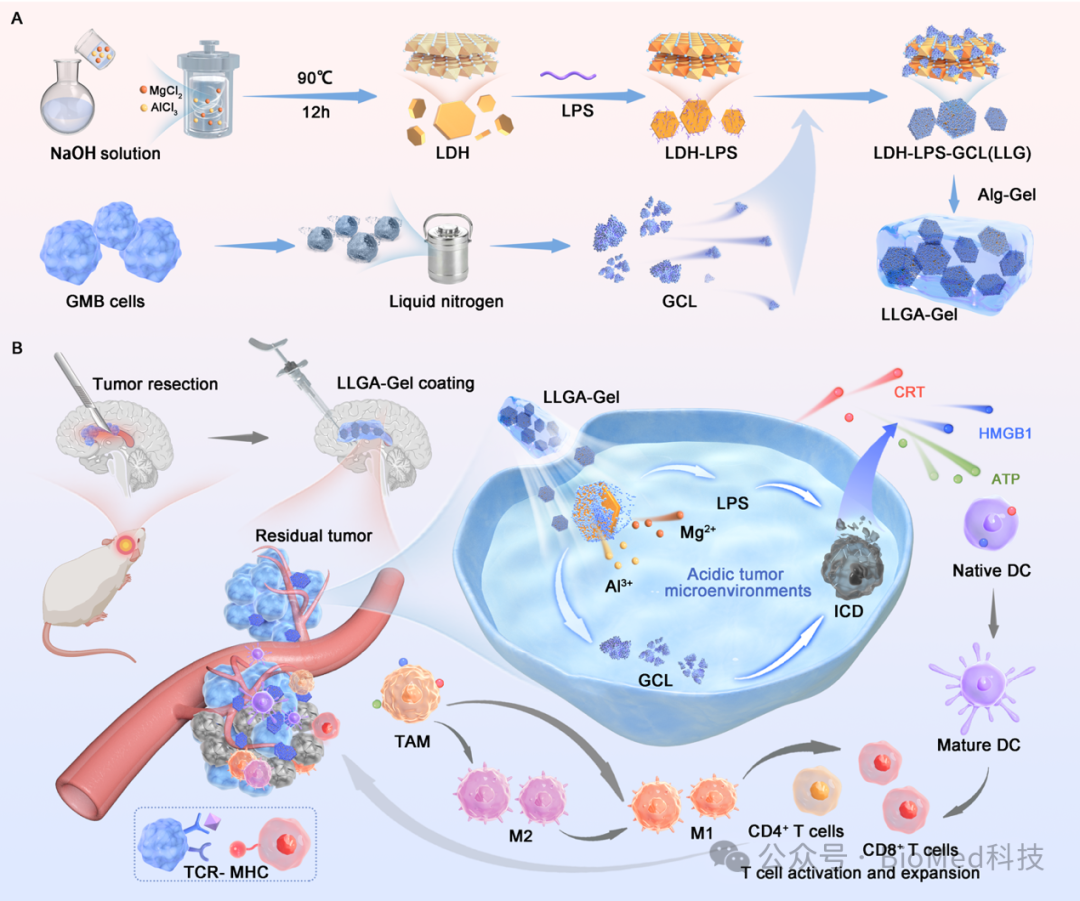
图一 LLGA-Gel纳米疫苗的搭建及抗GBM示意图
本研究中我们采用水热法合成了 MgAl-LDH 纳米片,随后,通过物理吸附将来自大肠杆菌的 LPS 吸附到 LDH 纳米片上。同时为了增强免疫反应,促进肿瘤细胞和免疫细胞等靶细胞对 LDH-LPS 的吸收,将反复冻融得到的 GCL 负载到 LDH-LPS 纳米片上,通过图2的研究结果共同证实了 GCL 在 LLG 中的成功负载。
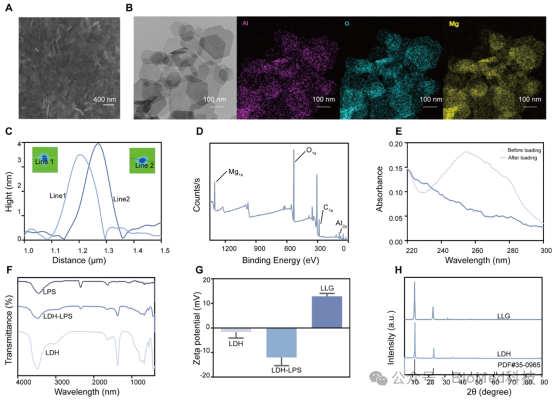
图二 LLG的制备和表征
本研究通过图三体外试验证实LPS能够借助LDH纳米载体增强GL261细胞对其的吸收,而在负载GCL后,这种吸收作用进一步增强,并且LPS能够引起GL261细胞焦亡在本研究也得到证实。重要的是,LLG对 HT22 神经细胞的细胞毒性可忽略不计,这表明 LLG 对正常神经细胞无损伤,这种选择性不仅能最大限度地提高对 GBM 的疗效,还能最大限度地减少对健康脑组织的附带损伤。LPS 诱导的焦亡可能会促进死亡的 GL261 细胞释放抗原物质[3],从而通过促进肿瘤抗原呈现给免疫系统来激活肿瘤的免疫原性细胞死亡(ICD),在本研究中也得到证实。
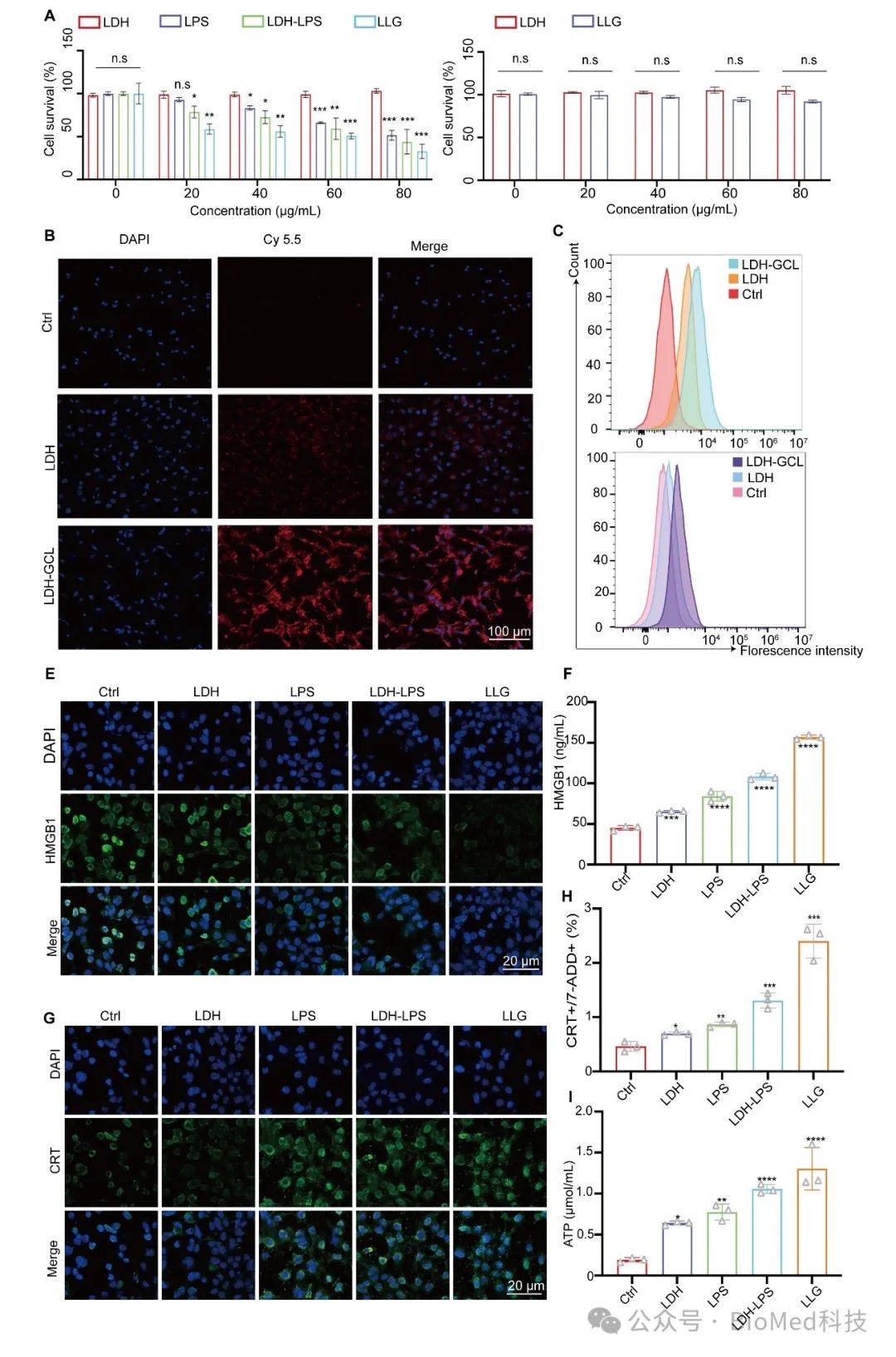
图三 细胞吞噬和体外抗肿瘤效果研究
LPS 可诱导巨噬细胞从M2型向M1型转化[4],通过在本研究中证实了巨噬细胞和DC细胞对LDH-GCL材料的摄取能力增强,这使它们能更有效地引起免疫反应。基于这些认识,我们进一步验证的 LLG 纳米疫苗对促进巨噬细胞极化和 DC 成熟的潜力。通过图四进一步验证了LLG纳米疫苗能有效促进巨噬细胞从亲肿瘤的M2表型极化为抗肿瘤的M1表型,并增强树突状细胞的成熟,这对于在肿瘤微环境中启动强有力的抗癌免疫应答至关重要。
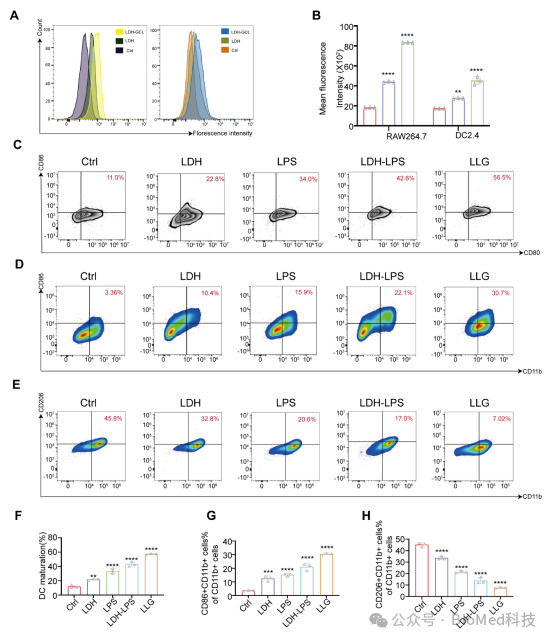
图四 巨噬细胞和DC细胞摄取效果与免疫激活
为了将 LLG 纳米疫苗精准的递送在肿瘤部位,实现肿瘤疫苗和免疫佐剂的持续缓释,我们将 LLG 嵌入 Algel 中,构建了 LLGA-Gel 纳米疫苗,我们建立了一个 GBM 术后模型,给小鼠接种 GL261 细胞,让其生长 12 天,然后在体内荧光显微镜下手术切除可见的颅内肿瘤,图五显示了LLGA-Gel 纳米疫苗不仅能够有效抑制 GBM 术后复发,同时具有良好的生物相容性。
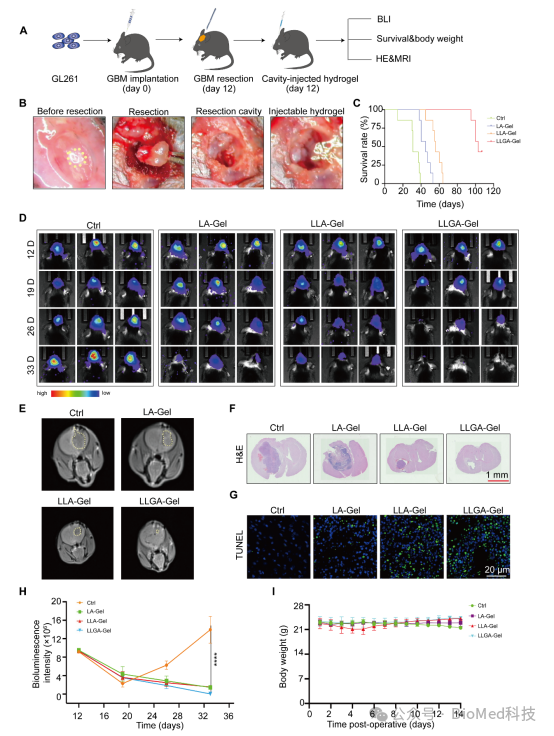
图五 瘤内注射 LLGA纳米疫苗抑制肿瘤复发
为了探索LLGA纳米疫苗抑制正位GBM术后复发的机制,我们评估了LLGA纳米疫苗在体内诱导的抗肿瘤免疫反应。我们的结果表明,脾脏中 CD4+和 CD8+T细胞明显增加,Foxp3+Treg细胞减少,同时治疗后肿瘤组织也显示出同样的免疫调节效应,图六的结果揭示了 LLGA 在改变 TME 的免疫格局方面的功效。
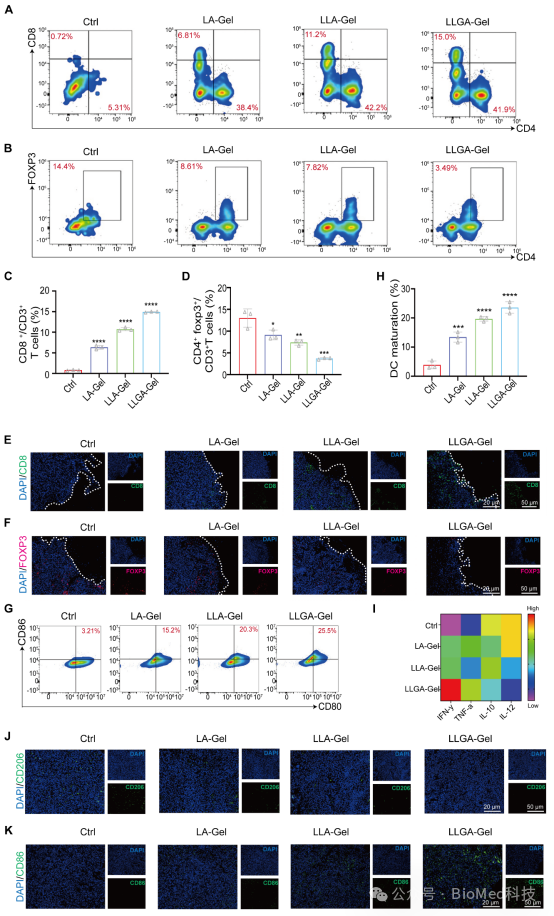
图六 GBM术后小鼠模型免疫细胞激活
【全文总结】
LLG 纳米疫苗的开发和应用为 GBM 治疗提供了一种突破性方法,它通过增强免疫原性反应超越了传统疗法。这种纳米疫苗封装了 GL261 细胞裂解物蛋白,提高了肿瘤细胞、巨噬细胞和树突细胞的吸收率,在诱导免疫原性细胞死亡的同时,最大限度地减少了对健康组织的伤害。进入肿瘤微环境后,它们会触发靶向性细胞焦亡,引发多米诺骨牌效应,放大免疫原性肿瘤抗原的存在,增强治疗的免疫刺激潜力。体内实验表明,手术后应用 LLG 纳米疫苗可明显预防 GBM 复发,将肿瘤部位转化为免疫激活中心,凸显了纳米材料协调全面、持续的抗肿瘤免疫反应的潜力。
参考文献:
[1] a)A. C. Tan, D. M. Ashley, G. Y. Lopez, M. Malinzak, H. S. Friedman, M. Khasraw, CA Cancer J Clin 2020, 70, 299; b)E. Massaad, W. J. Smith, J. Bradley, E. Esposito, M. Gupta, E. Burns, R. Burns, J. K. Velarde, I. K. Berglar, R. Gupta, M. Martinez-Lage, J. Dietrich, J. K. Lennerz, G. P. Dunn, P. S. Jones, B. D. Choi, A. E. Kim, M. Frosch, F. G. Barker, 2nd, W. T. Curry, B. S. Carter, B. V. Nahed, D. P. Cahill, G. M. Shankar, Neuro Oncol 2024.
[2] E. K. Nduom, M. Weller, A. B. Heimberger, Neuro Oncol 2015, 17 Suppl 7, vii9.
[3] a)X. Xia, X. Wang, Z. Cheng, W. Qin, L. Lei, J. Jiang, J. Hu, Cell Death Dis 2019, 10, 650; b)P. Broz, P. Pelegrin, F. Shao, Nat Rev Immunol 2020, 20, 143.
[4] S. Chen, A. Saeed, Q. Liu, Q. Jiang, H. Xu, G. G. Xiao, L. Rao, Y. Duo, Signal Transduct Target Ther 2023, 8, 207.
原文链接:
https://www.x-mol.com/paper/1886870405284192256
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#胶质母细胞瘤# #免疫原性多米诺效应#
30