Adv Sci:河北医科大学张彦荣/樊淼研究开发了一种生物正交反应驱动的外泌体消除策略
2025-06-14 iNature iNature 发表于上海
该研究开发了一种生物正交反应驱动的外泌体消除(Biordee)策略,该策略利用IgG Fc修饰内源性TExo(TExo-Fc)来促进巨噬细胞介导的吞噬作用。
肿瘤细胞驱动的外泌体(TExo)表现出一些阻碍抗肿瘤治疗的主要缺陷。一种典型的免疫抑制机制是在外泌体PD-L1的帮助下消耗CD8+细胞毒性T细胞。另一种常见的机制是通过促进转移性癌细胞在远处器官的播散和生长来促进肿瘤转移。因此,清除TExo可以为癌症患者的治疗带来诸多益处。
2025 年 6 月 11 日,河北医科大学第三医院张彦荣和河北医科大学药学院樊淼共同通讯在Advanced Science 在线发表题为“Enhancing Chemotherapy-Related Immune Responses via Bioorthogonal Metabolic Engineering-Driven Tumor Exosomes Elimination”的研究论文。该研究开发了一种生物正交反应驱动的外泌体消除(Biordee)策略,该策略利用IgG Fc修饰内源性TExo(TExo-Fc)来促进巨噬细胞介导的吞噬作用。
Biordee策略利用IgG Fc与巨噬细胞FcγRII/III受体的相互作用,有效降低循环系统中的TExo水平,进一步打破机体的免疫抑制并增强化疗后的免疫反应。此外,Biordee策略还抑制了乳腺癌肝转移,而这种抑制作用是通过促进化疗诱导的TExo释放而增强的,该工作为降低化疗后TExo水平以增强抗肿瘤治疗效果提供了一种新的尝试。

外泌体是一类富含生物活性物质(例如蛋白质、DNA、RNA等)的细胞外囊泡,其通过将生物活性物质递送至受体细胞,在细胞间通讯中发挥关键作用。肿瘤细胞驱动型外泌体(TExo)作为一类由特殊细胞分泌的外泌体,已被广泛研究并证实在肿瘤进展和抗肿瘤治疗中发挥重要作用。TExo能够优先寻找特定器官并在那里筑巢,从而为远处器官中的转移性癌细胞构建良好的微环境,从而促进肿瘤转移。此外,外泌体中的PD-L1可以诱导CD8+细胞毒性T细胞在到达肿瘤部位之前进入“疲劳”状态,从而抑制全身免疫反应并促进肿瘤生长。因此,清除内源性TExo被认为是一种有效的治疗途径,可以抑制肿瘤转移并增强抗肿瘤免疫反应。据报道,药物抑制剂,例如GW4869和磺胺异噁唑,能够通过抑制TExo的生物合成来增强抗肿瘤效果。基于外泌体生物合成机制的策略对于进入循环系统的TExo无能为力。因此,一些人工智能纳米材料被开发出来,用于选择性结合和清除TExo。例如,Jia等人利用适体(抗EGFR)修饰的介孔硅纳米粒子,将循环中的TExo从血液中拖曳并转运到小肠。然而,适体对TExo的阳性率限制了人工智能纳米材料的应用效果。
目前,化疗仍然是癌症临床的一线治疗方法。然而,我们注意到最近的研究表明,化疗药物(紫杉烷类和蒽环类药物)可以引发TExo释放增加,进而促进癌症转移。本研究结果表明,在接受化疗的癌症患者中,清除TExo无疑是必要的。在此,我们开发了一种生物正交反应驱动的外泌体消除(Biordee)策略,以抑制化疗相关的乳腺癌转移并增强化疗后的免疫反应(图1)。非天然糖(如甘露糖-N3)常用于通过糖代谢工程在细胞膜上标记化学标签(叠氮基,N3),这些标签可以通过高效的化学反应与其他分子偶联,实现后续的靶分子修饰。缺乏工程靶向基团的脂质体常被用作药物载体,因其良好的生物相容性及显著的在肿瘤组织中蓄积的趋势而受到认可。
我们首先构建了甘露糖-N3@脂质体(Man@Lip)制剂,以提高Biordee策略在未来临床应用中的可行性。在此基础上,利用糖代谢工程技术标记肿瘤细胞,获得携带N3基团的TExo(TExo-N3),主要是由于外泌体上存在来源于细胞膜的蛋白成分。选择免疫球蛋白G(IgG Fc)的Fc段作为修饰物,二苯并环辛炔基团(DBCO)修饰的IgG Fc(IgG Fc-DBCO)与TExo-N3进行特定的生物正交反应,获得IgG Fc工程化的TExo(TExo-Fc)。TExo-Fc表面的IgG Fc与巨噬细胞的FcγRII/III受体相互作用,促进巨噬细胞对TExo的吞噬作用(图1A)。本研究建立了化疗药物阿霉素(DOX)治疗乳腺癌的小鼠模型。结果表明,我们的Biordee策略抑制了化疗增强的乳腺癌肝转移,并且这种增强的转移被认为与DOX诱导的TExo释放增加密切相关。此外,去除内源性TExo可降低外泌体PD-L1对机体免疫反应的抑制,进一步增强化疗相关的免疫治疗(图1B)。我们的Biordee策略为改善化疗患者的治疗效果和预后开辟了一条潜在可行的途径。
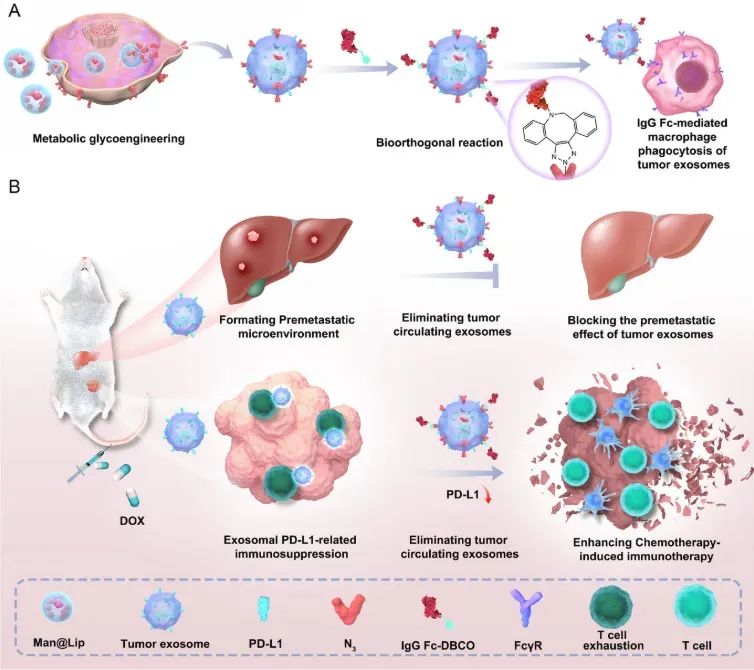
图1(图源自Advanced Science )
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202506409
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#外泌体# #巨噬细胞介导#
4