CAR-T 细胞疗法后的长期认知障碍:机制、意义与研究新方向
18小时前 MedSci原创 MedSci原创 发表于上海
Geraghty等人的研究为CAR T细胞疗法后的长期神经不良反应提供了首个系统且深入的机制性解释,明确了除急性炎症反应外,持续存在的神经微环境性炎症才是导致认知障碍的主因。
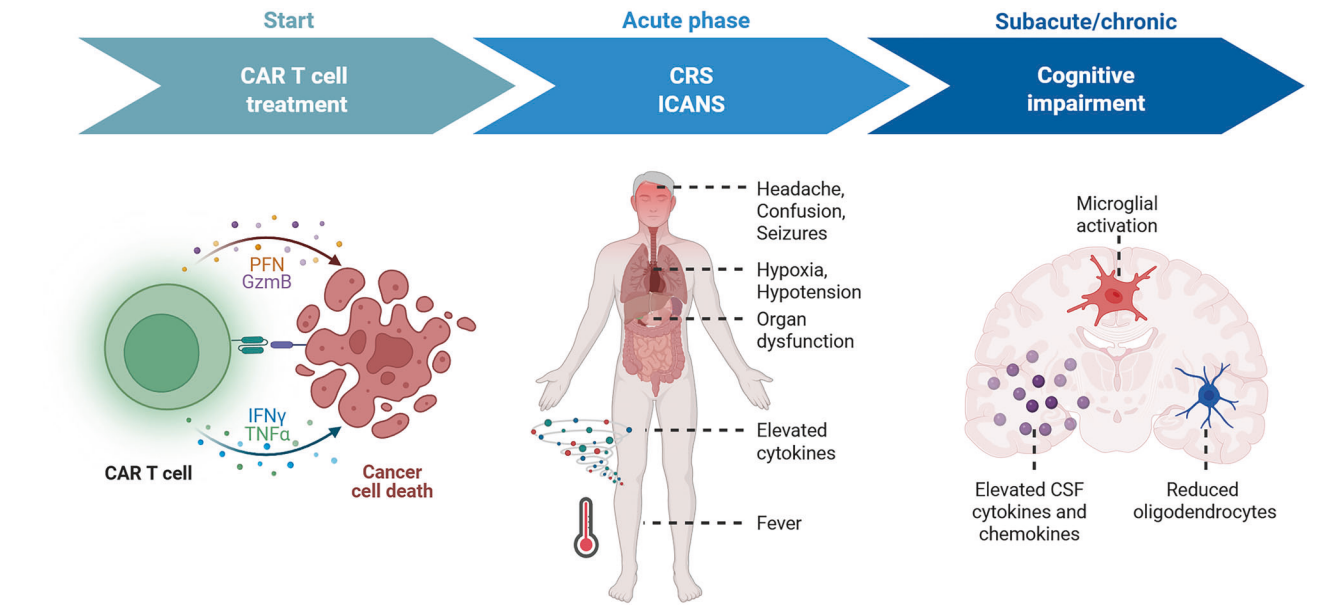
免疫细胞疗法的飞速发展,尤其是嵌合抗原受体T细胞(CAR-T细胞)技术的广泛应用,极大改善了血液系统恶性肿瘤患者的治疗前景。然而,随着 CAR-T细胞疗法成功率和临床应用的增加,患者在经历急性细胞因子释放综合征(CRS)和免疫相关神经毒性综合征(ICANS)之余,部分患者报告出现了长期认知功能减退,但这一表现尚未被充分认识和系统阐述。
2025年,Geraghty等人在Signal Transduct Target Ther杂志发表了开创性成果,采用多种小鼠模型系统深入探讨了CAR-T细胞疗法带来的认知障碍机制,发现在肿瘤清除后仍存在记忆、注意力等认知功能的持续受损,并首次明确了持续神经炎症中的关键角色及潜在干预靶点。本文基于该研究,结合权威解读,全面剖析CAR-T细胞疗法后认知障碍的生物学机制、临床意义和未来研究方向。

研究团队选用免疫缺陷小鼠承载多种肿瘤,包括中枢神经系统(CNS)肿瘤如弥漫性内在桥脑胶质瘤(DIPG)及血液系统和骨肉瘤等非CNS肿瘤,注入针对性CAR-T细胞,评估肿瘤清除效果后,采用新物体识别实验(Novel Object Recognition Test)和T迷宫测试(T-maze Test)评定认知功能。
此外,团队结合脑脊液细胞因子谱分析、脑组织免疫组化、单核RNA测序与线粒体荧光染色,深入解析微胶质细胞活化状态和髓鞘结构变化。对潜在治疗措施如CSF1R抑制剂(PLX5622)和CCR3受体阻断剂的干预效果也进行了行为学和组织学验证。
CAR-T细胞疗法诱导的长期认知障碍证据
-
多模型实验显示,接受肿瘤清除剂量CAR-T细胞治疗的小鼠,显著表现出注意力缺陷和短期记忆降低,行为学测试失败率明显高于对照组,且这种认知障碍不仅存在于中枢神经系统肿瘤模型(DIPG),也在淋巴细胞白血病和骨肉瘤模型中出现,表明认知损伤的普遍性。
-
对比未出现认知功能减退的肿瘤快速清除组,研究指出持久性炎症反应(而非单纯的肿瘤清除)是认知损伤的关键诱因。
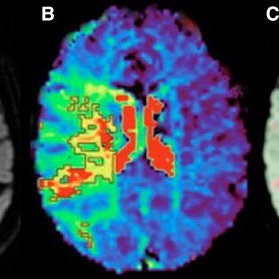
图 CAR-T细胞治疗后不同时期的神经毒性表现及机制示意图
持续神经炎症机制与微胶质细胞激活
-
免疫组化染色与单核RNA测序发现,治疗后小鼠大脑白质区存在微胶质细胞持续激活,呈现“反应性”表型,伴有关键趋化因子如CCL11(Eotaxin)、CCL2、CCL7及CXCL10表达显著上升。
-
微胶质细胞转录组分析揭示其趋向产生免疫调节相关趋化因子,造成神经环境变异。
髓鞘与海马神经发生受损
-
与炎症相关,亚皮质的少突胶质细胞数量明显下降,髓鞘密度减少,神经元髓鞘结构损害明显,提示髓鞘生成障碍。
-
海马区神经发生活性降低,影响记忆形成与认知处理。
同步验证人类临床样本
- 采用接受CAR-T细胞治疗的脑干肿瘤患者前额叶单核RNA测序,发现微胶质和少突胶质细胞转录状态的变化与小鼠模型相符,提示所发现机制在人类疾病中具有临床相关性和推广意义。
治疗探索与新靶点验证

-
结果明确表明微胶质细胞和其趋化因子信号是认知障碍形成的关键环节。
-
目前临床用于ICANS的抗炎药物Anakinra对认知损伤无效,提示需开发新的干预手段。
研究的意义与展望
Geraghty等人的研究为CAR-T细胞疗法后的长期神经不良反应提供了首个系统且深入的机制性解释,明确了除急性炎症反应外,持续存在的神经微环境性炎症才是导致认知障碍的主因,且该炎症与微胶质细胞功能紊乱和髓鞘损伤密切相关。
这一发现填补了该领域的空白,提示治疗CAR-T细胞关系患者时,需关注并随访长期神经认知功能,避免忽视后期慢性毒性,为临床提供了治疗靶点——微胶质细胞和CCR3信号轴,为后续研究创造了新起点。临床需要试验评估针对这些靶点的药物安全性及有效性,制定系统的认知障碍筛查体系。
此外,研究还暗示了类似机制在其他炎症相关神经紊乱病症中的普适意义,如COVID-19感染后的认知障碍,拓展了免疫神经科学的视野。未来,不同CAR-T细胞靶向抗原(如BCMA)是否存在类似神经炎症风险,以及免疫状态完整的动物模型中认知影响的评估,都是亟待重点突破的方向。
原始出处:
Gabriel K, Kobold S. Long-term consequences of cancer therapy: cognitive impairment following CAR-T cell therapy. Signal Transduct Target Ther. 2025;10:226. doi:10.1038/s41392-025-02324-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#神经毒性# #CAR-T 细胞疗法#
6 举报