Circ Res 上海交通大学医学院瑞金医院高平进教授团队揭示PGC-1α调控管周基质细胞分化参与动脉瘤发生发展的作用机制
18小时前 论道心血管 论道心血管 发表于上海
该研究揭示了PGC-1α调控SM22α+管周基质细胞分化参与PVAT重塑,从而影响动脉瘤的进展。并且通过影像组学分析动脉瘤血管外周脂肪组织特征,以评估动脉瘤的严重程度。
腹主动脉瘤(abdominal aortic aneurysm, AAA)是一种致死率高的扩张性主动脉疾病,随着年龄的增长,腹主动脉瘤的发生率显著上升,这与年龄相关的血管结构及功能改变密切相关。血管周围脂肪组织(perivascular adipose tissue, PVAT)作为血管组成的重要成分,参与调控血管稳态,随着年龄的增长,PVAT发生结构及功能重塑,这与多种血管疾病,包括腹主动脉瘤的发病机制密切相关。PVAT中存在异质性的基质细胞,至今仍缺乏特异性的标志物。衰老会引起管周基质细胞分化能力改变,从而影响血管微环境的稳态,其在腹主动脉瘤发生发展中的作用有待进一步探究。
2025年5月15日,上海交通大学医学院瑞金医院/上海市高血压研究所高平进教授团队在Circulation Research杂志上在线发表题为“SM22α-lineage perivascular stromal cells contribute to abdominal aortic aneurysm”的研究论文,揭示了PGC-1α调控SM22α+管周基质细胞分化参与PVAT重塑,从而影响动脉瘤的进展。并且通过影像组学分析动脉瘤血管外周脂肪组织特征,以评估动脉瘤的严重程度。

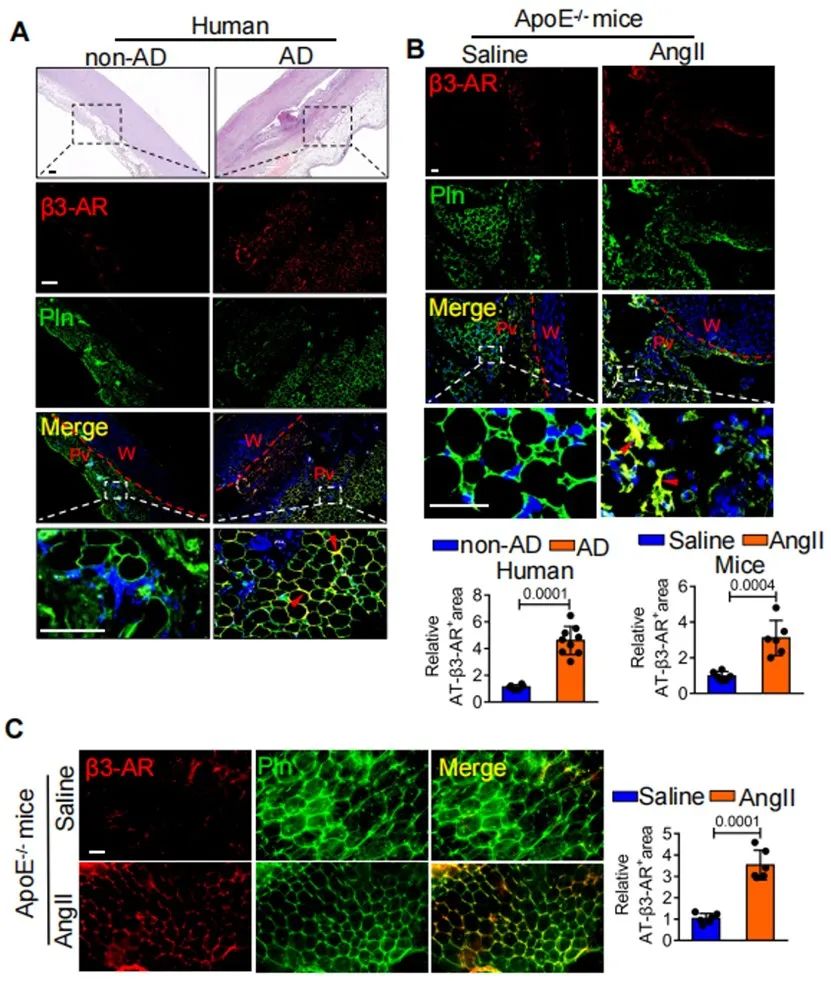
研究团队利用老年小鼠制备动脉瘤模型,发现PVAT重塑并出现大量SM22α+的细胞。进一步利用单细胞测序分析发现,年轻和年老的SM22α+管周基质细胞(perivascular stromal cells, PVSCs)的分化潜能具有显著差异,并且衰老PVSCs的PGC-1α表达显著下调。于是研究团队进一步构建了SM22α+基质细胞PGC1α条件性敲除小鼠,并标记上红色荧光蛋白进行体内示踪SM22α+ PVSCs体内分化命运。在此基础上制备动脉瘤模型,证实SM22α+管周基质细胞PGC-1α缺失导致小鼠动脉瘤的发生。进一步的免疫荧光结果显示,SM22α+管周基质细胞来源的脂肪细胞减少,而肌成纤维细胞增多,并分泌MMP2。
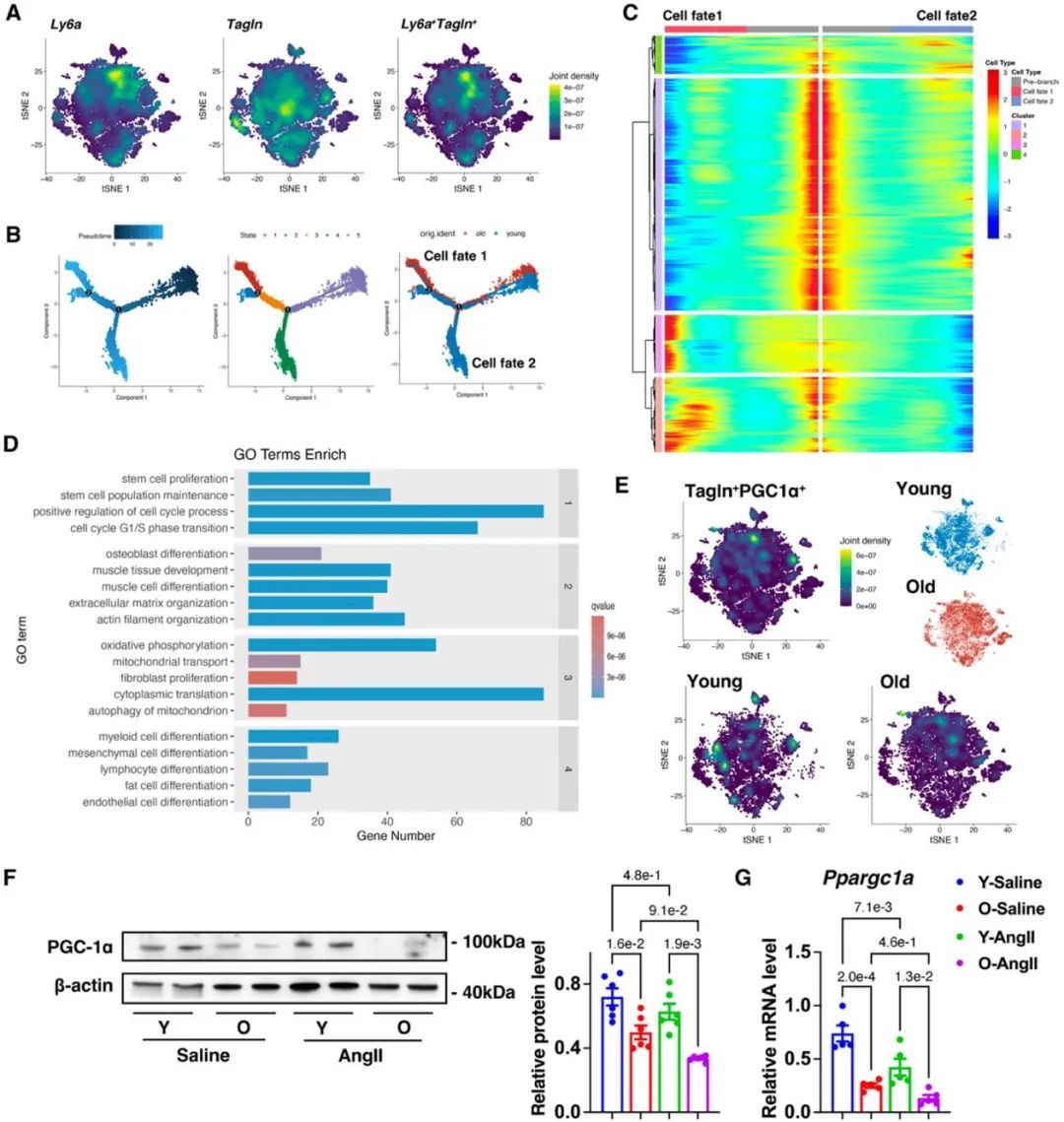
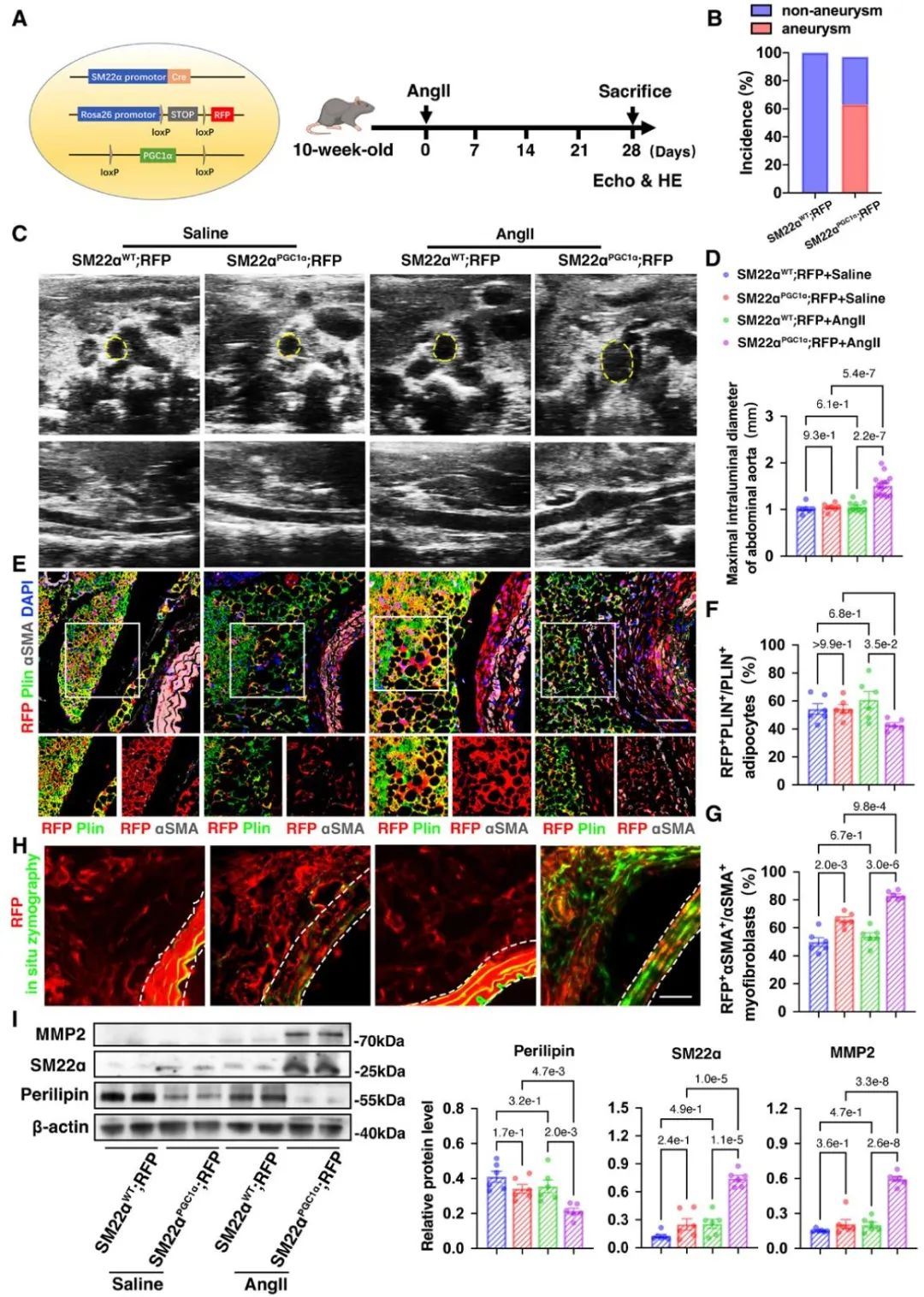
进一步研究发现,敲低管周基质细胞PGC-1α促进YAP去磷酸化,使其入核从而调控PVSCs向肌成纤维细胞分化。体内/体外运用YAP抑制剂Verteporfin可改善PGC-1α缺乏的PVSCs成脂分化潜能并抑制腹主动脉瘤的发生。以上结果在人动脉瘤样本中得到验证。PVAT在动脉瘤的发生发展中起重要作用,但人的PVAT组织难以取得。基于动脉瘤患者的CT影像,研究团队利用影像组学分析其PVAT特征,证实PVAT的脂肪衰减指数(fat attenuation index, FAI)与动脉瘤直径呈正相关。
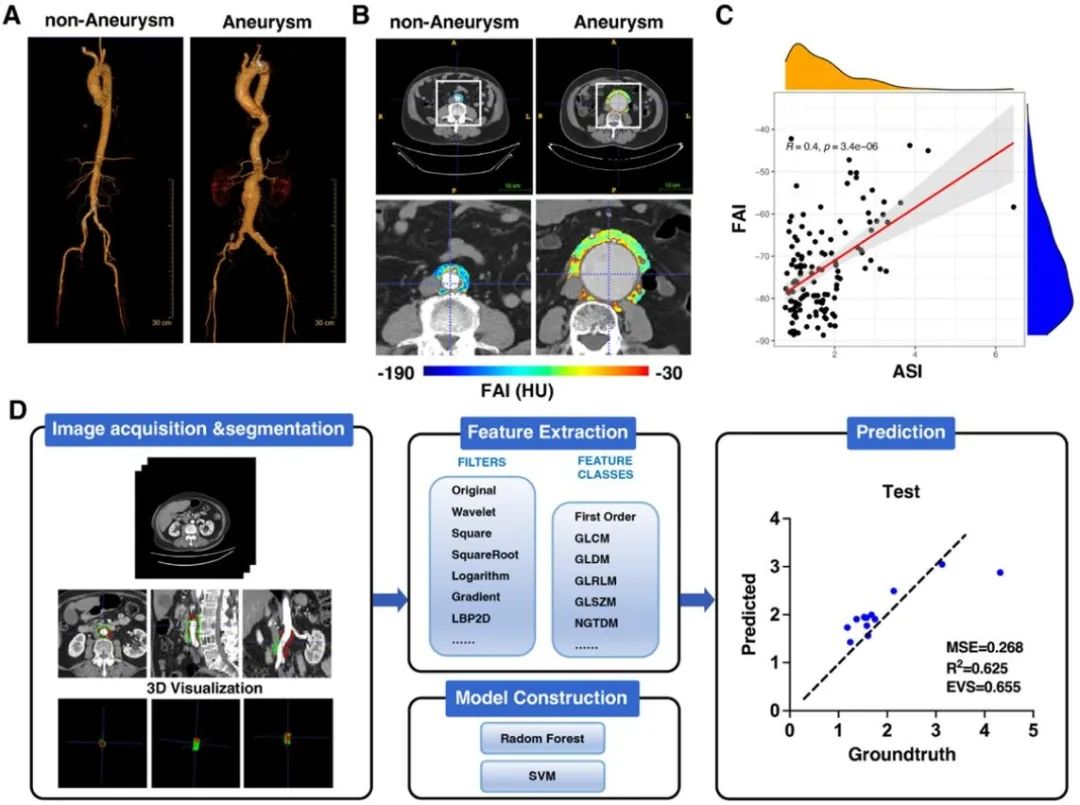
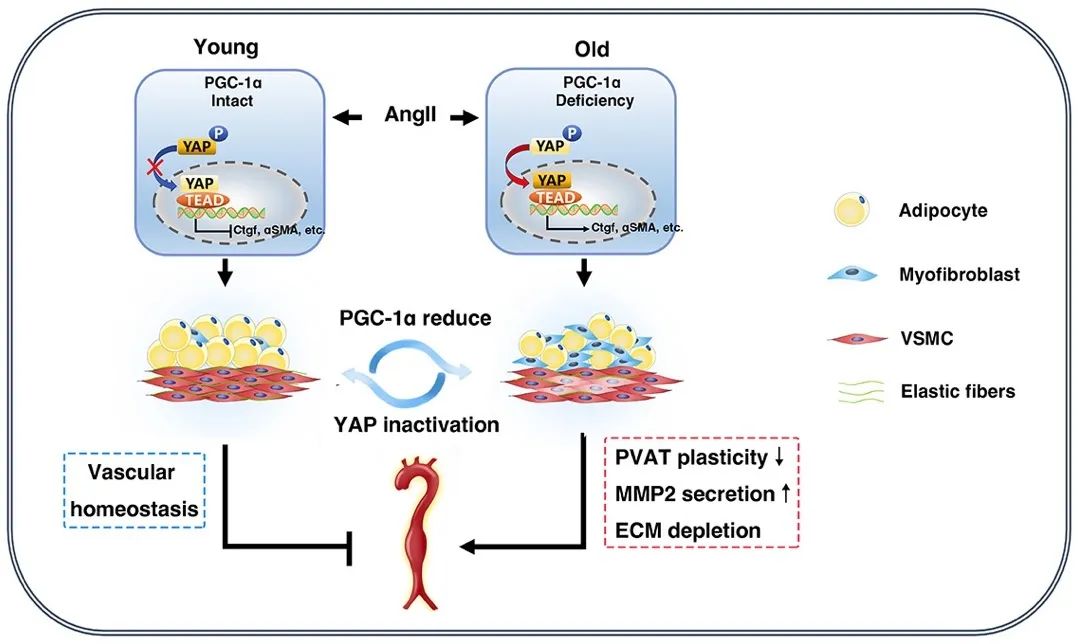
综上所述,本研究揭示了SM22α+管周基质细胞中PGC1α缺失,通过调控YAP信号通路干扰成脂分化与成肌分化的平衡,参与调节管周脂肪组织重塑从而影响腹主动脉瘤的发生发展。同时,研究团队利用影像组学评估动脉瘤PVAT结构及动脉瘤严重程度,提供了一种极具前景的无创评估方法。
该研究由上海交通大学医学院瑞金医院/上海市高血压研究所完成。潘晓茜医师、章润硕士为该论文的共同第一作者,高平进教授为该论文的通讯作者。该研究得到国家重点研发计划和国家自然科学基金等项目的支持。
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.325750
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#腹主动脉瘤# #PGC-1α#
1