JHO:BRD4通过抑制RhoB驱动终末红细胞生成的非经典机制解析
15小时前 吾乃喵大人 MedSci原创 发表于上海
研究团队通过高通量小分子抑制剂筛选、RNA-seq、ATAC-seq及CUT&Tag和功能验证等多种手段,系统揭示了BRD4抑制能加速红系细胞的成熟并促进脱核。
研究亮点
- 发现BRD4的抑制促进人类CD34+干/祖细胞及胚胎干细胞来源红系细胞的终末分化,增强了细胞的脱核率。
- 揭示BRD4在红细胞终末分化中,发挥了超出其经典CDK9依赖的非传统转录抑制功能,具体通过与EHMT1/2相互作用沉默小G蛋白RhoB表达,从而调控红系成熟。
- 阐明RhoB作为BRD4调节的下游效应分子,通过调节肌动蛋白重组,参与调控红细胞的终末分化过程,为促进体外血液细胞生成提供潜在新靶点。
近期发表于Journal of Hematology & Oncology的一篇研究,全面探究了表观遗传调控因子BRD4在红细胞终末分化(终末红细胞生成)中的调节作用。研究团队通过高通量小分子抑制剂筛选、RNA-seq、ATAC-seq及CUT&Tag和功能验证等多种手段,系统揭示了BRD4抑制能加速红系细胞的成熟并促进脱核。研究更深入发现BRD4调控功能不仅依赖其CDK9介导的转录激活作用,还承担着通过EHMT1/2介导的转录抑制,尤其针对小G蛋白RhoB,影响肌动蛋白骨架重组过程,驱动红系成熟。这为造血干/祖细胞向成熟红细胞的表观遗传调控提供了新视角和潜在干预靶点。

红细胞的生成过程被称为红细胞生成(erythropoiesis),其中终末红细胞生成是一个高度调控的多阶段过程,包含原红细胞(Proerythroblasts)向早晚嗜碱性红细胞及多色及正染红细胞的依次分化,最终细胞核被排出形成网织红细胞。该过程中伴随基因转录调控和染色质凝聚,细胞形态及功能发生剧烈转变。众多转录因子、转录协调子及染色质重塑因子参与此过程的精准调控,目前对其分子机制尚未完全明晰。BET(bromodomain and extra-terminal)蛋白家族成员BRD4作为重要的表观遗传读者和转录激活子,因其与CDK9共介导RNA聚合酶II转录延伸被广泛研究于细胞增殖与癌症领域,但其在红细胞终末分化中的具体调控功能及机制仍未明了。伴随无效红细胞生成症如骨髓增生异常综合征(MDS)等临床困境,阐明红细胞生成的关键调控机制具有重要意义。
本研究基于人类外周血和脐带血分离获得CD34+干/祖细胞,体外建立三阶段红细胞分化体系。采用超过300种针对转录及表观遗传调控因子的药物小分子库筛选,辅以多维组学分析(RNA-seq、ATAC-seq及CUT&Tag)、ChIP-qPCR及共免疫沉淀(Co-IP)技术,结合shRNA及siRNA介导的基因功能沉默,解析BRD4及下游靶点在红细胞分化中的作用。抓取验证采用内源性红系细胞系及胚胎干细胞衍生红细胞系统,保证结果的稳健性与广泛适用性。
主要研究结果
1、BRD4作为负调控因子,抑制其功能促进红系终末成熟
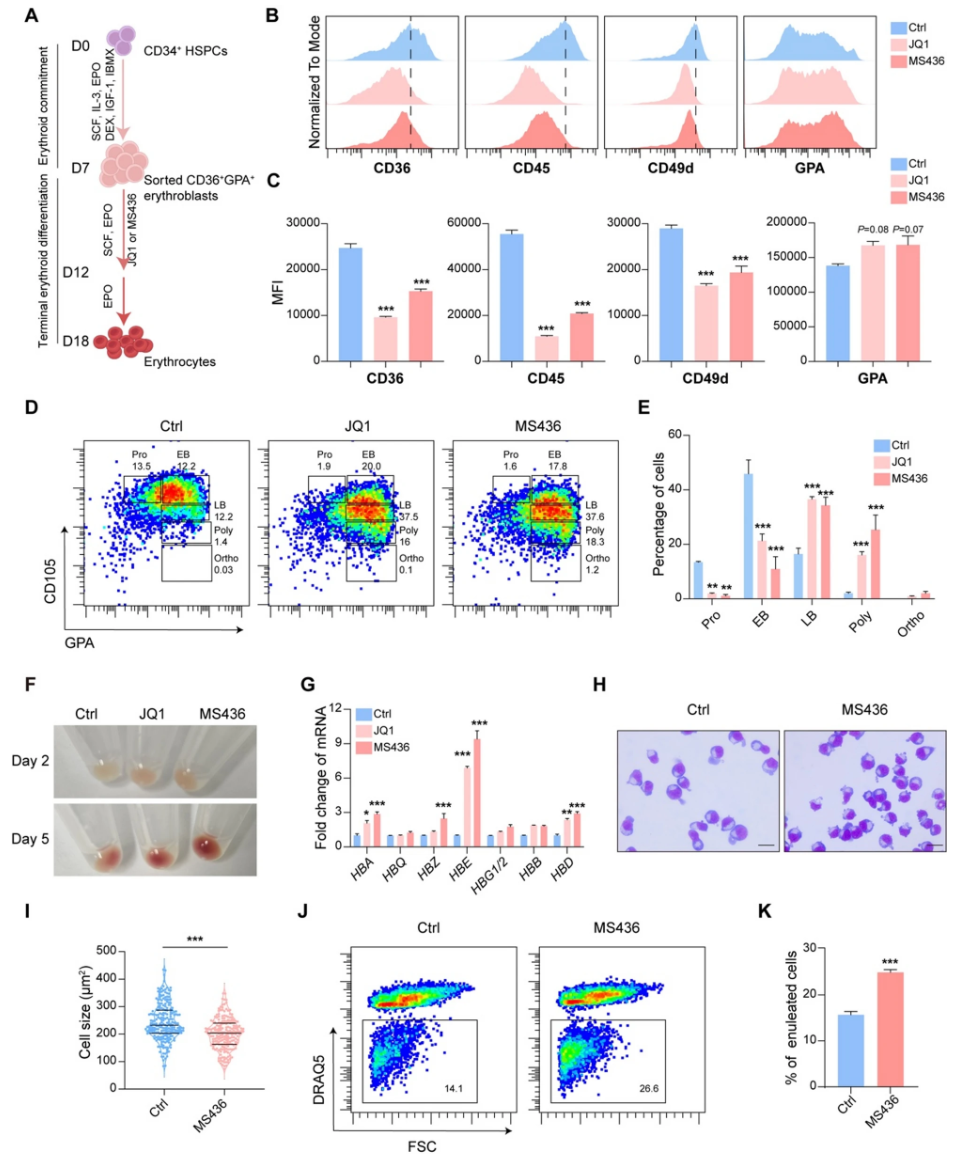
通过对脐带血CD34+细胞衍生红细胞加药物小分子库筛选发现,BET蛋白抑制剂中以BRD4为主要靶点的抑制剂显著促进终末红系分化。流式细胞术检测表明,BRD4抑制剂处理组红细胞表面标志物(CD36、CD45、CD49d)特征的表达动态符合更成熟的红细胞谱系;GPA表达轻微增高,代表发育进程加快。形态学染色(MGG)及细胞尺寸测定显示,BRD4抑制促进细胞核浓缩及体积缩小。重要的是,BRD4抑制显著提高细胞的脱核率,说明加速分化至成熟红细胞阶段。
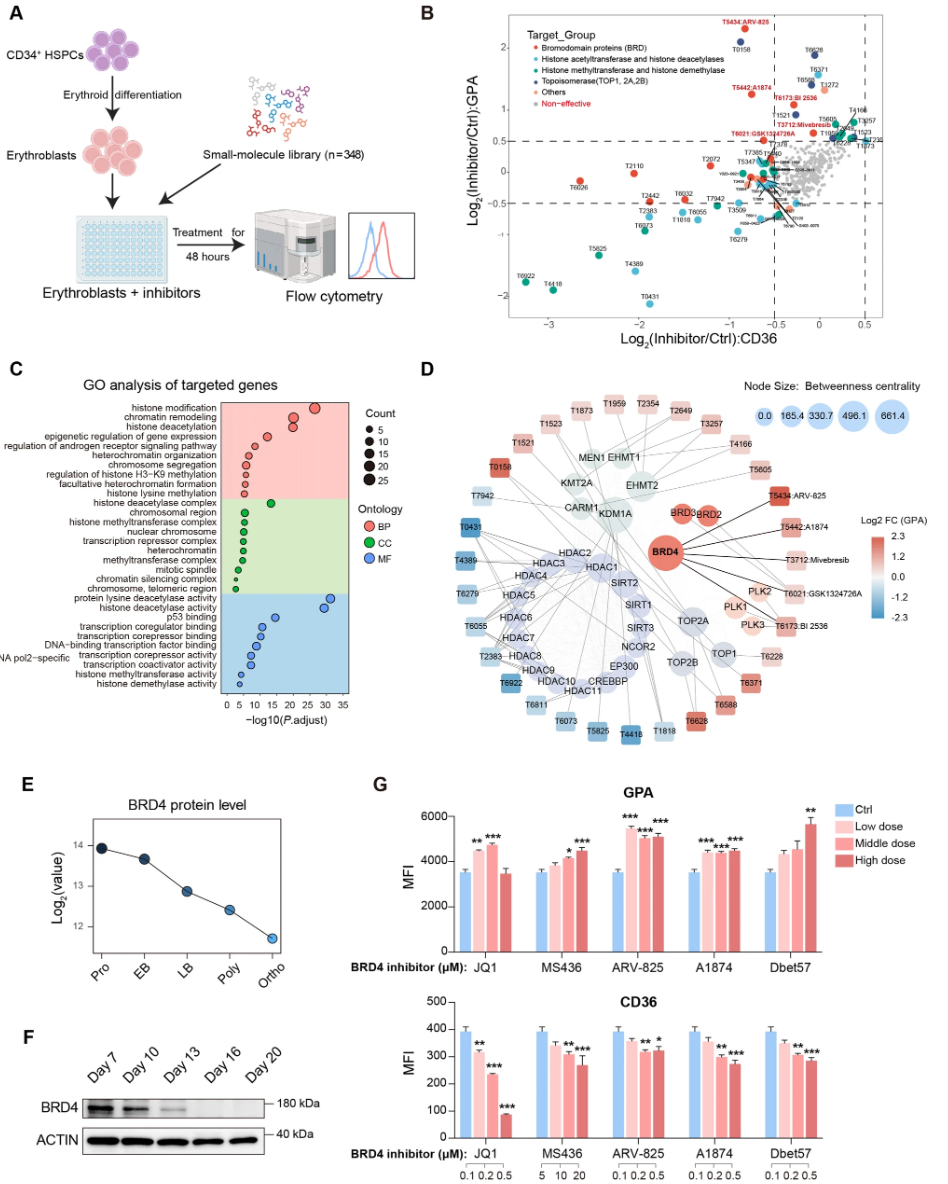
图1
2、多组学联合解析证实BRD4抑制加速红系细胞成熟
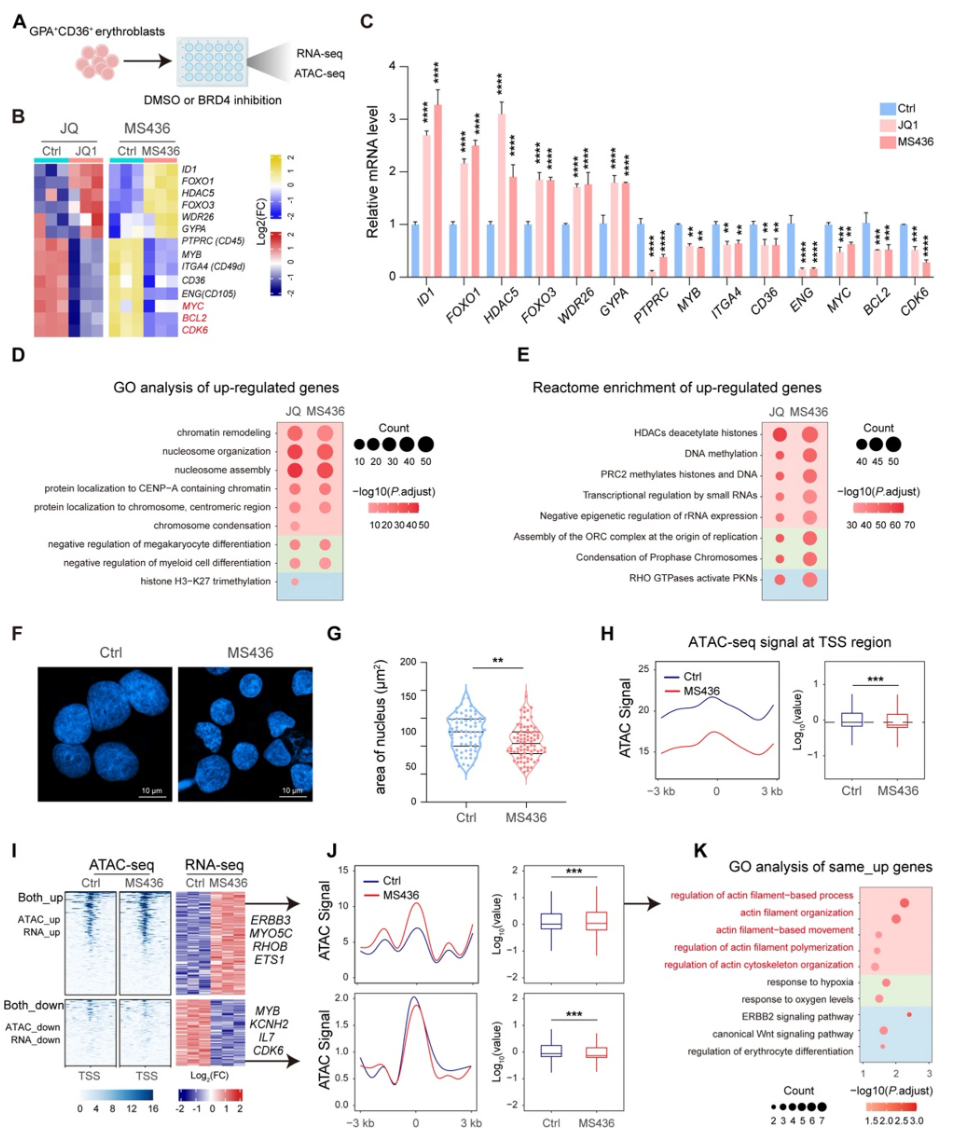
RNA-seq数据显示BRD4抑制使得与终末分化正相关的基因(如HDAC5、FOXO1)显著上调,而增殖及免疫调节相关基因(如MYC、CD36)下调。ATAC-seq显示全基因组转录起始位点附近染色质更加闭合,代表全局转录水平降低,符合同期终末红系染色质凝聚特征。联合分析RNA-seq与ATAC-seq揭示BRD4抑制增加了与肌动蛋白重组织相关基因的开放染色质和表达(包括RHOB),而增殖相关基因染色质闭合、表达下降。重分析公开数据进一步佐证这一结论,提示BRD4抑制推动红系分化谱系的正常发育轨迹。
4、BRD4调控红细胞成熟独立于其经典的CDK9依赖性机制
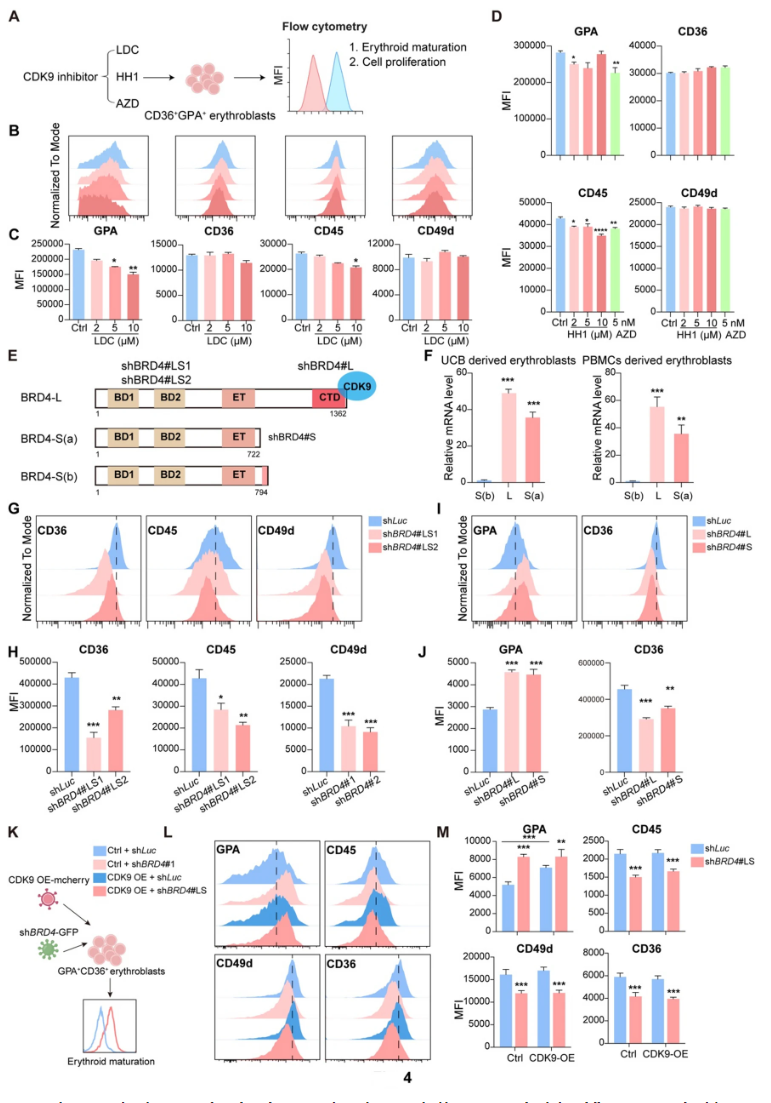
BRD4传统功能通过其C端结构域与CDK9结合,促进RNA聚合酶II从启动子暂停状态释放,激活靶基因转录落地。研究观察CDK9表达在终末分化过程中逐渐下降。使用CDK9抑制剂(LDC00067、HH1、AZD4573)处理红细胞,不仅未加速分化,反而抑制GPA表达,减少细胞增殖,增加凋亡。shRNA特异敲低BRD4全长或短长两个异构蛋白均促进分化标志表达,但CDK9过表达无法逆转BRD4敲低诱导的成熟促进,表明BRD4在红细胞终末分化中的调控存在CDK9独立机制。
5、BRD4通过转录抑制小G蛋白RhoB,调控红细胞终末分化
基于BRD4 CUT&Tag结合RNA-seq和ATAC-seq数据,确定BRD4直接结合且抑制表达的靶基因群。功能富集显示Rho家族小GTP酶通路显著富集,尤以RHOB最为关键。BRD4抑制显著解除RHOB表达抑制,伴随其染色质开放,转录增强,但CDK9及其相关转录活化在该基因位点并无显著变化,支持其转录抑制者身份。ChIP-qPCR验证BRD4与EHMT1/2协同富集于RHOB调控区,BRD4抑制降低H3K9me2沉积,促进RhoB表达。
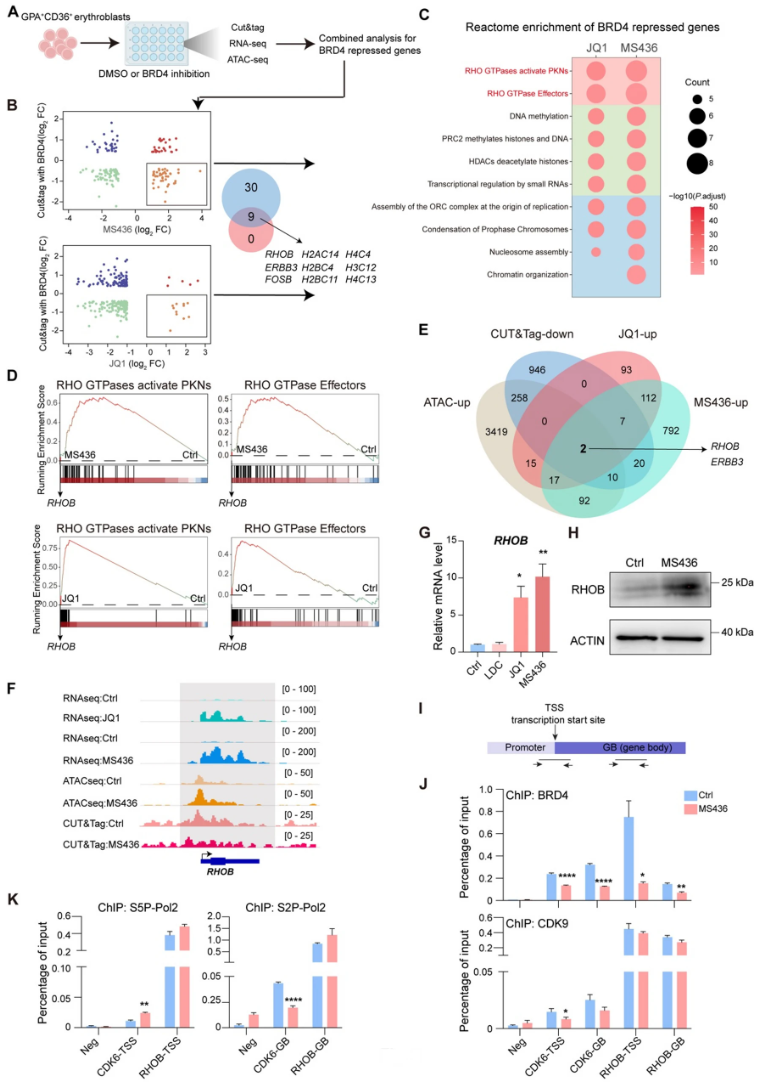
6、RhoB功能验证及其在红细胞终末分化中的作用
重新分析公开数据,RhoB表达及活性在红系终末分化中上调。siRNA和shRNA介导的RhoB敲低阻碍红细胞分化,保持早期标志物表达延迟成熟相关基因上调。RNA-seq及功能富集显示,RhoB缺失细胞中,相关肌动蛋白调控、染色质凝聚等通路被下调。免疫荧光显示RhoB调控肌动蛋白网络,Rho激活剂可模拟BRD4抑制效果促进分化。同时RhoB敲低能部分逆转BRD4抑制诱导的成熟促进行为,提示其为BRD4调控红系细胞成熟的重要效应分子(Fig6)。
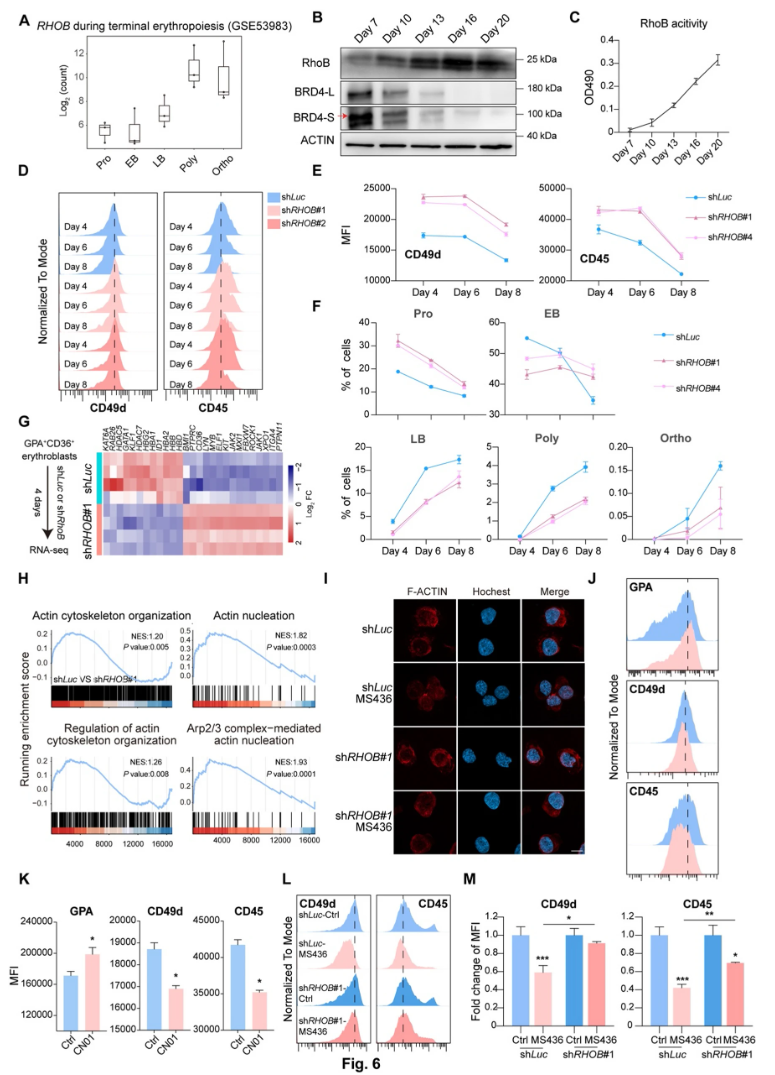
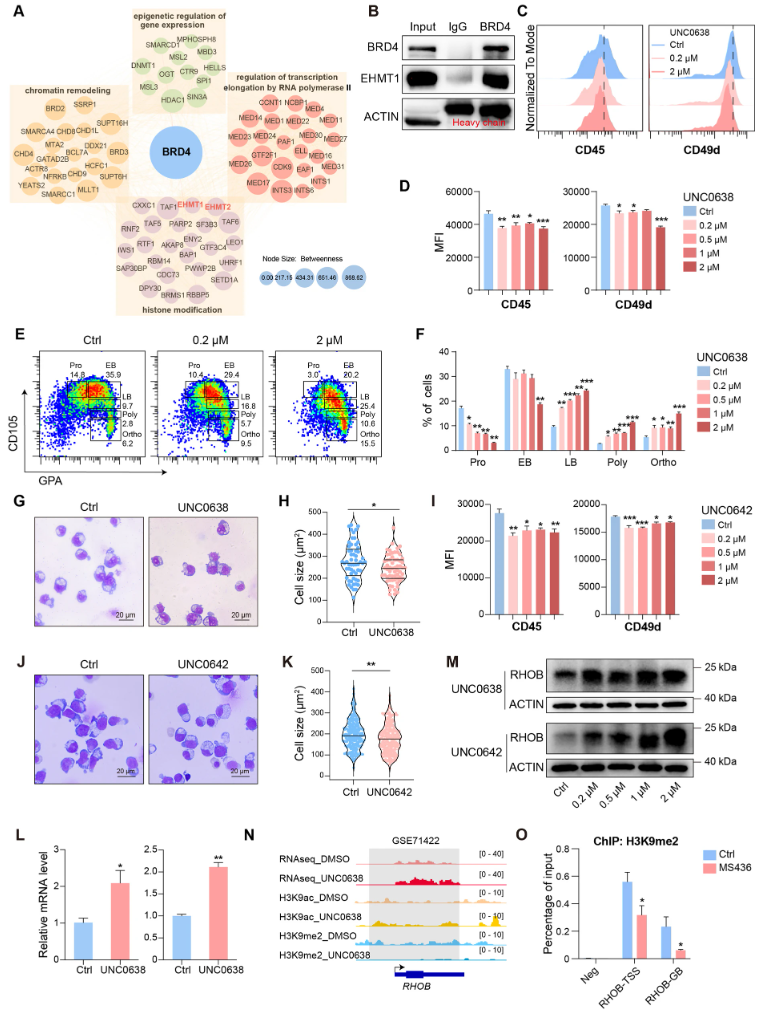
7、BRD4通过与EHMT1/2相互作用参与对RhoB的转录沉默
重新分析BRD4蛋白互作谱,发现BRD4与典型组蛋白甲基转移酶EHMT1和EHMT2存在相互作用关系。Co-IP实验确认二者结合。抑制EHMT1/2酶活(UNC0638,UNC0642)促进红细胞终末分化,复制BRD4抑制效应,伴随RhoB表达提升及H3K9me2标记减少。shRNA敲低EHMT1或EHMT2均促进红细胞分化。ChIP-seq数据及ChIP-qPCR均证明EHMT1/2介导的抑制性H3K9me2修饰参与沉默RhoB基因表达。
研究价值与意义
本研究首次系统揭示BRD4不仅作为转录激活因子,更发挥转录抑制作用,调节红细胞终末分化过程中的关键靶基因RhoB表达。这一发现丰富了BRD4的分子功能多样性,说明其在细胞命运转变中既可作为转录启动子也可作为抑制子,调和细胞增殖和分化过程。BRD4介导的RhoB沉默维持了红系分化的时序与结构重组。该机制的明确,为无效红细胞生成症等造血疾病的分子治疗提供新靶点。实践中,BRD4抑制剂不仅是肿瘤治疗药物的候选,还可能成为临床辅助红细胞体外生成的用药,提升造血重建效率。未来探索其与其他组蛋白修饰酶及转录因子的协同作用,将全方位揭示红系表观遗传调控网络的精细调节机制,推动再生医学及血液病学创新。
原始出处
Chen, Y., Huo, D., Meng, Y. et al. BRD4 acts as a transcriptional repressor of RhoB to inhibit terminal erythropoiesis. J Hematol Oncol 18, 67 (2025). https://doi.org/10.1186/s13045-025-01721-2
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#BRD4# #终末红细胞生成#
6 举报