Adv Mater:中国药科大学姜雷等团队研究发现巨噬细胞靶向纳米粒调节胆固醇稳态以治疗动脉粥样硬化
22小时前 iNature iNature 发表于上海
该研究提出了一种多价纳米平台(siTTENPs))进行动脉粥样硬化治疗。
动脉粥样硬化斑块在动脉壁内的积累导致心血管疾病。富含脂质的巨噬细胞,即泡沫细胞,通过破坏胆固醇稳态和促进炎症,在动脉粥样硬化斑块的进展中起关键作用。
2025年6月27日,中国药科大学姜雷、涂家生、苏志桂共同通讯在Advanced Materials在线发表题为“Lesional Macrophage-Targeted Nanomedicine Regulating Cholesterol Homeostasis for the Treatment of Atherosclerosis”的研究论文,该研究提出了一种多价纳米平台(siTTENPs))进行动脉粥样硬化治疗。
siTTENPs可以与核酸siTRPM2形成静电复合物,从而减少泡沫细胞对氧化低密度脂蛋白(oxLDL)的摄取并减轻炎症。同时,β-环糊精(β-CD)修饰siTTENPs促进胆固醇清除,进一步重建脂质稳态。纳米尺寸和S2P肽(CRTLLTVRKC)修饰赋予siTTENPs对病变巨噬细胞的特异性靶向能力,增强其抗动脉粥样硬化功效。因此,siTTENPs递送系统有效抑制病理性胆固醇内化,同时促进胆固醇外排并减少炎症,促进动脉粥样硬化斑块的消退。该研究介绍了一种旨在改善胆固醇稳态的创新治疗策略,对动脉粥样硬化治疗意义重大。

动脉粥样硬化是冠心病、心肌梗塞和中风等各种心血管疾病的主要原因。斑块部位的异常脂质代谢是动脉粥样硬化发展的关键因素。该过程始于动脉壁中低密度脂蛋白(LDL)的滞留和修饰,破坏胆固醇稳态并触发一连串的炎症反应,特别是氧化的低密度脂蛋白(oxLDL)。xLDL被巨噬细胞吸收,导致泡沫细胞的形成,是早期动脉粥样硬化病变的特征。近年来,靶向泡沫细胞已成为动脉粥样硬化研究的重点,主要有三种治疗策略:抑制泡沫细胞形成、增强胆固醇外排及消除炎症反应。然而,已有的治疗干预措施在同步靶向病灶方面存在严重限制。因此,开发一种同时调节胆固醇稳态和减轻炎症级联反应的综合治疗平台成为提高动脉粥样硬化临床疗效的关键。
防止泡沫细胞发育的主要方法为减少巨噬细胞对oxLDL的过度摄取。巨噬细胞主要通过表面CD36清除受体识别和内化oxLDL。近期研究强调了在动脉粥样硬化形成过程中,CD36和Ca2+可渗透瞬时受体电位阳离子通道亚家族M成员2(TRPM2)之间的正反馈回路。抑制TRPM2可下调CD36的表达,靶向TRPM2调节oxLDL的摄取是抑制泡沫细胞形成和减轻脂质斑块积累的一种有效治疗策略。此外,抑制泡沫细胞的形成可以有效减少炎症,但还没有针对这一特定途径的有效药物。RNA干扰(RNAi)技术为选择性沉默TRPM2等基因提供了有效方法,但RNAi的临床应用面临着重大的挑战,如siRNA在体内的不稳定性、核酸酶的快速降解、非特异性靶向、低效率的细胞摄取和内体逃逸。因此,开发能够保护siRNA免受酶降解、增强病变巨噬细胞摄取和促进内体释放的新型siRNA递送系统对于调节巨噬细胞对oxLDL的摄取和抑制泡沫细胞的形成至关重要。
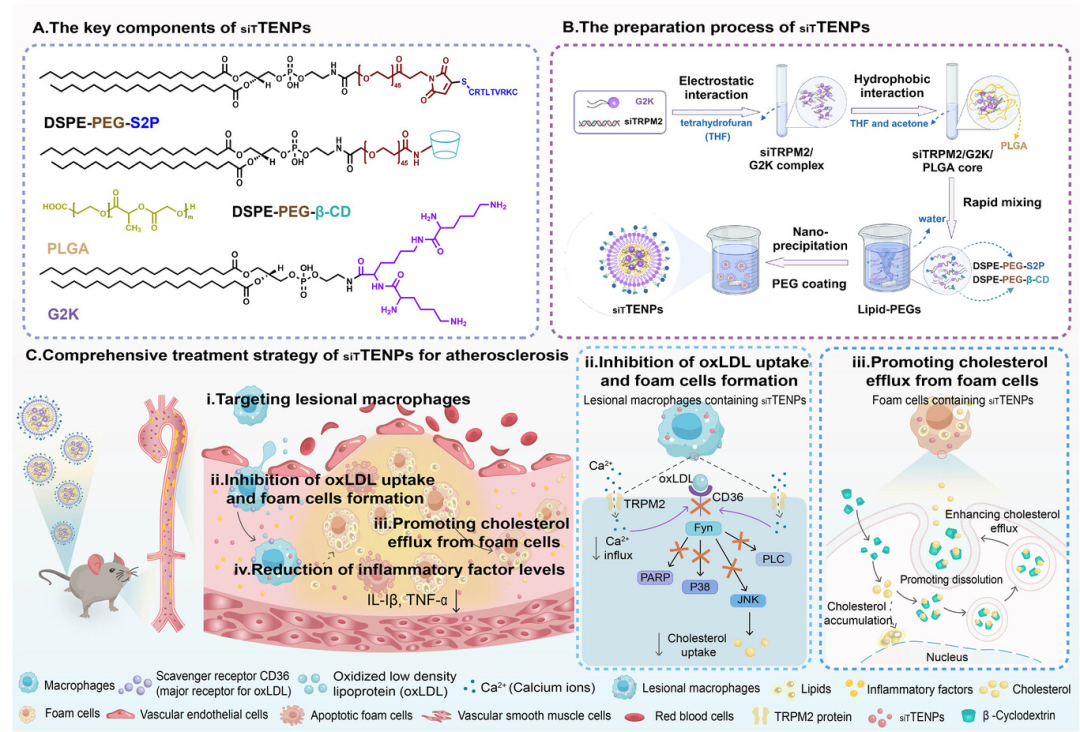
图1 siTTENPs的制备和治疗动脉粥样硬化的示意图(摘自Advanced Materials)
增强泡沫细胞中的胆固醇外排是维持脂质代谢平衡的另一种重要机制。胆固醇外排涉及多种机制,如由ATP结合盒转运蛋白ABCA1和ABCG1介导的转运、被动扩散、肝脏清除率以及B类清道夫受体I型(SR-BI)促进的反向胆固醇转运,都依赖特定的受体来有效促进胆固醇的去除和易位。环糊精(CD)可以将胆固醇包封在其疏水腔中,促进胆固醇的溶解和排出,从而减少细胞内胆固醇的积累。在转运蛋白功能受损或病理状况下,显著降低动物模型和人类患者动脉粥样硬化的发生率。因此,CD是治疗动脉粥样硬化的有效药物,但其对斑块靶向的特异性不足,剂量过大可能导致耳毒性或溶血等不良反应。
该研究设计了一个用于动脉粥样硬化治疗的多价纳米平台,展示了靶向递送到病变巨噬细胞、特异性敲低TRPM2基因和增强胆固醇外排的协同能力。siTTENPs由阳离子树突状脂肽(G2K)、聚乳酸-羟基乙酸共聚物(PLGA)聚合物、用于靶向递送(T)的聚乙二醇化脂质DSPE-PEG-S2P(CRTLLTVRKC)和用于胆固醇外排(E)的DSPE-PEG-β-CD和治疗性核酸siTRPM2(siT)制备而成。siTTENPs的概念化和工程化考虑了以下因素:i)树突状脂肽G2K与siTRPM2静电复合物,有助于增强siRNA对酶降解的保护,同时促进病变巨噬细胞内化和内体逃逸,从而减弱oxLDL摄取并抑制泡沫细胞形成;ii)PLGA与siRNA-树突状脂肽复合物疏水相互作用,实现功能性PEGylation修饰;iii)S2P肽偶联的聚乙二醇化脂质特异性识别病变巨噬细胞的稳定素2受体;iv)环糊精修饰的聚乙二醇化脂质在较低治疗剂量下增强胆固醇溶解和外排功效。体外和体内研究表明,siTTENPs靶向和调节胆固醇代谢的能力显著增强,能够减少主动脉斑块负荷并解决现有的治疗局限性。
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202502581
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#动脉粥样硬化# #siTTENPs#
7 举报