Nat Cancer | 非小细胞肺癌TILs治疗耐药机制:肿瘤抗原丢失与T细胞功能失调的双重困境
2025-05-13 MedSci原创 MedSci原创 发表于上海
该研究揭示了TILs治疗抵抗的潜在机制,包括肿瘤反应性T细胞的功能失调、外周血中抗原反应性T细胞克隆型的快速衰减,以及肿瘤细胞通过丢失新抗原来逃避T细胞的识别。
肿瘤浸润性淋巴细胞(TILs)疗法在多种癌症类型中取得了持久的疗效,但其治疗抵抗机制尚不清楚。TILs疗法通过扩增患者肿瘤组织中的T细胞并重新输注到体内,以增强抗肿瘤免疫反应。然而,许多患者对TILs疗法无反应,或在短暂缓解后出现疾病进展。因此,深入理解TILs治疗抵抗的机制对于优化这种疗法至关重要。
近日,国际权威期刊Nature Cancer上在线发表了题为“Impaired T cell and neoantigen retention in time-serial analysis of metastatic non-small cell lung cancer in patients unresponsive to TIL cell therapy”的最新研究成果。该研究对接受TILs治疗的非小细胞肺癌(NSCLC)患者进行了时间序列的肿瘤和血液样本分析。通过T细胞受体(TCR)测序和单细胞RNA测序,研究者们发现,对TILs治疗无反应的患者中,肿瘤反应性T细胞克隆型表现出功能失调的程序,并且缺乏干细胞样特征。此外,随着时间推移,外周血中抗原反应性T细胞克隆型的衰减与疾病进展相关。进一步分析发现,TILs治疗后进展的肿瘤中,先前被输注T细胞靶向的亚克隆新抗原(neoantigen)消失,提示可能存在适应性耐药机制。这些发现表明,靶向克隆抗原并克服功能失调状态对于TILs治疗的临床反应至关重要。

研究纳入了16名接受TILs治疗的NSCLC患者,这些患者在使用nivolumab治疗后出现疾病进展。通过对基线肿瘤样本进行全外显子组测序、转录组测序和蛋白质组学分析,研究者发现,与临床受益(CB)组相比,无受益(NB)组患者的肿瘤表现出细胞骨架重塑、细胞黏附、细胞外基质产生和成纤维细胞迁移等通路的上调,这可能表明这些肿瘤具有更强的排斥T细胞浸润的能力。此外,CB组患者的肿瘤中,DNA损伤、细胞周期和免疫反应通路在转录组和蛋白质组水平上均显著上调。
研究者利用TCR测序技术,结合功能扩展的T细胞和新抗原负载的四聚体分选T细胞,鉴定出肿瘤抗原特异性TCR。通过单细胞TCR和RNA测序,研究者发现,对TILs治疗无反应的患者中,肿瘤反应性克隆型表达功能失调程序,并且缺乏干细胞样特征。此外,随着时间推移,外周血中抗原反应性T细胞克隆型的衰减与疾病进展相关。进一步分析发现,TILs治疗后进展的肿瘤中,先前被输注T细胞靶向的亚克隆新抗原消失,提示可能存在适应性耐药机制。
通过对16名患者的TILs进行单细胞RNA测序,研究者发现,对TILs治疗有反应的患者中,肿瘤反应性T细胞克隆型广泛分布于多种CD4+和CD8+ T细胞亚群中,而无反应的患者中,肿瘤反应性T细胞克隆型主要集中在CD8+效应T细胞亚群中。此外,对TILs治疗有反应的患者中,肿瘤反应性T细胞克隆型表达与记忆T细胞相关的基因,如IL7R、CXCR3和CXCR6,而无反应的患者中,肿瘤反应性T细胞克隆型表达与耗竭T细胞相关的基因,如LAG3和TIGIT。
通过对TILs治疗后进展的肿瘤进行全外显子组测序,研究者发现,与基线肿瘤相比,进展肿瘤中发生了显著的突变变化,中位数为每患者77.5个突变差异。此外,研究者发现,进展肿瘤中,先前被输注T细胞靶向的新抗原大多消失,这表明TILs治疗可能对肿瘤施加了免疫选择压力,导致肿瘤细胞通过丢失新抗原来逃避T细胞的识别。
综上所述,该研究揭示了TILs治疗抵抗的潜在机制,包括肿瘤反应性T细胞的功能失调、外周血中抗原反应性T细胞克隆型的快速衰减,以及肿瘤细胞通过丢失新抗原来逃避T细胞的识别。这些发现为优化TILs疗法提供了新的思路,例如通过选择靶向克隆抗原的T细胞、增强T细胞的持久性和功能,以及开发新的策略来克服肿瘤的免疫逃逸机制。未来的研究可以进一步探索这些机制在其他癌症类型中的作用,并开发新的生物标志物来预测TILs治疗的反应和耐药性。
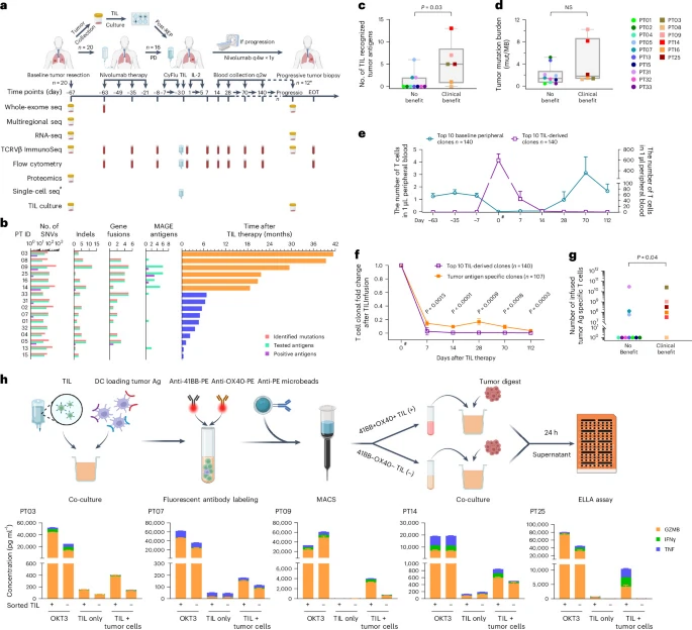
图 NSCLC的TIL过继疗法试验概述
原始出处:
Impaired T cell and neoantigen retention in time-serial analysis of metastatic non-small cell lung cancer in patients unresponsive to TIL cell therapy. Nat Cancer. 2025 May 8. doi: 10.1038/s43018-025-00946-x. Epub ahead of print. PMID: 40341231.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#TILs#肿瘤浸润性淋巴细胞(TILs)疗法在多种癌症类型中取得了持久的疗效,但其治疗抵抗机制尚不清楚。
18
#非小细胞肺癌# #T细胞# #肿瘤浸润性淋巴细胞(TILs)疗法#
18