卡非佐米为基础的三药和四药方案治疗新诊断多发性骨髓瘤的现状和未来
2025-07-20 聊聊血液 聊聊血液 发表于上海
KRd三药方案的数据及联合CD38单抗的四药方案数据整理如下。相信随着更多证据的积累,KRd方案及其四药方案可能会在未来欧洲和更多指南中被推荐用于NDMM患者。
近年来,新诊断多发性骨髓瘤 (NDMM) 的治疗进展迅速,目前的标准治疗 (SOC) 不仅包括蛋白酶体抑制剂 (PI)、免疫调节剂和类固醇,也包括四药组合,在三药方案骨架中加入抗 CD38 单克隆抗体艾沙妥昔单抗(Isa) 或达雷妥尤单抗 (D)。除广泛使用的硼替佐米-来那度胺-地塞米松 (VRd) 联合方案外,还可以考虑二代 PI 卡非佐米 (K) 联合来那度胺-地塞米松 (KRd)。在适合移植的 NDMM 患者中,NCCN指南将 KRd 三药方案作为推荐方案,将 Isa-KRd 或 D-KRd 四药方案作为额外选择。
目前使用 KRd 作为 NDMM 患者一线治疗已有很多证据,也有多项研究在研究CD38单抗-KRd 四药方案,并揭示了Isa‐KRd和D‐KRd的深度和持久缓解,包括微小残留病(MRD)阴性。重要的是,在高危 NDMM 人群中也证实了有获益。对于部分患者,基于 KRd 的联合治疗可能是 VRd 的合适替代方案。通过适当的患者选择、缓解安全性问题的步骤和确立最佳给药方案,可能有助于确定基于 KRd 的四药方案作为额外SOC。
KRd三药方案的数据及联合CD38单抗的四药方案数据整理如下。相信随着更多证据的积累,KRd方案及其四药方案可能会在未来欧洲和更多指南中被推荐用于NDMM患者。
KRD三药方案治疗NDMM的疗效和安全性
适合移植(Te)和不适合移植(Ti)NDMM患者中KRd单臂研究的疗效
初步研究探索了KRd方案在适合移植(Te)和不适合移植(Ti)的NDMM患者中的疗效(图1)。这些研究包括由多发性骨髓瘤研究联盟(MMRC;n=53)开展的I/II期试验,以及美国国立卫生研究院(NIH)内设的国家癌症研究所(NCI/NIH;n=45)开展的II期试验。MMRC试验的II期研究对KRd方案进行了长达24个周期的延长治疗。在意向治疗(ITT)人群中,4个周期后达到近完全缓解或更好(≥nCR)的比例为38%。中位随访时间为13个月,中位无进展生存期(mPFS)尚未达到。
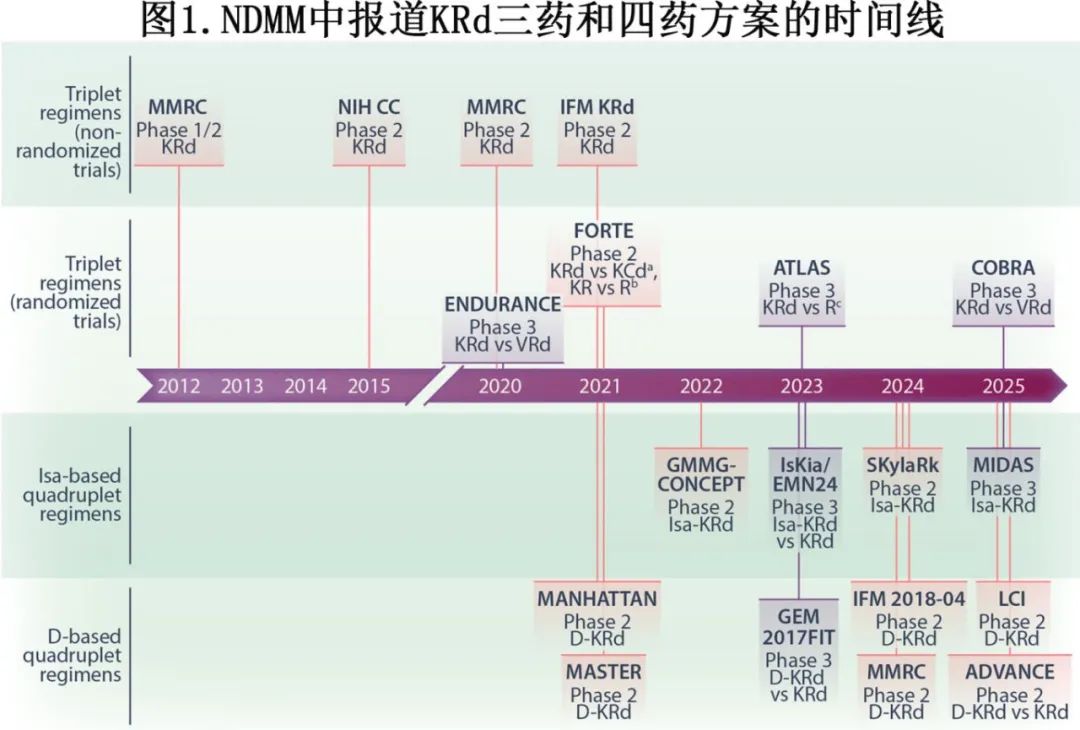
在NCI/NIH试验中,患者接受8个周期的KRd治疗,并可选择进行干细胞采集。具体而言,在接受4个周期的KRd治疗后,患者可以选择进行采干并延迟移植,此后再接受额外的4个周期的KRd治疗,随后进行为期2年的来那度胺维持治疗。长期随访(中位随访时间为5.2年)显示,mPFS为67.3个月。2015年NCI/NIH试验结果发表后,NCCN指南基于2A类证据将KRd方案纳入NDMM的治疗推荐。
单纯Te NDMM患者中KRd单臂研究的疗效
另外两项单臂、II期试验分别由多发性骨髓瘤研究联盟(MMRC;n=76)和法语区骨髓瘤研究组(IFM;n=48)开展,仅纳入接受自体干细胞移植(ASCT)的Te NDMM患者。在这两项试验中,诱导治疗和巩固治疗均包括4个周期的KRd治疗。MMRC试验的中位随访时间为56个月,mPFS尚未达到;IFM-KRd研究的中位随访时间为60.5个月,mPFS为56.4个月。在这两项试验中,接受8个周期的KRd诱导/巩固治疗后,≥60%的可评估患者达到主要终点,即严格意义的完全缓解(sCR)。在MMRC研究中,患者还接受了10个周期的KRd维持治疗,达到至少非常好的部分缓解(≥VGPR)作为最佳总缓解的比例为91%,5年PFS为72%。
在NDMM患者中比较KRd与VRd方案的研究
部分基于早期试验的令人鼓舞的结果,KRd方案在ENDURANCE III期随机、多中心研究中与VRd方案进行了头对头比较,纳入Ti NDMM患者或不计划立刻ASCT的Te NDMM患者(n=1087);排除具有高危细胞遗传学特征的患者。尽管在接受36周诱导治疗后,KRd组达到≥VGPR的患者比例显著高于VRd组,但在意向治疗(ITT)人群中,两组在主要终点mPFS或其他关键疗效终点上并无显著差异。然而,ENDURANCE研究的一些设计方面可能并非最佳,包括相对较短的随访时间(中位9个月)以及在研究中途增加计划招募的患者数量后才将PFS设为主要终点。此外,部分患者在疾病进展前更换治疗方案但仍被视为保持原始治疗方案组,可能会出现截尾偏倚。在一项亚组分析中,当将治疗方案更换视为事件时,KRd组的无事件生存期显著优于VRd组。
COBRA III期试验(NCT03729804)的结果将进一步帮助确定KRd方案与VRd方案在一线治疗中的效益。在COBRA试验中,Ti或移植延迟的Te NDMM患者(n=250)被随机分配接受24个周期的KRd治疗,或接受历史标准的8个周期的VRd治疗,随后进行16个周期的来那度胺维持治疗。预计2025年7月将公布12个月时的MRD率,这是第一个共同主要终点。
在近期的单中心、回顾性、真实世界研究中,也对KRd方案与VRd方案的效益进行了评估。一项在2015年至2022年期间在美国纽约纪念斯隆·凯特琳癌症中心(MSKCC)开展的研究,比较了接受早期或延迟ASCT的NDMM患者(n=389)接受KRd方案与VRd方案的治疗效果。尽管两组的mPFS均未达到,但KRd组的5年PFS显著高于VRd组(67% vs. 56%;P=0.027)。与VRd方案相比,KRd方案在诱导治疗后的≥CR率以及≥VGPR率也显著更高。然而,在另一项研究中,2016年至2018年期间在美国德克萨斯州休斯顿的MD安德森癌症中心,对121例高危Te NDMM患者(高危定义为del(17p)、t(4;14)、t(14;16)或1q21扩增/获得)在接受三药诱导治疗前进行了评估,KRd组(38.2个月)与VRd组(45.9个月)的mPFS并无统计学差异(P=0.25)。
Te NDMM患者中KRd方案随机研究的疗效
ENDURANCE试验的结果存在一定的争议,这也导致KRd方案未被推荐作为NDMM患者的一线治疗选择。但前述单臂研究以及随机研究的结果还是支持KRd方案在NDMM治疗中的应用。总体而言,这些研究中KRd方案带来了深度且持久的缓解,在某些情况下,mPFS在相对较长的随访时间后仍未达到(表1)。

FORTE II期随机试验(n=474)研究了KRd方案在Te NDMM患者中的诱导治疗和巩固治疗。接受ASCT的患者接受4个周期的诱导治疗和4个周期的巩固治疗,治疗方案为两种基于卡非佐米的疗法之一,即KRd或卡非佐米-环磷酰胺-地塞米松(KCd)。在接受ASCT的患者中,中位随访时间为50.9个月,KRd组的mPFS尚未达到,而KCd组为53个月。ITT人群中,诱导治疗后达到≥VGPR的主要终点在KRd组达到70%,而KCd组为53%(比值比[OR]:2.14;P=0.0002)。当在ITT患者中评估1年持续MRD阴性(多参数流式细胞术;10⁻⁵截止值)的比例时,与仅接受12个周期KRd治疗而不进行ASCT的患者(35%)相比,接受KRd联合ASCT治疗的患者(47%)显示出显著的获益(OR:1.69;P=0.024)。KRd诱导/巩固治疗的疗效优势也扩展到了高危患者。
KRd维持治疗的数据来自FORTE研究,以及III期ATLAS研究的中期分析。在FORTE研究中,306名患者在巩固治疗后进行了第二次随机分配,结果显示,与单独使用来那度胺相比,KR维持治疗的疗效更优(3年PFS:KR组为75%,来那度胺组为65%;风险比[HR]:0.64;P=0.023)。无论细胞遗传学风险如何,KR与来那度胺相比的维持PFS获益均一致,且标危患者(HR:0.56)和高危患者(HR:0.67;交互P值:0.70,高危定义为del(17p)、t(4;14)、t(14;16))之间的HR值相似。基于FORTE维持治疗的数据,研究者对ATLAS进行了中期分析,在接受ASCT的Te NDMM患者(n=180)中, 最多36个周期的KRd维持治疗对比来那度胺维持治疗。对于6个KRd周期后达到MRD阴性的患者,后续治疗方案降级为来那度胺,直至完成方案指导的维持治疗。中期分析显示,与来那度胺(41.4个月)相比,从KRd开始维持治疗的患者的主要终点mPFS有显著改善(59.1个月;HR:0.51;P=0.012)。
KRd的安全性
在KRd方案的研究中,报告的最常见的≥3级级不良事件(AE,≥20%)主要是血液学事件和感染(表1)。与VRd方案相比,KRd方案与更高的心血管事件发生率相关。在ENDURANCE研究中,对治疗相关的心脏、肺部和肾脏不良事件进行了综合评估,结果显示,KRd组3至5级事件的发生率显著高于VRd组(16% vs. 5%;P<0.0001)。同样,在MSKCC对这些三药方案进行的真实世界比较中,KRd组所有级别的肺部和心血管不良事件的发生率显著高于VRd组(21% vs. 9%;P<0.01),并且KRd组≥3级肺部和心血管不良事件的发生率也更高(8% vs. 5%;P=0.15)。在该研究中,由于不良事件导致的治疗中断率在KRd组低于VRd组。值得注意的是,之前在每次给予卡非佐米时进行静脉(IV)水化的做法导致了心力衰竭发生率的增加。除非存在肿瘤溶解高风险,否则不再建议同时使用静脉输液。为了降低心血管和肺部毒性,可以采取的进一步措施包括基线和重复进行心脏超声检查、降低检查B型利钠肽的阈值、控制血压以及适当选择患者,其中年龄超过75岁是一个心血管风险因素。
接受含硼替佐米方案治疗的患者中,周围神经病变(PN)的发生率高于接受含卡非佐米方案治疗的患者。NCI/NIH的KRd研究将≥3级神经病变的发生率作为主要终点进行评估。在中位随访时间为17.3个月时,未报告3至4级PN事件。在III期ENDURANCE研究中,作为≥3级治疗相关不良事件(TEAE)的PN发生率在KRd组低于1%,而在VRd组为8%。
由于VRd或KRd的安全性特点,某些患者群体可能更适合VRd或KRd方案。为了提高耐受性和减轻治疗负担,可以采用调整后的卡非佐米和硼替佐米给药方案(图2)。
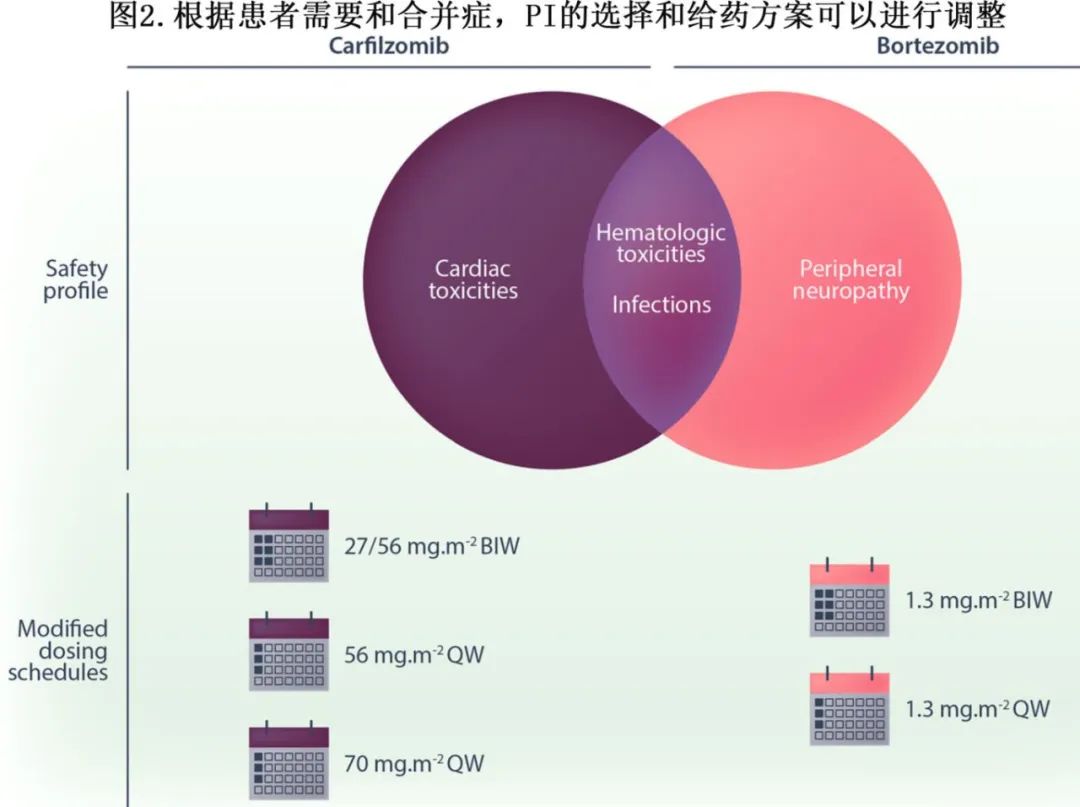
KRd方案研究中的卡非佐米剂量
在NDMM中探索KRd方案的初期I/II期MMRC试验中,使用的卡非佐米方案为诱导周期每4周一次,前3周每周两次;该研究中使用的卡非佐米剂量为20、27或36 mg/m²。随后,在KRd方案的II期试验中,诱导治疗采用每周两次36 mg/m²的卡非佐米给药方案。对于包含KRd巩固治疗的KRd三药方案研究,巩固治疗期间的卡非佐米剂量与诱导治疗相同。
NDMM中KRd联合CD38单抗的疗效和安全性
基于KRd三药方案的疗效和安全性,近期NDMM试验研究了将KRd作为抗CD38单克隆抗体四药方案的治疗基础。越来越多的研究关注于缓解深度,特别是MRD阴性,并构成许多试验的主要终点。MRD阴性的预后价值超过CR,持续MRD阴性与最良好的预后相关。此外,部分试验采用了根据反应调整治疗(response‐adapted)的设计,即根据MRD状态在不同治疗阶段做出决策。
表2总结了以KRd为基础的抗CD38四药方案在NDMM患者中的部分试验,其中两项研究专门针对高危患者。大多数试验仅纳入Te NDMM患者,包括Isa-KRd的III期IsKia/EMN24和MIDAS试验。另外两项试验纳入NDMM患者不考虑是否适合移植,另外两项试验主要纳入Te NDMM患者,少数为Ti NDMM患者。D-KRd的III期GEM2017FIT试验仅纳入Ti NDMM患者。

对于Isa-KRd或D-KRd,目前没有任何试验达到mPFS,包括两项中位随访时间超过4年的研究。这些不同的试验报告了深度和持久的缓解,包括MRD阴性(表2)。对于许多试验,随访正在进行中。纳入Te NDMM患者的D-KRd vs KRd的II期ADVANCE试验(预期入组人数:n=306)也在进行中。
在Te NDMM患者中CD38单抗-KRd四药方案的疗效
Isa-KRd
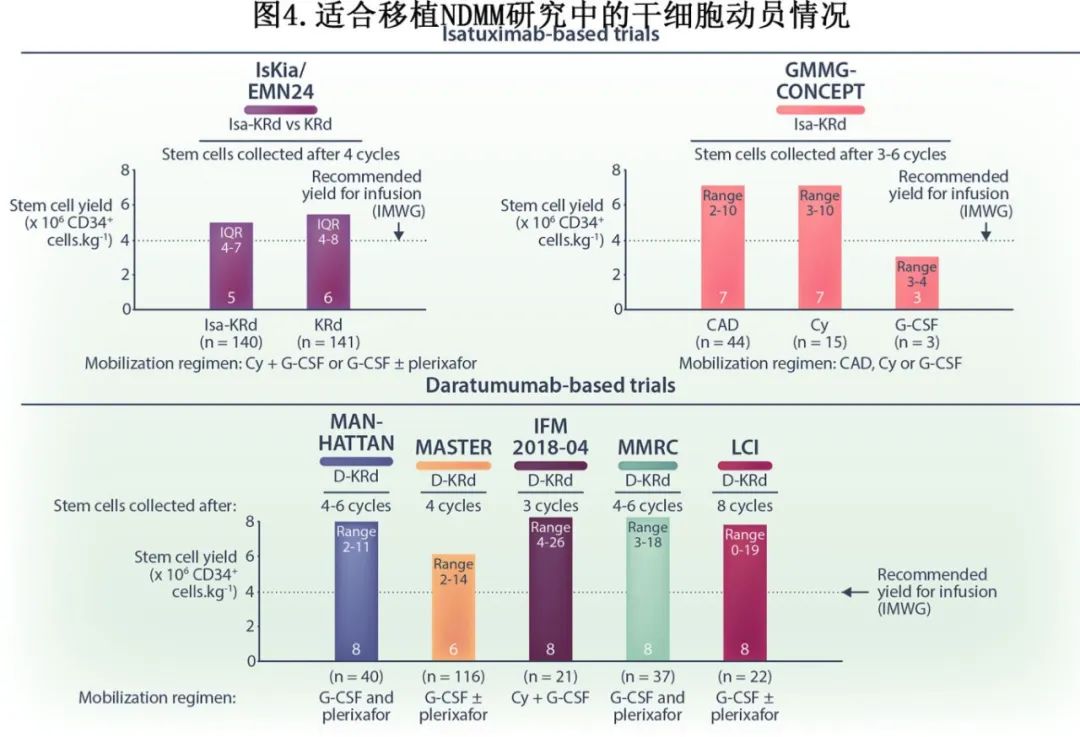
IsKia/EMN24是首个以KRd为抗CD38四药方案基础的III期随机试验,纳入Te NDMM患者中开展。年龄小于70岁的患者(n=302)被随机分配至Isa-KRd或KRd组;每组患者接受4个周期的诱导治疗,随后进行ASCT,4个周期的四药巩固治疗,12个周期的轻度巩固治疗,以及可选的来那度胺维持治疗。在中位随访时间为21个月时,ITT患者中巩固治疗后MRD阴性(NGS;灵敏度10⁻⁵)的主要终点得以实现,Isa-KRd组的比率达到77%,显著高于KRd组的67%(OR:1.67;P=0.049)。在10⁻⁶灵敏度下,Isa-KRd组的MRD阴性率也高于KRd组(67% vs. 48%;OR:2.29;P<0.001)。无论细胞遗传学风险如何,Isa-KRd与KRd相比的MRD阴性获益均一致,在10⁻⁵(标危OR:1.70;高危OR:2.30;交互P值:0.66,高危定义为del(17p)、t(4;14)、t(14;16))和10⁻⁶(标危OR:2.10;高危OR:4.95;交互P值:0.20)灵敏度下,OR值也相似。预先计划的分析显示,在IsKia/EMN24的大多数患者中,干细胞采集是可行的,两组治疗在采集的干细胞数量上没有显著差异;所有接受移植的患者均成功实现造血重建。
正在进行的III期IFM2020-02 MIDAS试验纳入Te NDMM患者,采用基于MRD调整的巩固和维持治疗方案,将患者分为四组;该研究是迄今为止规模最大的Isa-KRd试验(n=791),所有患者接受六个周期的Isa-KRd诱导治疗。诱导治疗后,标危患者(MRD < 10⁻⁵ [NGS])按1:1随机分配至巩固治疗,接受六个周期的Isa-KRd(A组)或ASCT联合两个周期的Isa-KRd(B组);A组和B组随后接受为期3年的来那度胺维持治疗。高危患者(MRD > 10⁻⁵ [NGS])按1:1随机分配至巩固治疗,接受ASCT联合两个周期的Isa-KRd(C组)或串联ASCT(D组);C组和D组随后接受为期3年的维持治疗,使用艾沙妥昔单抗和Cereblon E3连接酶调节药物Iberdomide。主要终点包括从诱导治疗后基线到巩固治疗结束、1年、2年和3年的MRD阴性率变化(NGS;10⁻⁶)。诱导治疗后的中期分析显示,患者缓解深度良好,包括在六个Isa-KRd周期后,ITT患者中≥VGPR率达到92%,以及较高的MRD阴性率(10⁻⁵为63%,10⁻⁶为47%)。
GMMG-CONCEPT II期研究仅纳入高危人群,定义为国际分期系统(ISS)II期或III期,伴以下一项或多项:≥10%纯化细胞中存在del(17p)、t(4;14)、t(14;16)和/或≥4(后改为≥3)个1q21拷贝(1q21扩增)。ITT人群中主要由Te高危NDMM患者组成(也包括21%的高危Ti NDMM患者)。接受ASCT的Te NDMM患者接受六个Isa-KRd诱导周期,随后进行大剂量化疗联合ASCT,四个Isa-KRd巩固周期,以及最多26个Isa-KR维持周期。接受ASCT的Te NDMM患者(ITT:n=99)取得较高的缓解率。在诱导治疗后可评估的Te NDMM患者中,65%实现MRD 阴性(10⁻⁵;NGS),并且随着时间的推移持续加深。GMMG-CONCEPT达到其主要终点,在巩固治疗后,68%的ITT患者实现MRD阴性(10⁻⁵;NGS)。当对第一个GMMG-CONCEPT队列的结果进行评估时(随访时间≥4年),Isa-KRd在大多数患者中维持MRD阴性:84%的Te NDMM患者实现MRD阴性,其中80%的患者维持≥1年的MRD阴性。这一长期随访还显示,在开始治疗6年后,Te NDMM患者的mPFS仍未达到。GMMG-CONCEPT中的高危患者人群反映出未满足的需求,该试验的结果将艾沙妥昔单抗的获益扩展到高危NDMM。此外,当一种方案在高危人群中有效时,其结果也可以认为可以转化到标危人群。由于高危患者与标危患者相比,进展事件的发生率更快,因此高危人群的结果可以代表适合整个人群。
在SKylaRk II期研究中,Te NDMM患者(n=50)接受早期或延迟ASCT。早期ASCT组接受四个Isa-KRd诱导周期,随后进行ASCT和Isa-KRd巩固治疗;延迟ASCT组接受八个Isa-KRd诱导周期。维持治疗包括Isa-KR(对于高危和/或MRD阳性患者)或来那度胺(对于标危和/或MRD阴性患者)。主要终点为诱导治疗后的≥CR,这一目标在32%的患者中实现,并且随着时间的推移,缓解率(≥CR和≥VGPR)不断加深。在前4个 Isa-KRd 诱导周期后达到≥VGPR的可评价患者中,62%达到MRD-(NGS;10-5),8个周期后达72%。在对推迟 ASCT 的患者进行的细胞遗传学风险分析中(中位随访时间35.9个月),所有患者的3年 PFS 为80%,无高危染色体异常 (HRCA;n=20) 的患者为90%,具有1个 HRCA 的患者为83%(n = 16),具有2个 HRCA 的患者无法评估 (n=5)。
D‐KRd
在MASTER II期研究中,Te NDMM患者(n=123)接受4个周期的D-KRd诱导治疗,随后进行ASCT和基于MRD调整的D-KRd巩固治疗。连续两次MRD阴性(10⁻⁵;NGS)的患者进入无治疗观察期(MRD监测[MRD-SURE]);未达到此标准的患者接受来那度胺维持治疗。在ITT人群中,诱导治疗后MRD阴性率(10⁻⁵;NGS)为38%,而在整个研究期间的MRD阴性率(10⁻⁵;NGS)(主要终点)为81%。在这一包含所有风险水平的患者群体中,根据MRD调整D-KRd巩固治疗是可行的,71%的患者达到MRD-SURE。在进入MRD-SURE的患者中,停止治疗后24个月的累积进展发生率,在无高危细胞遗传学异常(HRCA)的患者中为9%,有1个HRCA的患者中为9%,有≥2个HRCA的患者中为47%。
IFM 2018-04 II期研究在Te NDMM高危人群(n=50)评估D-KRd方案和串联移植,高危定义为存在del(17p)、t(4;14)和/或t(14;16)。患者接受6个周期的D-KRd诱导治疗,随后进行首次ASCT,4个周期的D-KRd巩固治疗,第二次ASCT,以及2年D-R维持治疗。完成第二次移植的患者比例(72%)超过设定的70%可行性阈值,这一阈值被用来定义主要终点的达成。对D-KRd诱导治疗有深度反应:在ITT人群中,MRD阴性率(NGS)在10⁻⁵灵敏度下为64%,在10⁻⁶灵敏度下为62%。
在Levine癌症研究所(LCI;美国北卡罗来纳州)一项单中心II期研究(NCT04113018)中,39例Te或Ti NDMM患者接受8个周期的D-KRd诱导治疗,随后的治疗根据ASCT资格和MRD状态进行调整。主要终点为诱导治疗后达到≥CR的比例,54%的患者实现。由于这一比例低于预设的70%阈值,研究被认为未达到其主要终点(P=0.375)。诱导治疗后MRD阴性的患者接受来那度胺维持治疗,其中78%的患者实现持续≥12周期的MRD阴性。在诱导治疗后MRD阳性的患者中,Te患者(n=8)接受ASCT,其中63%的患者在ASCT后实现MRD阴性(10⁻⁵;MRD持续阳性的患者可接受最多12个周期的KRd巩固治疗),而Ti的患者(n=4)接受最多12个周期的KRd巩固治疗,但在开始巩固治疗1年后没有患者实现MRD阴性。
D-KRd方案在Ti NDMM患者中的疗效:GEM2017FIT
GEM2017FIT是一项III期西班牙试验,纳入Ti NDMM老年fit患者。fit患者定义为血液学老年评估(GAH)量表评分≤42分(量表范围:0-94;评分越低表示体能状态越好)。患者随机分为三组,诱导治疗方案分别为:(i)D-KRd(18个周期),(ii)KRd(18个周期),(iii)硼替佐米-马法兰-泼尼松(VMP;9个周期)序贯Rd(9个周期)。KRd和VMP-Rd组接受四个D-Rd巩固治疗周期;最后,MRD阳性或MRD阴性患者分别接受D-R或观察作为维持治疗。目前已公布诱导治疗的结果。在ITT人群中,通过NGF检测,10⁻⁵灵敏度下D-KRd组和KRd组分别有61%和54%的患者达到MRD阴性。在可评估人群中,GEM2017FIT的主要终点显示,D-KRd组和KRd组分别有84%和75%的患者达到MRD阴性。按GAH量表评分(<20 vs. ≥20)分层的患者中,结果也相似。GAH量表评分≥20的D-KRd治疗患者30个月的PFS较低(71%),而GAH量表评分<20的患者为88%。因毒性或毒性相关死亡而停药的患者中,D-KRd组和KRd组分别有67%和40%为GAH量表评分≥20。这些发现表明,D-KRd四药方案可能更适合较体健的老年患者,而不是较衰弱的老年患者。
在不考虑移植资格的NDMM患者中D-KRd方案的疗效
MANHATTAN是D-KRd在NDMM中关键的II期研究之一。在这项研究中,41例NDMM患者接受最多8个周期的D-KRd诱导治疗,未进行大剂量化疗和ASCT。随后的治疗为方案外治疗,包括SOC治疗,联合或不联合早期ASCT,以及维持治疗。在≤8个周期的D-KRd诱导治疗后,报告的MRD阴性率(MFC;10⁻⁵;ITT)为71%,超过研究设定的40%的主要终点。在个体患者层面,临床反应随时间加深。MANHATTAN研究的结果促成了D-KRd方案被纳入NCCN指南的NDMM治疗。
另一项II期研究(NCT03500445)评估了不进行移植,该研究在美国的多发性骨髓瘤研究联盟(MMRC)站点纳入42名NDMM患者(不考虑是否适合移植)。在这项研究中,患者接受24个周期的D-KRd治疗,而没有进行ASCT。在ITT人群中,经过八个周期后,MRD阴性率(NGS)在10⁻⁵水平为59%,在10⁻⁶水平为35%,并且主要终点(sCR和/或MRD阴性;10⁻⁵;NGS)在75%的患者中得以实现。随着四药联合治疗的持续进行,患者的缓解进一步加深,MRD阴性率(NGS)在10⁻⁵水平增加到65%,在10⁻⁶水平增加到53%。
CD38单抗-KRd四药方案的安全性
抗CD38-KRd四药方案耐受性良好;常见AE包括血液学事件和血栓栓塞事件,以及感染和高血压(表2)。Isa-KRd方案的临床试验报告了可控的不良事件,其安全性与既往报告相似,进一步强化了该联合方案的获益风险比。同样,向KRd方案中添加达雷妥尤单抗也耐受性良好,其安全性数据与已知研究药物的安全性一致。在D-KRd方案的研究中,IFM 2018-04报告了一例与卡非佐米相关的2级心力衰竭,该事件可逆;MMRC研究则报告了一例导致卡非佐米停药的血栓性微血管病。
CD38单抗-KRd四药方案中的卡非佐米剂量
每周和每周两次给药的卡非佐米和硼替佐米均观察到相似的PFS。每周56 mg/m²卡非佐米的疗效和安全性已在一项RRMM患者的III期试验中得到证实,该试验中接受KRd方案的患者每周56 mg/m²的卡非佐米不劣于每周两次27 mg/m²,以及一项纳入Te NDMM患者的II期试验中接受卡非佐米-沙利度胺-地塞米松三药方案的患者中也得以证实。这一卡非佐米方案已用于大多数NDMM CD38单抗-KRd四药方案的试验(图3)。在所有四项Isa-KRd试验以及MANHATTAN、MASTER和单中心LCI D-KRd II期试验中,诱导治疗步骤均包括每周56 mg/m²的卡非佐米。除了MANHATTAN试验外,所有这些试验均包含巩固治疗,且同样规定使用每周56 mg/m²的卡非佐米。

在三项Isa-KRd试验中,在巩固治疗后从每周给药转变为每两周给药一次。在IsKia/EMN24中用于KRd轻度巩固治疗以及在SKylaRk中用于KR维持治疗时,每两周一次的卡非佐米剂量保持在56 mg/m²。在GMMG-CONCEPT中用于KR维持治疗时,每两周一次的卡非佐米剂量增加至70 mg/m²。在D-KRd试验中,GEM2017FIT、IFM 2018-04和MMRC研究均以每周两次36 mg/m²的卡非佐米起始。在GEM2017FIT中,从第3至18周期的诱导治疗余下阶段调整为每周两次56 mg/m²的卡非佐米;在IFM 2018-04中,巩固治疗采用每周56 mg/m²的卡非佐米;在MMRC研究中,巩固治疗采用每两周给药的每周两次36 mg/m²卡非佐米。
干细胞动员
高达75%的动员后的CD34+造血祖细胞表达CD38,因此可能存在关于抗CD38单克隆抗体暴露是否可能影响干细胞动员和植入的问题。近期试验的数据表明,在接受抗CD38单克隆抗体-KRd四药方案治疗的大多数NDMM患者中,干细胞采集是可行的(图4),尽管中位干细胞产量可能取决于目标CD34+剂量、采干过程中处理的总血量以及是否使用普乐沙福或化疗动员。应在诱导治疗早期对有反应的患者进行采干,最好是在3至4个周期后。
总结
KRd方案已确立为一种有效的治疗方案,与抗CD38单克隆抗体联合使用时,在包括高危患者在内的多项NDMM临床试验中均显示出疗效获益。在III期试验中,Isa-KRd方案在NDMM中实现了迄今为止最深度的缓解,包括高比例的MRD阴性。在IsKia/EMN24 ITT人群中,巩固治疗后仅经过八个Isa-KRd周期,MRD阴性率(10⁻⁵)就达到77%,其中Isa-KRd组67%实现更深度的MRD反应(10⁻⁶灵敏度)。MIDAS的初步数据揭示,在诱导治疗后,ITT患者中63%实现MRD阴性(10⁻⁵)。III期试验结果与Isa-KRd的II期试验一致。
对于D-KRd方案,II期研究发现,在接受≤8个周期治疗的MANHATTAN ITT人群中,MRD阴性率(10⁻⁵)为71%,并且在MMRC试验(NCT03500445)中,随着治疗的持续进行,缓解进一步加深。这与GEM2017FIT III期研究在体健老年患者中的数据一致,该研究显示在18个诱导周期后,ITT患者的MRD阴性率(10⁻⁵)为61%。此外,MASTER试验成功实施了基于MRD调整的D-KRd巩固治疗策略,结果显示在治疗期间任何时间点,ITT人群中MRD阴性率(10⁻⁵)为81%,并且从诱导治疗后的≥VGPR率88%增加到MRD引导的巩固治疗后的98%。
这些研究支持KRd为基础的四药方案作为NDMM治疗中的另一种SOC,并且持续使用卡非佐米治疗所带来的获益必须与患者的偏好、便利性和毒性相权衡。与其他推荐方案(如Isa-VRd和D-VRd)相比,可能从抗CD38-KRd四药方案中获得最强临床影响的患者群体包括有较高PN风险和高危细胞遗传学的患者。重要的是,在完全由高危患者组成的GMMG-CONCEPT人群中,接受Isa-KRd治疗并达到MRD阴性的患者中,80%随后实现≥1年的持续MRD阴性。在高危IFM 2018-04人群中,D-KRd方案也报告了缓解加深。这些II期结果得到了III期数据的支持,包括在极高危IsKia患者(≥2个高危细胞遗传学异常)中,Isa-KRd在巩固治疗后10⁻⁶灵敏度下的MRD阴性率为77%,而KRd为27%(比值比:9.05;95%置信区间,1.57–52.14)。
尽管KRd三药方案和抗CD38-KRd四药方案目前尚未纳入欧洲指南推荐用于NDMM治疗,但Isa-KRd和D-KRd方案最近已被纳入美国NCCN指南用于NDMM治疗。预计未来欧洲指南也会有类似的调整,尤其是因为许多关键试验都纳入了欧洲患者。这些推荐可能会导致这些联合方案更频繁地作为NDMM患者的一线治疗,其疗效可以通过纳入减轻安全问题的策略来最大化,包括建立最佳剂量和给药计划。更多关于不同人群中长期获益的证据将有助于未来关于这些联合方案在NDMM中批准的决策。
尽管由于部分研究(包括ENDURANCE)的相互矛盾的结果,KRd方案作为一线治疗的强效基础方案的认可花费了一定时间,但各种研究已清楚地证明了KRd为基础的方案的疗效、安全性和耐受性。这一证据基础应该能够继续加强,从而为未来的骨髓瘤治疗提供有价值的替代方案,供医生和患者选择。
参考文献
Landgren, O., Biran, N., O'Donnell, E.K., Mikhael, J., Weisel, K.C., Broijl, A., Usmani, S.Z., Moreau, P., Gay, F.M., Mina, R., Rodríguez-Otero, P., Jakubowiak, A.J. and Derman, B.A. (2025), Current and future role of carfilzomib-based quadruplet combinations as therapy for newly diagnosed multiple myeloma. HemaSphere, 9: e70178. https://doi.org/10.1002/hem3.70178

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#多发性骨髓瘤# #卡非佐米#
3 举报