ADC的“阿喀琉斯之踵”:耐药机制全解析
2025-07-18 小药说药 小药说药 发表于上海
抗体偶联药物(ADC)在癌症治疗中成效显著,但晚期患者易耐药,其机制可分为抗原表达变化、ADC 处理及有效载荷变化,为后续研究提供方向。
-01-
引言
抗体偶联药物(ADC)是一种利用单克隆抗体选择性靶向表达特定抗原的细胞,并递送细胞毒性有效载荷的新型药物,旨在最大限度地减少化疗药物的脱靶毒性。近年来,ADC在乳腺癌和其他恶性肿瘤中的成功试验表明,ADC可以有效地杀伤肿瘤细胞并限制毒性,在某些情况下可以取代传统的化疗。虽然这些药物取得了显著的成功,特别是在转移性环境中,但几乎所有接受ADC治疗的晚期患者都会产生耐药性。
潜在的耐药性机制可以根据抗体偶联药物的复杂结构进行分类。分为抗原表达的变化、ADC的处理以及有效载荷变化的临床前和临床耐药性机制。用这种方法对耐药性机制进行分类为未来的研究提供了方向,以进一步了解这些机制和药物开发的新靶点,从而扩大ADC的疗效。
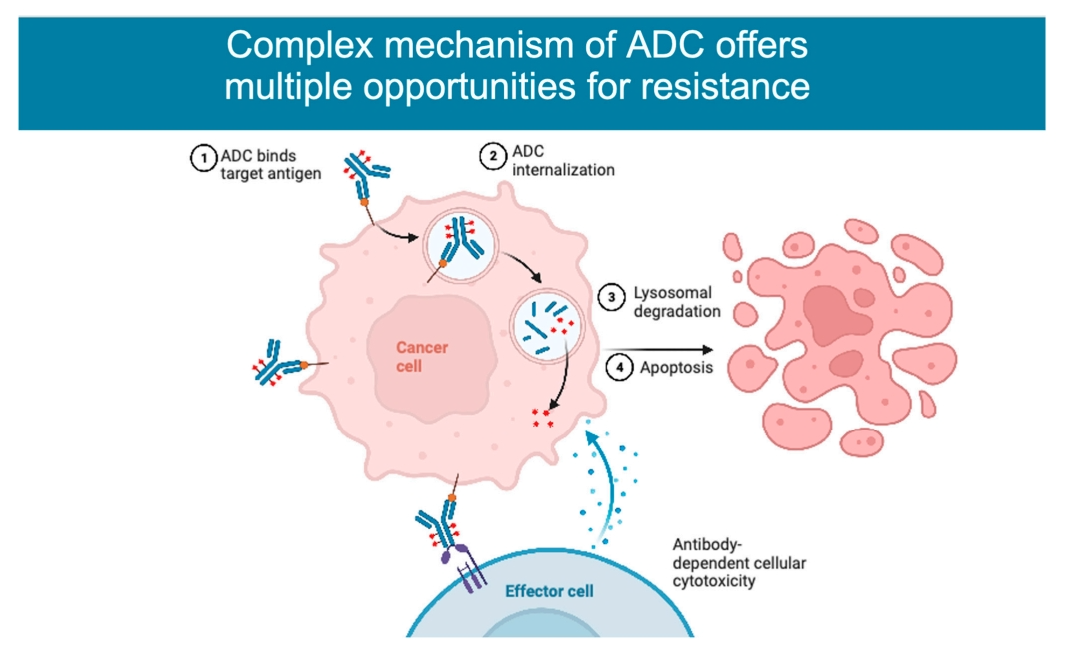
-02-
一、抗原表达的变化
在T-DM1的早期试验中,观察到HER2表达更高、更均匀的肿瘤更有可能对治疗产生反应。鉴于HER2可能具有相当异质性的表达,需要一致更高HER2表达的药物在HER2水平发生任何变化时都会遇到耐药性。
这一假设的进一步证据包括观察到HER2+肿瘤在治疗后表现出较低的HER2表达,并且更多的异质性表达与更高的复发率和更低的生存率相关。一项针对接受新辅助T-DM1和帕妥珠单抗治疗的早期HER2+乳腺癌患者的研究发现,治疗前存在的HER-2异质性与治疗反应呈负相关。在那些具有异质性预处理活检的患者中,没有患者获得病理学完全缓解(pCR),而55%的非异质性患者在T-DM1和帕妥珠单抗的联合作用下获得pCR。
除了异常的抗原表达水平外,抗原与另一个细胞表面受体的二聚化可能能够介导对ADC的耐药性。NRG-1β,一种已知可引发HER2/HER3异二聚化的配体,在HER2扩增的乳腺癌细胞系亚群中抑制了TDM-1的细胞毒性活性。这种耐药性可以通过添加帕妥珠单抗来克服,帕妥珠单抗是一种阻断HER2/HER3二聚化和下游信号传导的单克隆HER2抗体。TDM-1和Pertuzumab的组合在体外和体内肿瘤异种移植物研究中均显示出协同作用。
考虑到抗原异质性在介导ADC耐药性中的影响,未来解决这种耐药性的策略可能包括具有双重抗体的药物(双特异性ADC),以及增加抗原表达的联合疗法。
-03-
二、ADC的摄取和加工
另一种ADC耐药性的假说涉及细胞内摄取和加工的改变。ADC的复杂性,特别是与小分子相比,为出现耐药性提供了许多可能的机会。
一种提出的机制是由于一些屏障导致对细胞的渗透减少,如细胞基底膜的增加。另一个提出的机制来自最近的临床前研究,ADC确保特异性的一种机制是通过网格蛋白介导的在表达靶抗原的细胞中进行内吞摄取。在对T-DM1产生耐药性的N89-TM细胞系中,发现了另一种摄取机制,其中细胞使用小窝蛋白-1(CAV1)包被的囊泡,这可能导致效率降低。最近一项研究发现,肿瘤CAV1水平与T-DM1肿瘤摄取之间呈负相关。CAV1的遗传或药理学抑制增加了T-DM1的摄取,并在多种异种移植物模型中显示出与T-DM1的协同作用。
此外,还发现对T-DM1具有耐药的JIMT1-TM细胞系还显示包括Rab5B、ATG9a和HTT在内的蛋白质的增加,这些蛋白质介导溶酶体加工和囊泡的运输。在JIMT1-TM细胞系中,可裂解和不可裂解连接子的ADC在溶酶体中的共定位时间都比在亲本细胞中长。与亲本细胞相比,耐药性细胞系的连接子-有效载荷代谢产物都减少了。
-04-
三、有效载荷
一些观察到的耐药机制涉及有效载荷本身,并且可以通过使用具有替代有效载荷的ADC来克服。例如,对含有拓扑异构酶抑制剂有效载荷的ADC的耐药性可能是由拓扑异酶表达的变化或下游信号机制的变化驱动的。
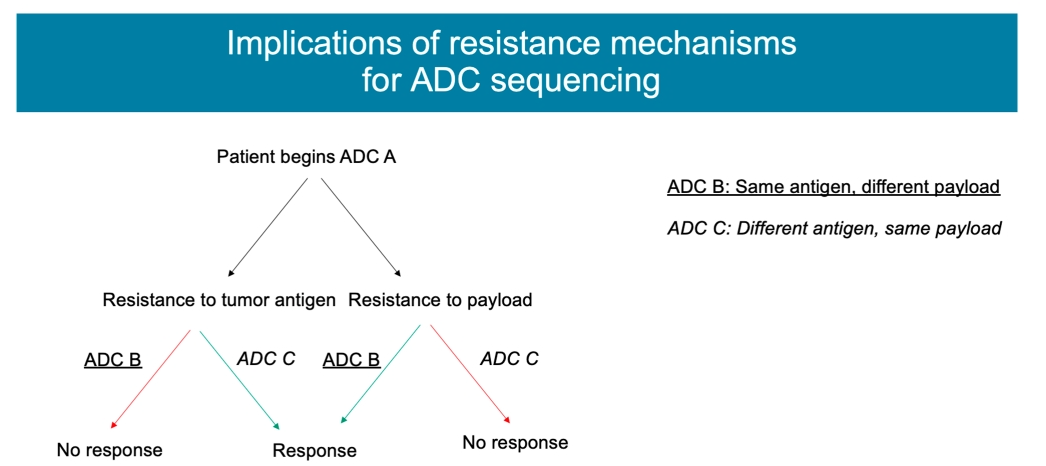
在非霍奇金淋巴瘤的肿瘤模型中观察到了这一点,其中将含有auristatin有效载荷的ADC改变为含有蒽环类有效载荷的ADCs导致对治疗的响应增加。类似地,在对T-DM1具有抗性的癌细胞中,这些细胞仍然对DS-8201a(T-DXd)敏感。
由ATP结合盒转运蛋白介导的ADC有效载荷的流出增加是另一种提出的耐药机制。与亲本细胞相比,转运蛋白在对T-DM1具有抗性的细胞中的表达增加,高达20-50倍。这是gemtuzumab ozogamicin(GO)耐药性的一种机制,编码ATP结合盒的ABCB1基因水平较低的患者对GO的反应有所改善。
-05-
结语
虽然ADC的广泛应用为患者提供了新的治疗选择,但大多数肿瘤最终会对这些药物产生耐药性。鉴于ADC的复杂性,针对ADC的不同组件都可能涉及不同的耐药机制。抗原表达减少、ADC运输和加工减少、对细胞毒性有效载荷的耐药性以及药物流出细胞的增加等机制都是潜在的靶向过程,可用于未来的药物开发。优化ADC的顺序治疗和联合治疗的研究有望为克服耐药提供更多的线索,并促进新的治疗选择,扩大这些疗法的临床疗效。
参考资料:
1.Mechanisms of Resistance to Antibody-Drug Conjugates. Cancers (Basel).2023 Feb 17;15(4):1278
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#抗体偶联药物# #耐药性机制#
9 举报