胰腺癌转移新机制,登上Nature!
2025-05-26 BioMed科技 BioMed科技 发表于上海
Nature 研究发现,PCSK9 驱动 PDAC 转移器官选择。低 PCSK9 细胞依赖肝内 LDL 胆固醇激活 mTORC1,高 PCSK9 细胞通过远端胆固醇合成抗铁死亡,调控转移至肝或肺。
PDAC如何转移缺乏清晰的机制研究
为了在远处生长,转移细胞必须克服次要器官独特的细胞和代谢组成所带来的主要挑战。胰腺导管腺癌(PDAC)是一种转移到肝脏和肺部的侵袭性疾病。转移性定植需要肿瘤细胞适应不同于原发部位的微环境,而肿瘤细胞的代谢可塑性是循环生存和适应新生态位的关键。同样,目标器官的代谢特征施加了选择性压力,只允许适应的细胞成长。PDAC经常转移到肝脏、肺、腹膜和淋巴结。此外,特定的靶器官与疾病进展相关,肺转移比肝脏或多位点转移具有更好的预后。然而,尽管有证据表明代谢重编程远离原发部位,但决定PDAC细胞在肝脏或肺部定植并在那里存活的能力的关键驱动因素仍未明确。
PCSK9驱动PDAC转移器官的选择
在这项研究中,加州大学旧金山分校Rushika M. Perera教授团队通过整合人PDAC细胞系的转移性数据、小鼠体内转移模型和基因表达相关性分析,发现PCSK9可以预测肝脏和肺部的转移后定植。PCSK9负向调节低密度脂蛋白(LDL)-胆固醇的输入,因此PCSK9低的PDAC细胞优先定植于富含LDL的肝组织。低PCSK9肝细胞摄取的低密度脂蛋白胆固醇支持促生长mTORC1在溶酶体上的激活,并通过转化为信号氧甾醇24(S)-羟基胆固醇,重新编程微环境以释放邻近肝细胞的营养物质。相反,PCSK9高的肺促生PDAC细胞依赖于远端胆固醇合成途径的转录上调来产生保护作用,防止铁死亡。增加PCSK9的量能够将嗜肝细胞重定向到肺,而消融PCSK9将嗜肺细胞转移到肝脏,从而确定PCSK9是次要器官部位偏好的必要和充分条件。作者的研究表明PCSK9驱动的远端胆固醇合成途径的差异利用是PDAC转移性生长的关键和潜在的可操作驱动因素。相关工作以“PCSK9 drives sterol-dependent metastatic organ choice in pancreatic cancer”为题发表在Nature。

【文章要点】
一、PDAC细胞的不同器官偏好
作者采用高通量的体内转移筛选技术揭示了不同肿瘤类型,包括胰腺导管腺癌(PDAC),存在显著的器官特异性转移模式。通过分析PDAC细胞系在5个转移靶器官(肝脏、肺部、肾脏、大脑和骨骼)的定植倾向,作者发现可将PDAC分为两个亚型:一类具有强烈的肝脏转移偏好(C1-Liver亚型),另一类则更倾向于转移至其他器官,尤其是肺部(C2-Lung亚型)。细胞系实验进一步验证了这种器官特异性转移模式,并表明这种差异不仅仅源于肿瘤细胞本身的遗传背景,还可能与其他调控因素有关。通过联合注射不同亚型细胞,作者发现两类细胞在特定器官内的生长差异更为明显,表明转移偏好反映的是定植和生长能力的差异。
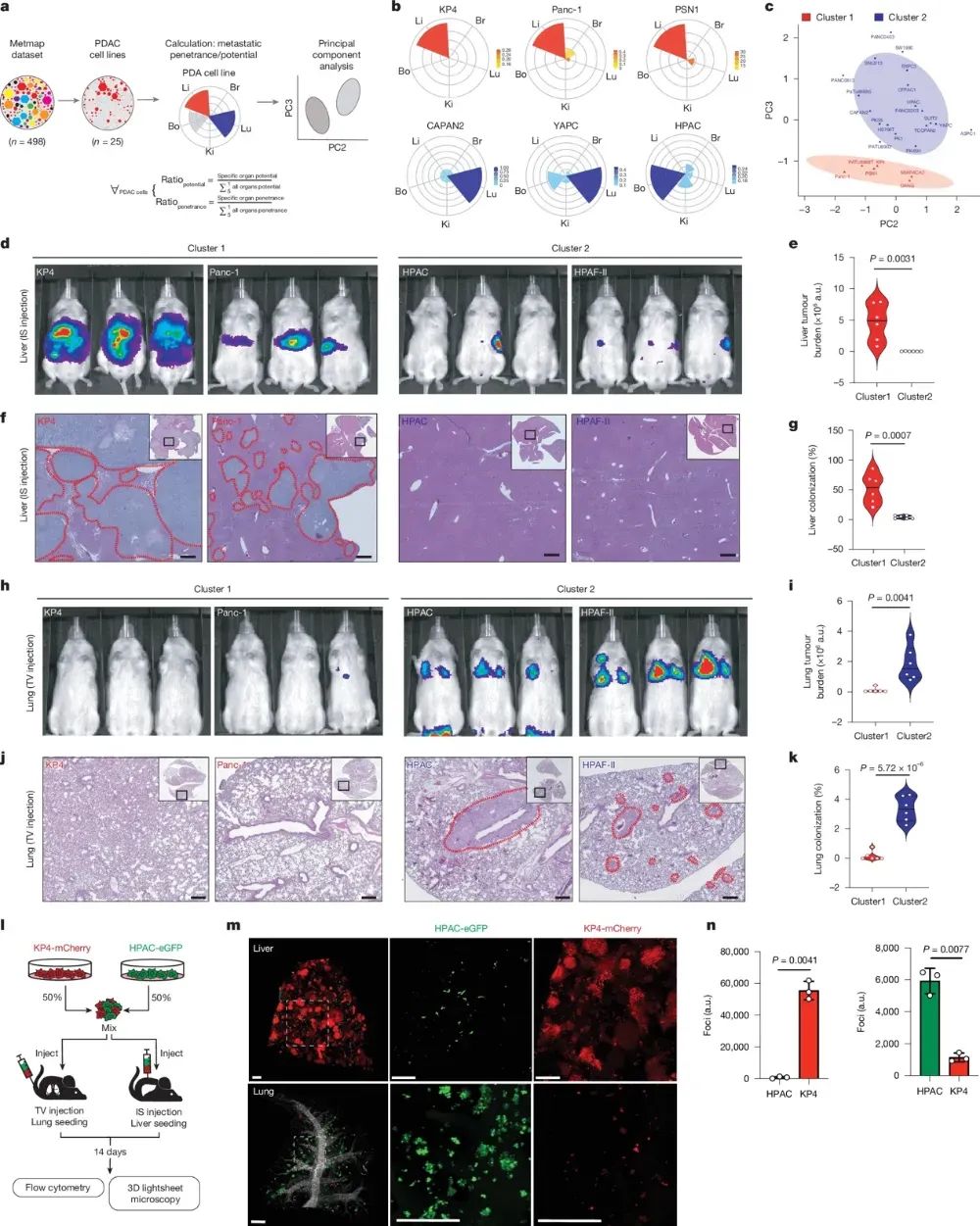
图1 PDAC细胞的不同器官偏好
二、PCSK9水平与器官偏好相关
DepMap数据库分析显示,胰腺导管腺癌(PDAC)细胞可分为两个主要亚型:一种具有强烈的肝脏转移倾向(C1-Liver),另一种更偏向于肺部转移(C2-Lung)。进一步研究发现,这种器官特异性转移差异与PCSK9表达水平密切相关。C2-Lung亚型细胞高表达PCSK9,从而抑制低密度脂蛋白受体(LDLR)的表达和胆固醇代谢,而C1-Liver细胞则PCSK9表达较低、LDLR水平较高。临床样本分析也证实,PCSK9低、LDLR高的肿瘤更易转移至肝脏,而PCSK9高、LDLR低的肿瘤倾向于肺部转移。这一发现为理解PDAC亚型特异性转移的分子机制提供了线索,也为基于PCSK9/LDLR代谢通路的肿瘤转移干预策略的开发奠定了基础。
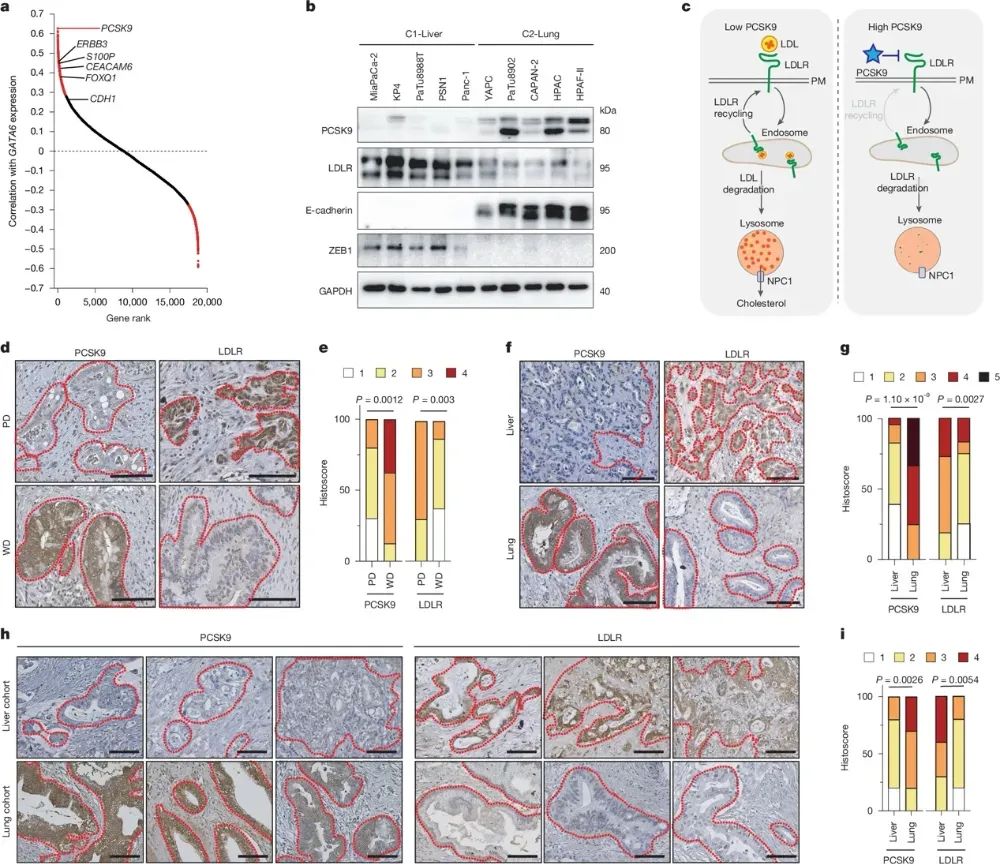
图2 PCSK9水平与器官偏好相关
三、不同的胆固醇代谢指导转移器官偏好
作者发现,与肺部转移倾向的C2-Lung亚型PDAC细胞相比,肝脏转移倾向的C1-Liver亚型细胞对低密度脂蛋白(LDL)的摄取更加依赖。具体而言,C1-Liver细胞在脂蛋白缺乏培养基中增殖受到抑制,而C2-Lung细胞不受影响。这是因为C1-Liver细胞依赖LDL供给维持胆固醇水平和细胞生长,而C2-Lung细胞则更倾向于激活内源性胆固醇合成通路。机制分析发现,C2-Lung细胞高表达调控胆固醇合成的关键转录因子SREBP2,导致下游合成酶表达增高,从而弥补PCSK9抑制LDLR所致的LDL摄取下降。相反,PCSK9抑制LDLR表达和LDL吸收的C1-Liver细胞则会受到生长受损。通过操纵PCSK9和LDLR的表达,可以明显改变肿瘤细胞在肝脏和肺部的生长能力。总之,PCSK9调控的胆固醇代谢重编程是决定PDAC细胞器官特异性转移的关键机制。
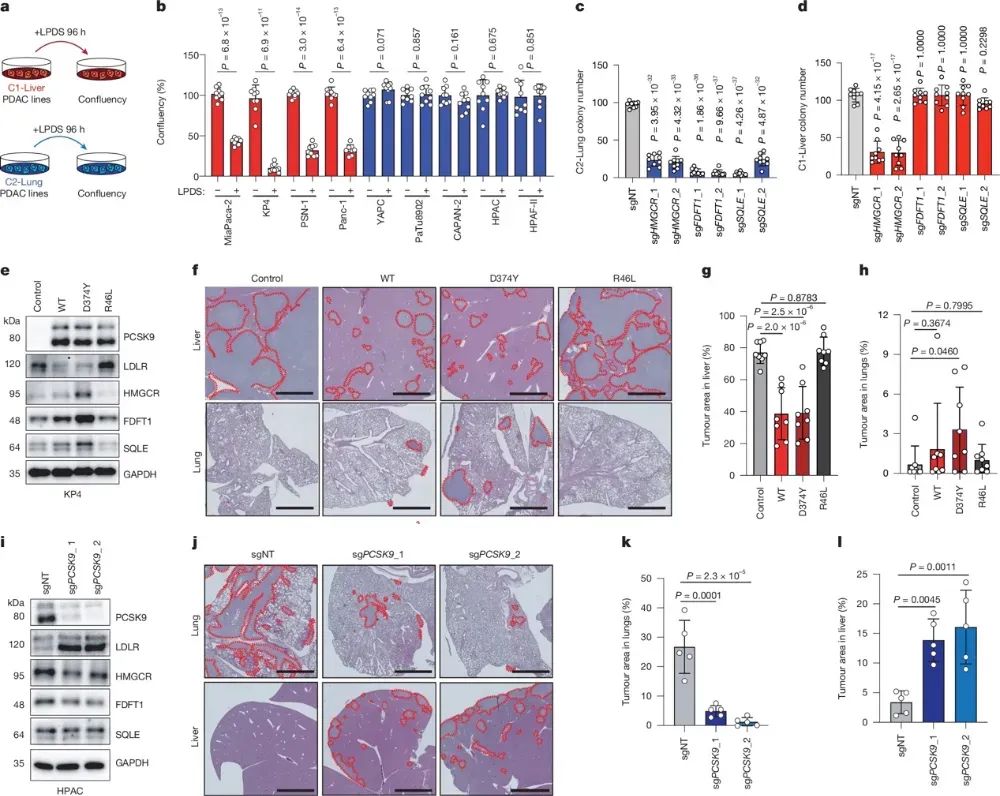
图3不同的胆固醇代谢指导转移器官偏好
四、肝细胞利用胆固醇激活mTORC1并调节微环境
高内吞LDL-胆固醇导致C1-Liver细胞溶酶体内出现大量胆固醇积累,从而激活mTORC1信号通路,促进肿瘤细胞的增殖和存活。同时,C1-Liver细胞还上调表达特异性胆固醇羟化酶CYP46A1,合成24-羟胆固醇(24-HC)。24-HC可以通过LXR转录因子激活旁边肝细胞中胆固醇外排基因的表达,促进肝细胞向肿瘤细胞释放LDL-胆固醇。这种肿瘤细胞到肝细胞的化学信号反馈通路,形成一个维持C1-Liver细胞肝转移生长的循环机制。相反,C2-Lung细胞由于PCSK9高表达而无法有效吸收LDL-胆固醇,不能通过这种途径来调节肝微环境,因此更难在肝脏生长。这一发现进一步阐明了PCSK9-LDLR轴调控肿瘤细胞胆固醇代谢重编程在决定器官特异性转移中的关键作用。
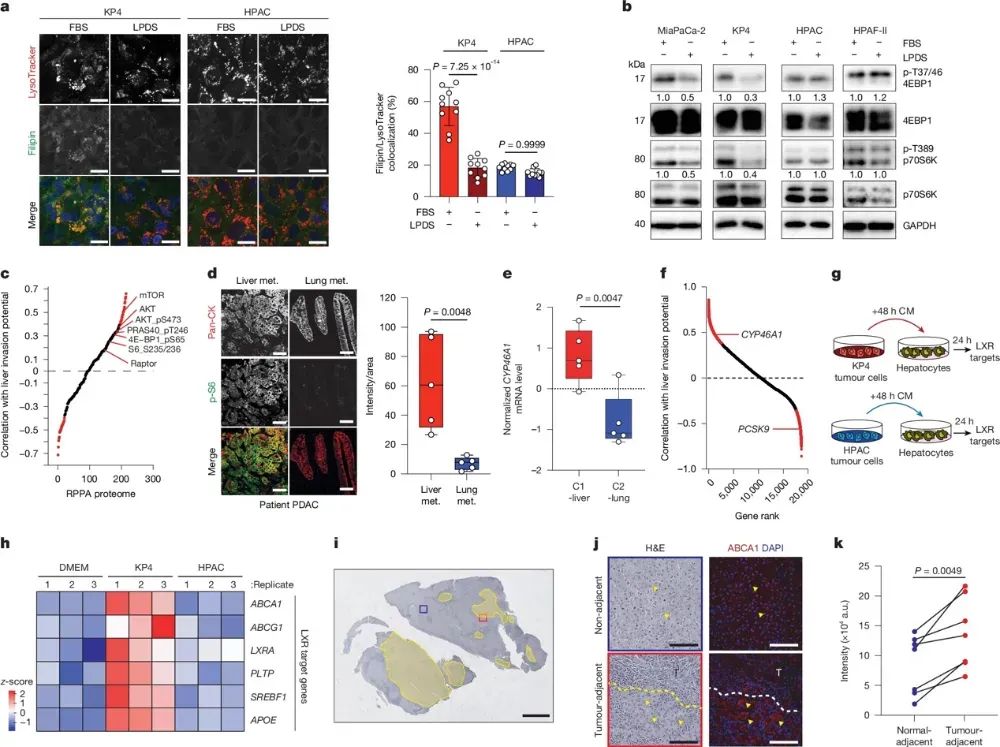
图4肝细胞利用胆固醇激活mTORC1并调节微环境
五、嗜肺PDAC细胞产生具有抗铁死亡特性的固醇中间体
高PCSK9水平增加了7-脱氢胆固醇(7-DHC)和7-脱氢地塞米酮(7-DHD)等胆固醇合成中间体的积累。这些中间体具有抑制铁死亡的性质,能保护肿瘤细胞免受氧化应激伤害。相比之下,低PCSK9表达的C1-Liver细胞不依赖这种保护机制,更易受到铁死亡的诱导。进一步实验证明,C2-Lung细胞株对GPX4抑制剂RSL3和ML210的耐受性更强,而敲除PCSK9或阻断7-DHC、7-DHD合成能够降低其耐药性。同时,给予7-DHC或7-DHD预处理可以增强原本肝脏定植倾向的KPC1细胞在肺部的生长。综合以上结果,PCSK9调控的内源性胆固醇代谢重编程不仅影响肿瘤细胞对LDL-胆固醇的依赖程度,进而决定肝脏和肺部的转移倾向,还通过产生抗铁死亡的中间体来保护C2-Lung细胞免受氧化应激伤害,从而促进其在肺部的定植和生长。
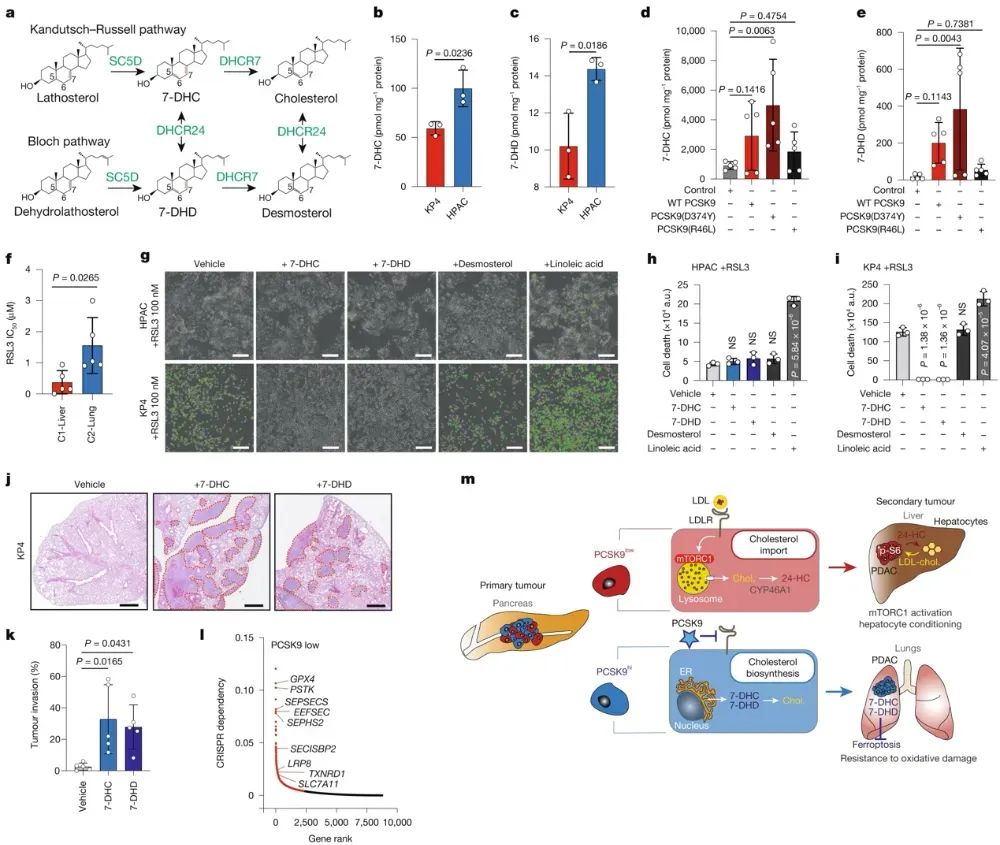
图5嗜肺PDAC细胞产生具有抗铁死亡特性的固醇中间体
【结论与展望】
大多数癌细胞表现出合成、摄取和储存脂质增加以适应生长和应激。这些不同的脂质处理活动之间的最佳平衡可能部分取决于能量限制,胆固醇合成是非常耗能的。因此,胆固醇生物合成途径基因受到反馈调节,以将这种脂质水平维持在与生长相容的确定范围内。此外,甲羟戊酸途径和远端胆固醇合成途径产生几种促进生长的代谢物,包括戊烯酰化前体、醇、泛素和抗衰铁衍生物。由于甲羟戊酸-胆固醇通路的高可塑性和可调性,其分支和输出在癌细胞生长的各个方面的相对贡献尚不清楚。作者的研究表明,PDAC细胞对甲羟戊酸-胆固醇途径的不同利用,可以在肝脏和肺部代谢不同的生态位定植的背景下得到最好的理解。此外,PCSK9调节特定胆固醇中间体和衍生物的可用性,这有助于肿瘤细胞克服与肝脏和肺部生长相关的器官特异性挑战,这一发现具有潜在的临床应用价值。
原文链接:
https://www.nature.com/articles/s41586-025-09017-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#胰腺癌# #PCSK9#
12