Nat Commun:满江红等团队研究揭示了AATF在XRCC4介导的NHEJ修复中的关键作用
2025-06-05 iNature iNature 发表于上海
研究揭示了GSC通过上调凋亡拮抗转录因子(AATF)激活非同源末端连接(NHEJ)来增强其DNA修复能力,从而促进GB的治疗耐药性。
胶质母细胞瘤(GB)是一种对放化疗耐药的高侵袭性脑肿瘤,主要是由于胶质瘤干细胞样细胞(GSC)具有强大的DNA损伤修复能力。
2025年5月28日,国家生物医学分析中心南湖实验室满江红、周涛、美国宾夕法尼亚州匹兹堡大学Jeremy N. Rich共同通讯在Nature Communications上在线发表题为“Elevated nonhomologous end-joining by AATF enables efficient DNA damage repair and therapeutic resistance in glioblastoma”的研究论文。研究揭示了GSC通过上调凋亡拮抗转录因子(AATF)激活非同源末端连接(NHEJ)来增强其DNA修复能力,从而促进GB的治疗耐药性。
AATF与NHEJ核心亚基XRCC4相互作用,防止其通过泛素介导的蛋白酶体过程降解。DNA损伤后,AATF在Ser189位点被ATM磷酸化,导致其与XRCC4解离,并将XRCC4快速募集到DNA断裂位点,以实现有效的NHEJ修复。此外,AATF耗竭或AATF磷酸化缺陷会阻碍GSC中的NHEJ,使GB异种移植物对放化疗敏感。此外,AATF水平升高会导致GB患者的预后不良。总的来说,研究结果揭示了AATF在XRCC4介导的NHEJ修复中的关键作用,并强调靶向AATF是克服GB对放化疗耐药的潜在策略。

胶质母细胞瘤(GB)是一种无法治愈的原发性脑肿瘤,预后不佳。虽然放化疗是GB患者最有效的非手术治疗方法,但治疗耐药性是普遍的。神经胶质瘤干细胞样细胞(GSC)通过有效修复DNA损伤和维持基因组稳定性来促进治疗耐药性,使它们在DNA损伤的情况下仍能存活和生长。然而,GSC修复DNA损伤能力的分子机制仍不完全清楚,这是改善GB治疗结果的主要障碍。更深入地了解GSC的DNA损伤修复特征可以深入了解胶质瘤生物学和这种毁灭性疾病的新治疗可能性。放化疗会诱发各种类型的DNA损伤,其中DNA双链断裂(DSB)尤其有害,因为如果不修复,它们会导致染色体异常、基因组不稳定和细胞死亡。DSB修复有两种主要途径:同源重组(HR)和非同源末端连接(NHEJ)。HR是一个发生在细胞周期的S和G2期的无错误过程。相比之下,NHEJ是一种容易出错的端到端连接过程,可以在细胞周期的任何时间发生,并被认为是修复人类细胞中DSB的主要机制。遇到DSB后,NHEJ由Ku70/80异二聚体与游离DNA末端的结合引发,促进NHEJ必需组分的组装。Ku-DNA-PKcs复合物在将断裂的DNA末端聚集在一起中起着至关重要的作用。随后,XRCC4与LIG4形成复合物并稳定,随后LIG4被募集到DNA末端以密封断裂的DNA。然而,XRCC4蛋白的调节及其在翻译后但募集到DSB之前的命运知之甚少。尽管NHEJ基因的有害变异会增加GB的风险,GB治疗耐药性中的NHEJ调节值得进一步研究。在这项工作中,研究者证明GSC通过增加细胞凋亡拮抗转录因子(AATF)水平激活NHEJ通路来有效修复DNA损伤。研究发现AATF与NHEJ复合物的核心成分XRCC4结合,并阻止其蛋白酶体降解。在DSB的刺激下,ATM磷酸化AATF,导致其从XRCC4中解离,并允许XRCC4快速募集到DSB位点以启动NHEJ修复,从而促进GSC的治疗耐药性。因此,这些发现确定AATF是XRCC4介导的NHEJ通路的调节因子,表明靶向NHEJ可能有助于克服GB对放化疗的耐药性。
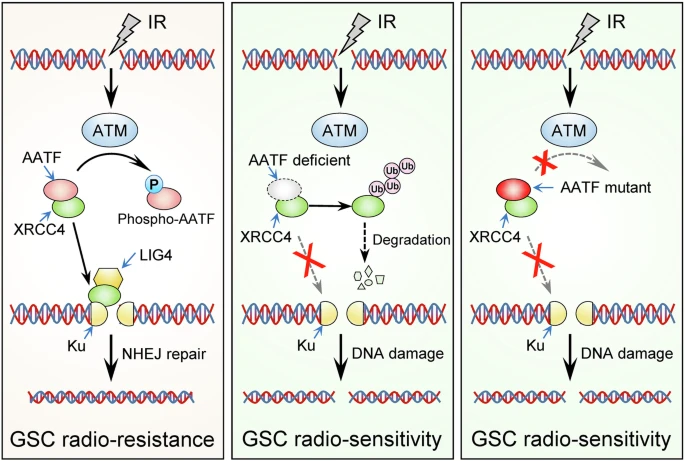
图1AATF促进了GSC中的NHEJ修复(摘自Nature Communications)
参考消息:https://doi.org/10.1038/s41467-025-60228-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#胶质母细胞瘤# #AATF#
2