Gastroenterology:胰腺脂肪沉积与胰腺癌风险的关联因癌型不同而异
2025-06-27 MedSci原创 MedSci原创 发表于上海
此次研究精准解析脂肪胰腺在胰腺癌形成中的角色,尤其是其对伴发于IPMN胰腺癌的重大影响,提供了疾病早期识别的重要视角。
胰腺癌作为全球预后最差的恶性肿瘤之一,早期发现难度大,且病理异质性显著。胰腺脂肪沉积俗称“脂肪胰腺”,近年来被逐渐认识为多种胰腺疾病的关键形态学改变,其在临床胃肠病学中备受关注。既往研究提示高程度胰腺脂肪沉积或与胰腺癌发病存在关联,但该关联究竟如何受胰腺癌不同病理类型影响尚未明确。胰腺导管乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm, IPMN)作为胰腺的一类囊性病变,具有明确的癌变潜能,患者需长期监测。IPMN可进一步分化为来源于IPMN的癌及伴发于IPMN的癌,二者在发生机理与预后上存在明显差异。

近日,日本东京大学研究团队发表于Gastroenterology一项前瞻性嵌套病例对照研究,系统探索了胰腺内脂肪沉积(intrapancreatic fat deposition, IPFD)与不同胰腺癌类型的发病风险关联。研究基于2070例IPMN患者长达12年的随访数据,首次揭示IPFD对伴发型胰腺癌风险有显著促发作用,而对IPMN来源的癌风险则无明显影响,为胰腺癌的病理机制和早期诊断开辟新视角。
研究方法
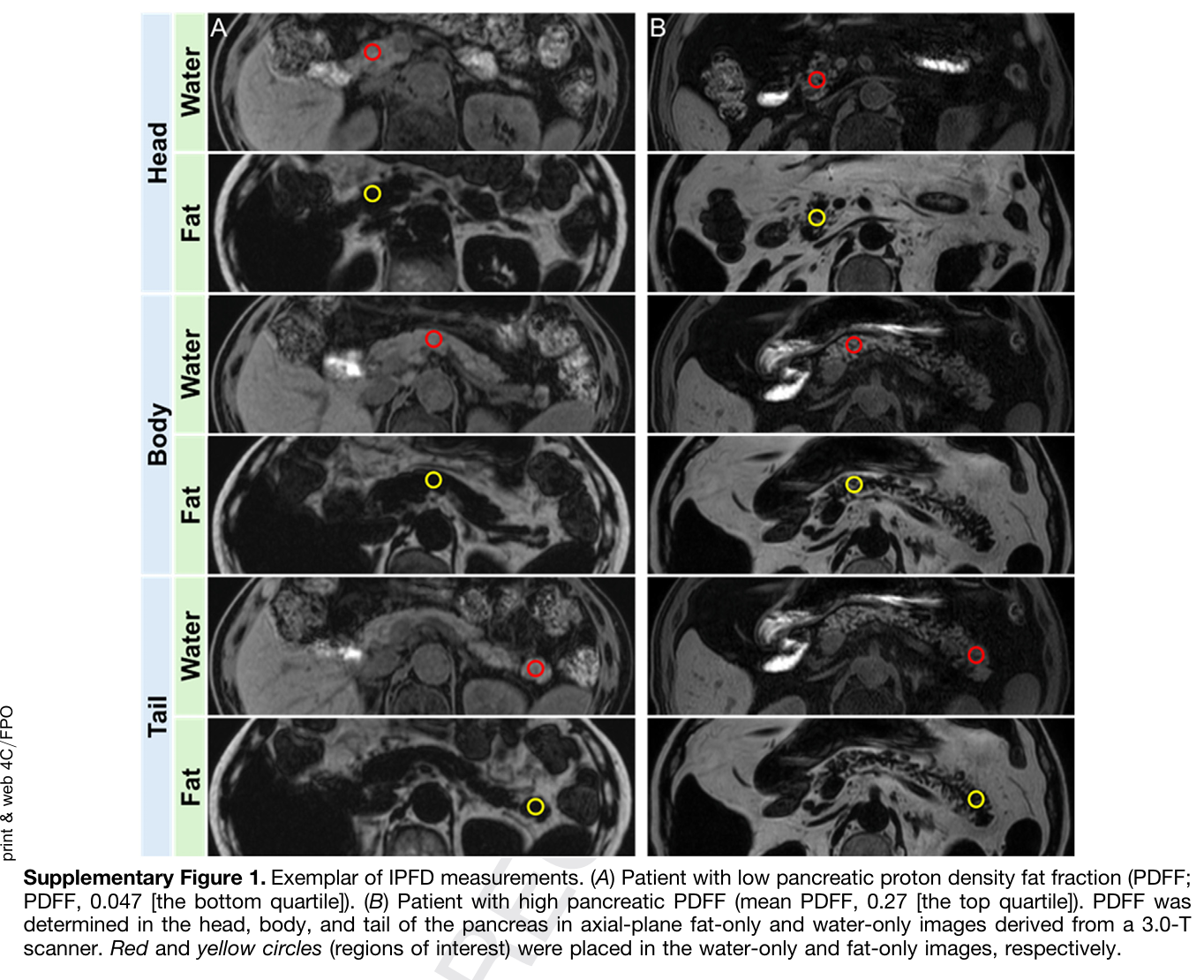
本研究为嵌套病例对照设计,纳入2013年至2023年间在东京大学附属医院确诊的2070例IPMN患者,排除慢性胰腺炎、既往胰腺癌病史及手术者。基于IPMN诊断时的3.0-T Dixon MRI技术测量胰腺质子密度脂肪分数(proton density fat fraction, PDFF),量化IPFD水平。研究将IPFD分为四分位数,定义最高四分位为脂肪胰腺。纵向随访至2024年,期间诊断出55例胰腺癌病例,匹配275名年龄、性别相似的对照进行比较。胰腺癌分为来源于IPMN的癌和伴发于IPMN的癌,采用多变量逻辑回归模型调整包括BMI、糖尿病、吸烟状态及IPMN特征,在两类癌症风险中分别评估IPFD的影响。
主要研究结果
患者特征及IPFD差异
基线时脂肪胰腺(IPFD最高四分位)在癌症伴发IPMN组中出现率显著高于来源于IPMN癌组(46.7% vs 12.0%,P=0.006)。总体脂肪分数在癌症患者与对照间无显著差异,但在特定癌型之间差异明显。
IPFD与胰腺癌风险关联分析
多变量调整后,IPFD与胰腺癌伴发IPMN类型风险显著相关。最高四分位与最低四分位风险比(OR)为4.63(95%CI 1.33-16.1,P_trend=0.004),而来源于IPMN癌则无显著关联(OR约0.75,95%CI 0.08-6.88)。两者差异具有统计学意义(P_heterogeneity=0.004)。在支气管导管IPMN亚组,风险关联更强,OR提升至8.53(95%CI 1.91-38.0,P_trend=0.001)。
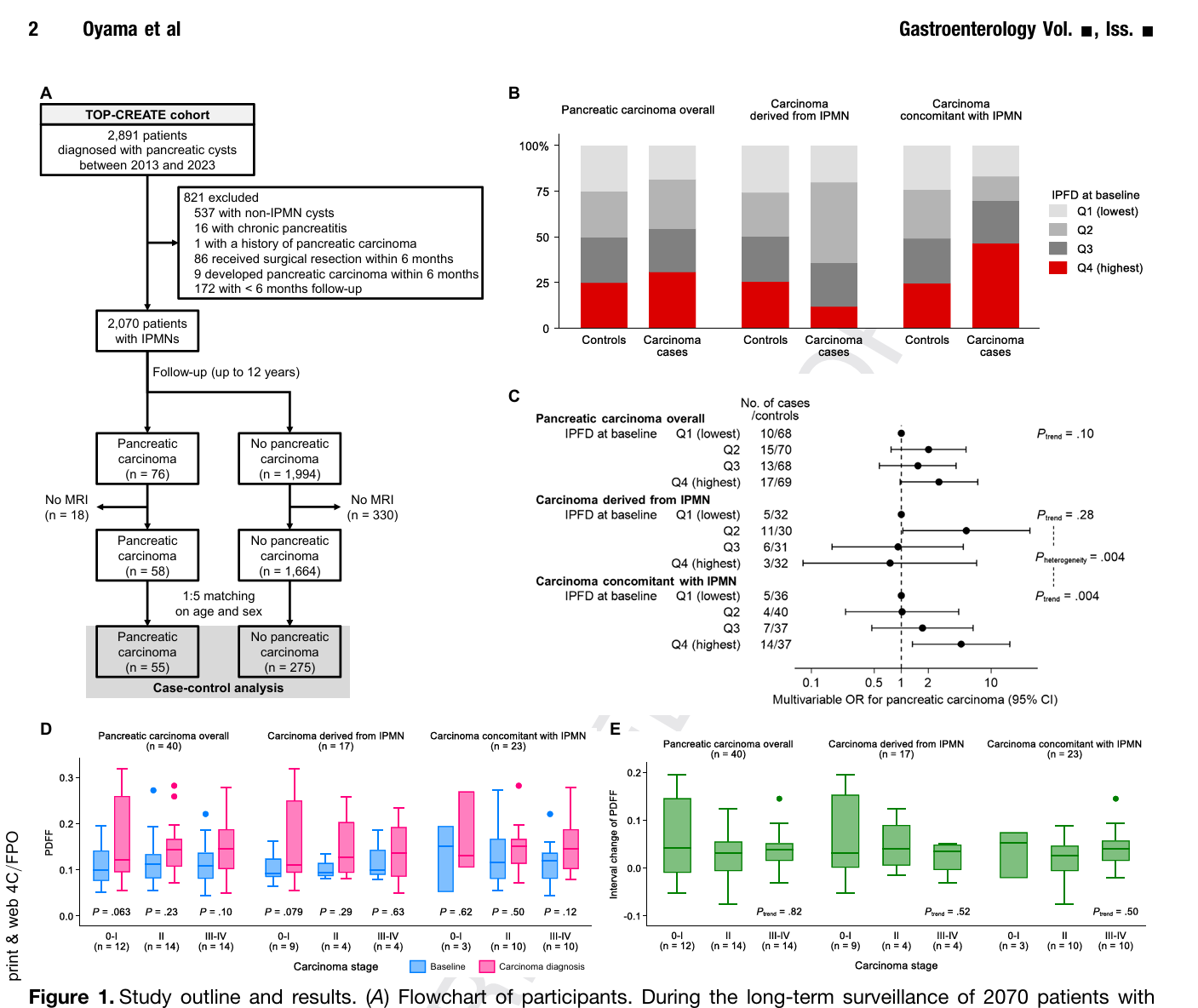
此外,在胰腺癌不同临床分期中,IPFD变化无显著趋势,指示IPFD可能是胰腺癌发生的早期风险因素,而非随肿瘤进展动态变化。
附加分析
IPFD与IPMN恶性进展相关的“令人担忧的特征”未显示相关性,进一步支持IPFD为独立风险因子。此外,调整包括BMI、糖尿病等共变量后,关联结果稳健。
研究价值与意义
本研究首次揭示了胰腺脂肪沉积对两类胰腺癌风险的差异性影响,显著丰富了胰腺癌发病机制的理解。脂肪胰腺作为一种可被MRI非侵入性量化的形态学标志,有望成为胰腺癌早期筛查及个体化监测的一项新指标,大幅提升高危人群识别的精准度,尤其是在IPMN患者中筛查伴发癌方面的潜力。现有IPMN监测更多依赖病变本身的解剖及生物标志物变化,本研究提示应重视胰腺整体脂肪环境的作用。此外,IPFD相关的胰腺脂肪代谢异常及其促癌机制,为未来靶向干预和癌症预防策略提供了新的方向。
尽管尚有IPFD不能通过组织学直接确认、单中心样本存在选择偏倚等局限,该研究通过大样本、长随访和高精度影像学支持,建立了坚实的循证基础。未来多中心、分子机制深入研究将进一步验证并完善IPFD作为胰腺癌风险标志的应用价值。
梅斯小编点评
此次研究精准解析脂肪胰腺在胰腺癌形成中的角色,尤其是其对伴发于IPMN胰腺癌的重大影响,提供了疾病早期识别的重要视角。鉴于胰腺癌预后不良,建立有效的早期筛查方案刻不容缓。IPFD作为MRI定量指标的出现,突破了传统脂肪评估的技术限制,为个体化防治策略奠定基础。未来值得关注IPFD在脂肪代谢异常、胰腺微环境调节及肿瘤促发信号的分子细节,或将引导精细化治疗策略。多中心验证和整合分子生物学指标,将推动脂肪胰腺向临床风险预测和动态监测的转化。值得所有消化内科和肿瘤科研究者密切关注。
原始出处
Oyama H, Hamada T, et al. Relationship of Intrapancreatic Fat Deposition With Pancreatic Cancer Differs According to Carcinoma Types. Gastroenterology. 2025. doi:10.1053/j.gastro.2025.04.032
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#胰腺癌# #胰腺脂肪沉积#
16 举报