STTT:四川大学石虎兵等团队研究揭示了PDAC肿瘤发展过程中逐步逃避免疫监视的复杂机制
2025-06-14 iNature iNature 发表于上海
研究通过分析来自51个组织的132,115个单细胞转录组来研究胰腺导管腺癌(PDAC)肿瘤微环境的动力学变化,包括健康胰腺组织、非转移性PDAC原发性肿瘤、转移性原发性肿瘤和患者匹配的肝转移。
宿主免疫系统在从正常细胞进化为恶性肿瘤的过程中如何失去其监视功能在很大程度上仍然未知。
2025年6月9日,四川大学华西医院石虎兵、马学磊、敬静共同通讯在Signal Transduction and Targeted Therapy上在线发表题为“Single-cell transcriptional disp illuminates an evolution of immunosuppressive microenvironment during pancreatic ductal adenocarcinoma metastasis”的研究论文。研究通过分析来自51个组织的132,115个单细胞转录组来研究胰腺导管腺癌(PDAC)肿瘤微环境的动力学变化,包括健康胰腺组织、非转移性PDAC原发性肿瘤、转移性原发性肿瘤和患者匹配的肝转移。
仔细表征了每种细胞类型的细胞比例、生物功能和相互作用。在肿瘤发展过程中,在上皮细胞的7号和20号染色体上鉴定出表明恶性强度的异常拷贝数变异(CNV)。优势基因在生物学功能上发生了从生理到胰腺肿瘤发生和转移的转变。上皮细胞和免疫细胞的组合分析表明在恶性转化过程中免疫监视的梯度丧失。通过分析细胞间的相互作用,研究揭示了通过分子对ANXA1-FPR1/3增加的肿瘤细胞触发的DC凋亡。因此,细胞毒性CD8+ T细胞的活化和浸润逐渐受到抑制。值得注意的是,研究揭示了一种新的应激反应NK细胞亚型(strNK),其特征是强大的增殖能力,减弱的细胞溶解能力和负性免疫调节。值得注意的是,strNK细胞的存在与PDAC患者的不良预后相关,提示其潜在的促肿瘤功能。综上所述,研究结果不仅揭示了PDAC肿瘤发展过程中逐步逃避免疫监视的复杂机制,而且提供了一种通过增强DCs功能来阻止恶性转化的潜在策略。

胰腺癌仍然是肿瘤学领域最艰巨的挑战之一,约占所有癌症相关死亡率的8.5%。胰腺导管腺癌(PDAC)是胰腺最普遍的恶性肿瘤。PDAC的治疗前景很复杂,因为绝大多数患者(超过80%)表现为不可切除的疾病,并且在诊断时以区域或远处转移为特征。尽管手术切除后辅助治疗是适合手术的局部早期疾病患者的标准治疗方式,但化疗对大多数不可切除的患者无效,凸显了对新型治疗策略的迫切需求。除了常规疗法发现延迟和疗效有限的挑战外,PDAC已被证明对免疫疗法具有耐药性,免疫疗法在治疗其他各种恶性肿瘤方面已显示出成功。
肿瘤微环境(TME)的复杂性是PDAC抵抗免疫疗法的主要原因。越来越多的证据强调了新抗原数量增加、抗肿瘤CD8T细胞反应和长期生存率增强之间的相关性,以及免疫检查点阻断策略的临床疗效。为了诱导针对肿瘤的特异性适应性免疫反应,来自肿瘤细胞的新抗原被抗原呈递细胞(APC)捕获并有效加工并交叉呈递给CD8T细胞。然而,树突状细胞(DC)对于抗原交叉呈递至CD8T细胞至关重要,在PDACTME中表现出明显的低浸润水平。此外,免疫抑制性肿瘤相关髓系细胞也富集在PDAC的TME中,使免疫景观进一步复杂化。总的来说,这些多方面因素有助于阻碍CD8T细胞浸润,从而维持PDACTME的“免疫冷”特性。
在恶性转化过程中,肿瘤细胞与TME内的各种基质细胞类型发生相互作用,这些细胞对肿瘤进展和免疫逃逸至关重要。全面了解TME中各种细胞类型之间的复杂相互作用对于阐明肿瘤发展、转移和预后的机制至关重要。单细胞RNA测序(scRNA-seq)技术的最新进展使得能够在单细胞转录组水平分析PDAC原发性肿瘤的TME。这些研究揭示了个体患者TME的免疫和基质组成存在相当程度的异质性。值得注意的是,缺乏T细胞浸润与免疫治疗耐药性有关。然而,目前的研究主要集中在非转移性PDAC上,未能全面了解TME在转移过程中的动态变化。重要的是要承认PDAC表现出明显的转移倾向,并且TME的动力学在转移过程中发生了显著变化。以前的研究表明,PDAC原发肿瘤、循环肿瘤细胞和转移病灶中存在明显的免疫肿瘤相互作用。因此,迫切需要在PDAC进展的各个阶段以单细胞分辨率对TME进行全面的转录组学分析,包括从健康胰腺组织到非转移性原发性肿瘤再到转移性原发性肿瘤,最后形成肝转移病灶的过程,这对于理解PDAC转移的机制和开发更有效的治疗范式至关重要。
在这项研究中全面剖析了健康胰腺组织、非转移性PDAC原发性肿瘤、转移性原发性肿瘤和匹配肝转移的TME景观。通过利用scRNA-seq,研究表征了PDAC整个恶性转化过程中细胞群分布、细胞转录组谱和细胞间相互作用的差异。研究不仅揭示了PDAC转移进化过程中的上皮细胞改变,还表征了不同免疫细胞亚群的转录组景观。此外,研究确定了几种特定的免疫细胞亚型,包括三种类型的巨噬细胞、五种类型的DC、十种类型的T细胞和五种类型的NKs,它们可能导致肿瘤的恶性转化。这些结果阐明了PDACTME的各种细胞成分之间的复杂相互作用及其在肿瘤进展过程中的进化动力学。
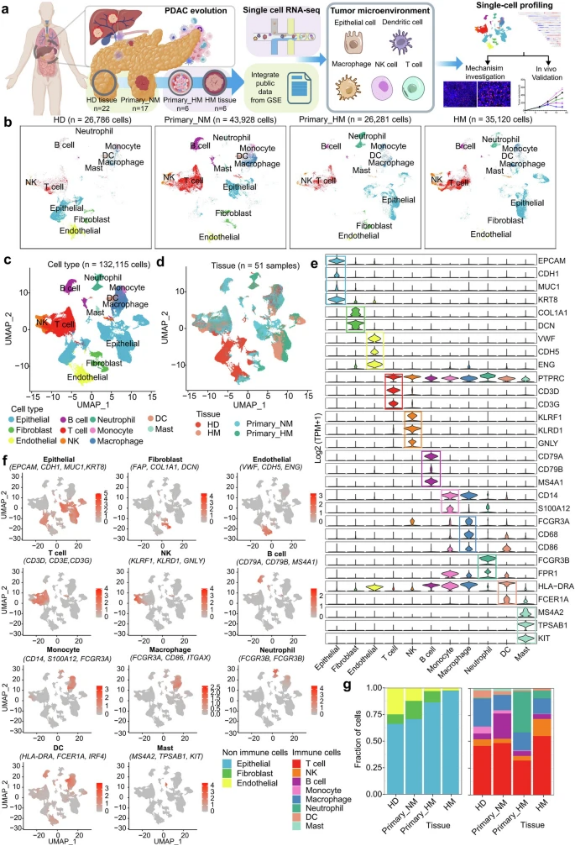
图1PDAC转移的肿瘤微环境的特征(摘自Signal Transduction and Targeted Therapy)
参考消息:
https://doi.org/10.1038/s41392-025-02265-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















前往app查看评论内容
3 0