JHO:新型EZH1/2双重抑制剂在复发难治性外周T细胞淋巴瘤中的安全性及疗效观察
9小时前 吾乃喵大人 MedSci原创 发表于上海
本研究首次系统揭示了HH2853在复发及难治性外周T细胞淋巴瘤中的临床应用价值。
亮点总结
- HH2853作为选择性EZH1/2双重抑制剂,在复发难治性外周T细胞淋巴瘤(r/r PTCL)患者中展现了良好的安全性和可控的毒性。
- 该药物的整体缓解率达67.6%,完全缓解率达29.4%,显示出在该高风险患者群体中显著的抗肿瘤活性。
- 尤其对AITL(血管免疫母细胞样T细胞淋巴瘤)亚型患者疗效突出,提供了潜在精准治疗的新方向。
近日,一项多中心、开放标签、单臂的I期临床试验正式公布了新型口服EZH1/2双重抑制剂HH2853在中国复发及难治性外周T细胞淋巴瘤患者中的安全性、耐受性及初步疗效。该研究纳入34例曾接受过多线治疗的r/r PTCL患者,剂量涵盖300 mg、400 mg及600 mg BID三档。经1年以上的中位随访,HH2853展现出较高的客观缓解率,治疗相关不良事件可管理,建议剂量确定为400 mg BID。相关成果发表于Journal of Hematology & Oncology,为r/r PTCL治疗提供了新的潜在突破。

外周T细胞淋巴瘤(PTCL)是一类异质性极强的侵袭性淋巴系统恶性肿瘤,常见亚型包括PTCL未特指型(PTCL-NOS)、血管免疫母细胞样T细胞淋巴瘤(AITL)及间变大细胞淋巴瘤(ALCL)。目前,标准多药化疗方案虽然为初治患者提供一定疗效,但一旦复发或对治疗耐药,患者预后十分凶险,中位总生存期仅约6个月。新兴治疗选择虽不断涌现,包括JAK/STAT通路抑制剂、HDAC抑制剂及免疫治疗,但整体疗效仍有限,亟需创新靶向药物以改善治疗前景。
EZH2作为PRC2复合物中的关键亚基,催化组蛋白H3的K27位点三甲基化(H3K27me3),参与转录沉默调节。在多种癌症,特别是PTCL中,EZH2异常高表达与肿瘤进展密切相关。然而,EZH2单独抑制剂临床受限于EZH1的补偿性作用,因此联合抑制EZH1/2被认为是更为有效的治疗策略。前期临床数据显示,另一种EZH1/2双重抑制剂valemetostat在r/r T细胞淋巴瘤中具有良好疗效,提示此类双重抑制剂具备较强的临床应用潜力。
HH2853作为一种新颖选择性EZH1/2双重抑制剂,在多种前临床模型中表现出优于现有EZH2特异抑制剂的抗肿瘤活性,并在实体瘤I/II期临床中显示出良好的安全性与疗效。基于此,该项研究旨在评估HH2853在r/r PTCL患者中的安全性、耐受性及疗效表现。
研究方法
本研究为多中心、开放标签、单臂的I期临床试验,于中国15家医疗机构开展,招募符合纳入标准的r/r PTCL患者,年龄≥18岁,既往至少接受过1线系统治疗,疾病复发或难治。排除标准包括既往使用EZH2或EZH1/2抑制剂、CNS累及、活动性感染及其他严重合并症。
试验设计包括剂量递增期采用经典3+3设计,剂量为300 mg、400 mg及600 mg两次每日口服,以确定推荐II期剂量(RP2D),随后进行剂量扩展验证。治疗周期为28天,至出现不可耐受毒性、疾病进展或患者退出。主要观察终点为安全性和客观缓解率(ORR),次要终点涵盖缓解持续时间、无进展生存期(PFS)、总体生存期(OS)及药代动力学和药效学指标。
主要研究结果
疗效评估显示总体缓解率(ORR)为67.6%,其中完全缓解(CR)比例为29.4%,部分缓解(PR)为38.2%。疾病控制率(DCR)达到73.5%。中位缓解持续时间(DoR)为14.8个月,中位无进展生存期6.3个月,而整体生存期尚未达到。各剂量组疗效相近。
特别值得注意的是,血管免疫母细胞样T细胞淋巴瘤(AITL)患者的ORR高达86.7%,显示对该亚型有较好疗效。同时,接受过新型抗肿瘤药物治疗(如chidamide等)的患者中,HH2853依然保持61.9%的ORR,提示对既往治疗失败患者具有较好的挽救作用。
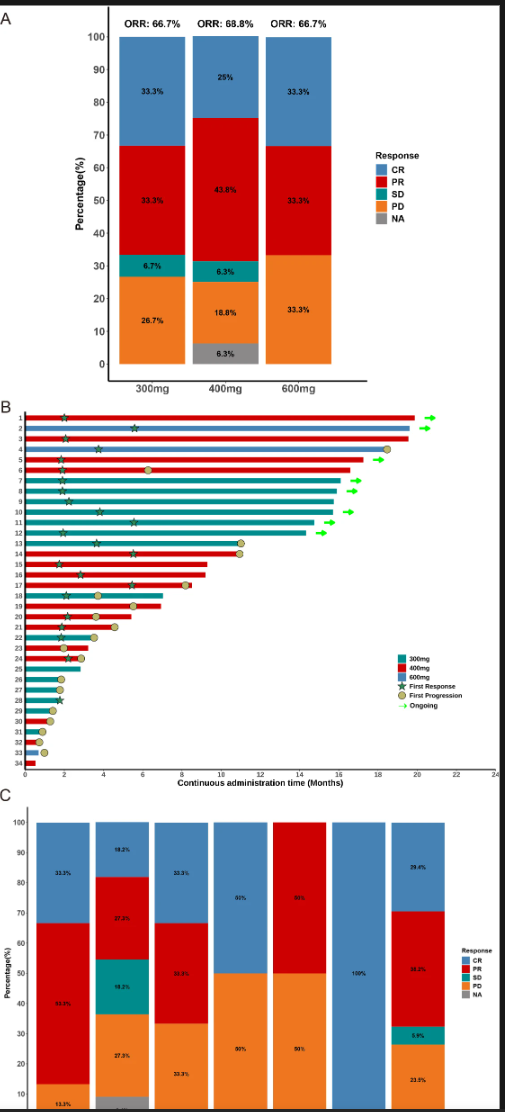
图. HH2853不同剂量组及病理亚型患者最佳治疗反应图及治疗时间
安全性分析显示,所有患者均发生治疗相关不良事件(TRAEs),其中92.1%为任何级别,20.6%为3级及以上。常见血液学不良反应包括贫血(67.6%)、血小板减少(52.9%)、白细胞减少(44.1%)和腹泻(38.2%)。600 mg组中有一例因4级血小板减少出现剂量限制毒性(DLT)。基于安全性考虑,400 mg BID确定为推荐Ⅱ期剂量(RP2D)。多达52.9%的患者曾因不良事件暂停用药,23.5%患者调整剂量,治疗相关严重不良事件多为可控和短暂。
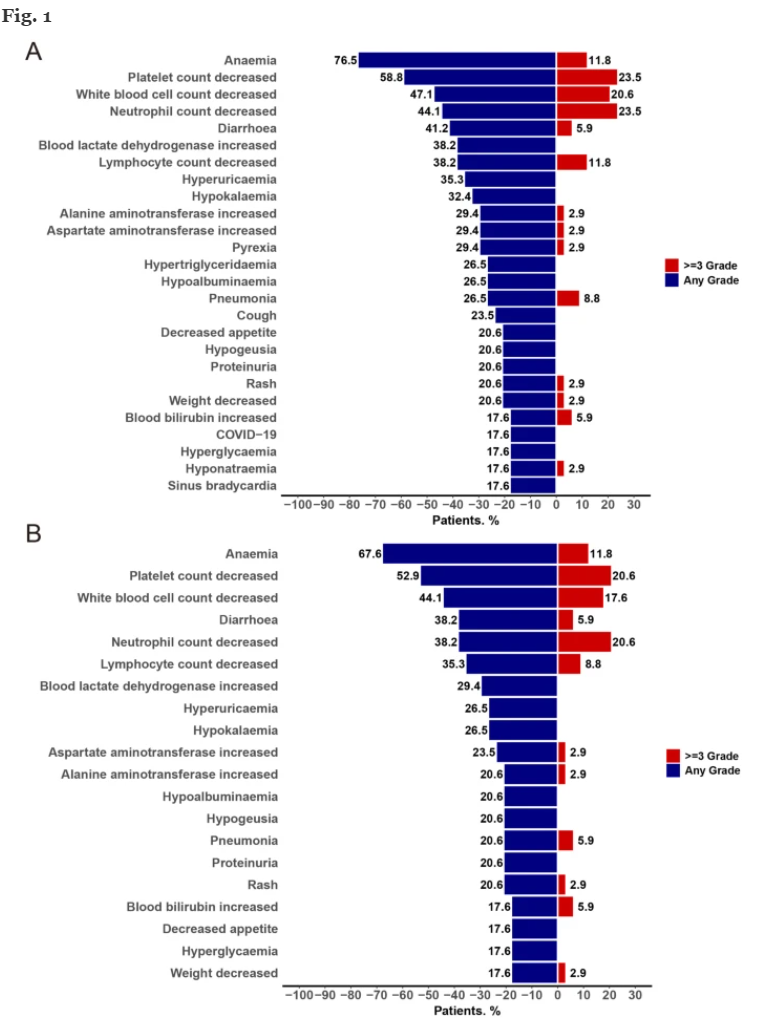
图. 各剂量组HH2853治疗相关不良事件(TEAEs和TRAEs)分布图
药代动力学结果显示,口服HH2853吸收迅速,峰浓度达时间为2小时,暴露量与剂量相关但存在个体差异,表现出温和的稳态累积。药效学检测通过PBMC中H3K27me3水平下降,证实了药物对靶点的有效抑制。
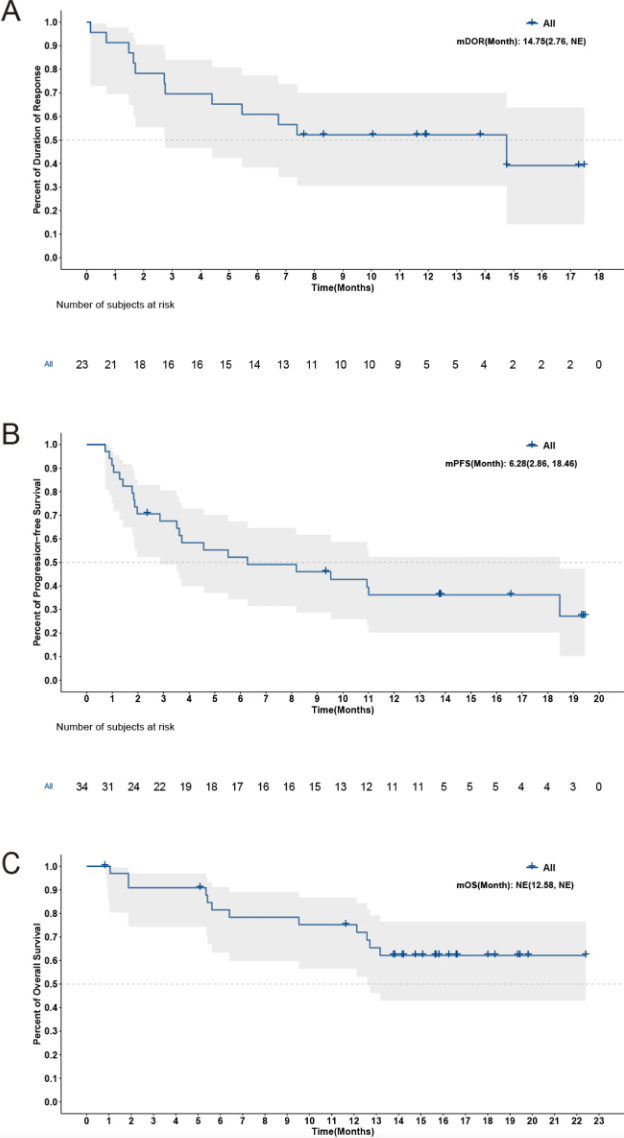
图. 响应患者缓解持续时间及全体患者无进展及总生存曲线
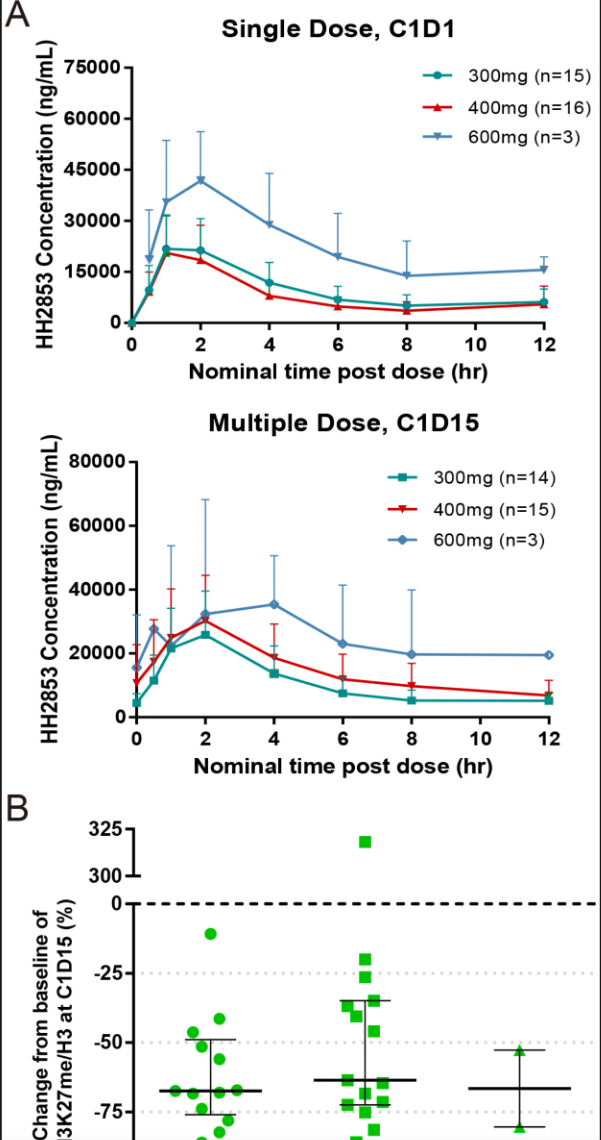
图. HH2853血浆药物浓度时间曲线及PBMC中H3K27me3标志物抑制效果
研究价值与意义
本研究首次系统揭示了HH2853在复发及难治性外周T细胞淋巴瘤中的临床应用价值。相比现有单一EZH2抑制剂和其他靶向治疗药物(如pralatrexate、copanlisib、ruxolitinib及HDAC抑制剂)的较低响应率(25-46%),HH2853展现出更高的客观响应率和完全缓解率,且毒副作用相对可控,提示其在r/r PTCL领域中的治疗潜力。对既往使用过新型药物的患者仍展现出良好疗效,表明HH2853或可作为救援治疗手段。
同时,AITL患者对本药物响应特别显著,支持未来开展精准分子分类指导下的药物筛选和个性化治疗策略。此外,EZH1/2双重抑制机制代表了克服EZH2抑制剂临床局限的重要路径,此类药物更能有效抑制H3K27me3修饰,调控恶性淋巴瘤相关的转录异常。
未来,结合免疫检查点抑制剂、HDAC抑制剂等联合用药方案,有望进一步发挥协同抗肿瘤作用,改善患者预后。当前研究仍存在样本量有限和随访时间较短等不足,需更大规模、随机对照的研究验证疗效和安全性。
梅斯点评
梅斯张博士点评:本研究为复发难治性PTCL患者带来了新的治疗希望。HH2853通过双重靶点EZH1/2实现对肿瘤表观遗传机制的深度干预,显著提升了疗效和缓解比例。尤其是AITL患者的高响应率值得深入探讨,可能揭示该亚型疾病的独特生物学特征。未来应聚焦于机制研究,明确HH2853的精准作用人群,并结合免疫或其他靶向药物,探索优化联合方案,以期突破目前疗效瓶颈。同时,探索长期安全性及生存获益将是后续研究重点。
原始出处:
Hong H, Chen Z, Zhang M, Peng Z, et al. A multicenter, open-label, single-arm, phase Ib clinical trial of HH2853 treatment in patients with relapsed and/or refractory peripheral T-cell lymphoma. J Hematol Oncol. 2025;18:50. https://doi.org/10.1186/s13045-025-01697-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















前往app查看评论内容
0 0 举报
#外周T细胞淋巴瘤# #HH2853#
6 举报