npj Precision Oncology:ALK阳性间变性大细胞淋巴瘤中的循环肿瘤DNA(ctDNA)应用:用于监测和耐药突变识别的概念验证
7小时前 熊佳仪 MedSci原创 发表于上海
鉴于ALK+ ALCL病情起伏多变,ctDNA的动态监控可助力临床诊断、疗效评估和早期复发预警,进一步丰富精准医疗工具箱。
间变性大细胞淋巴瘤(ALCL)属于非霍奇金淋巴瘤中的一种罕见类型,儿童病例占比10%-15%,成人约1%-2%。90%以上的儿童ALK+ ALCL病例均携带ALK基因融合(以NPM1::ALK最为常见),该融合激活ALK的酪氨酸激酶活性,驱动多条肿瘤相关信号通路,促进细胞增殖与逃避凋亡。尽管ALK+ ALCL对一线化疗高度敏感,仍有 25%-30%患者面临复发。针对复发患者,ALK抑制剂(ALKi)治疗显示出突破性疗效,完全缓解率高达67%-90%。
传统分子监测主要依赖血液中循环肿瘤细胞的融合转录本RT-qPCR检测,能够评估微小残留病灶(MRD)。然而,ctDNA作为一种无创、高灵敏度的液体活检手段,在实体瘤及血液肿瘤中的应用日益广泛,尤其在耐药机制挖掘和疾病动态监测中展现巨大潜力。迄今为止,关于ctDNA在ALK+ ALCL中的研究数据极为有限。
本研究回顾性纳入了2020年11月至2023年3月间来自法国6个中心的18例组织学确诊的ALK+ ALCL患者,收集了至少一份血浆样本。对血浆细胞游离DNA(cfDNA)进行多重分子分析:
- Panel测序(基于Illumina TruSight Oncology 500 ctDNA v2,深度优于35000X,覆盖全已知ALK耐药位点),
- 低覆盖全基因组测序(LP-WGS)用于拷贝数变异(CNV)和肿瘤比例检测,
- ddPCR专针对患者个体的ALK基因融合断点设计引物探针,用于MRD敏感监测。
同时,研究将上述三种液体活检技术结果与血液循环肿瘤细胞融合转录本的逆转录定量PCR(RT-qPCR)结果进行了对比,以评价ctDNA分析的临床应用价值。
研究结果
ctDNA检出及分子特征
使用panel测序技术,ctDNA在87.5%(14/16)患者血浆中被检测到,样本中未检出拆解融合基因 rearrangement的2例,均采样于治疗期间或刚结束时,推测酶解物浓度偏低影响检出。ALK融合类型包括绝大多数NPM1::ALK,及少数ATIC::ALK、TRAF1::ALK和EEF1G::ALK。ctDNA含量介于0.2%~63.4%不等,反映了肿瘤负荷的异质性。常见的拷贝数变异(CNV)包括1q、2p及8q增幅,部分患者有MDM4及MYC基因扩增。高发突变基因为DNMT3A(4/16患者),提示与克隆性血细胞生成相关;同时也检测到LRP1B和TP53的点突变。
耐药突变的识别
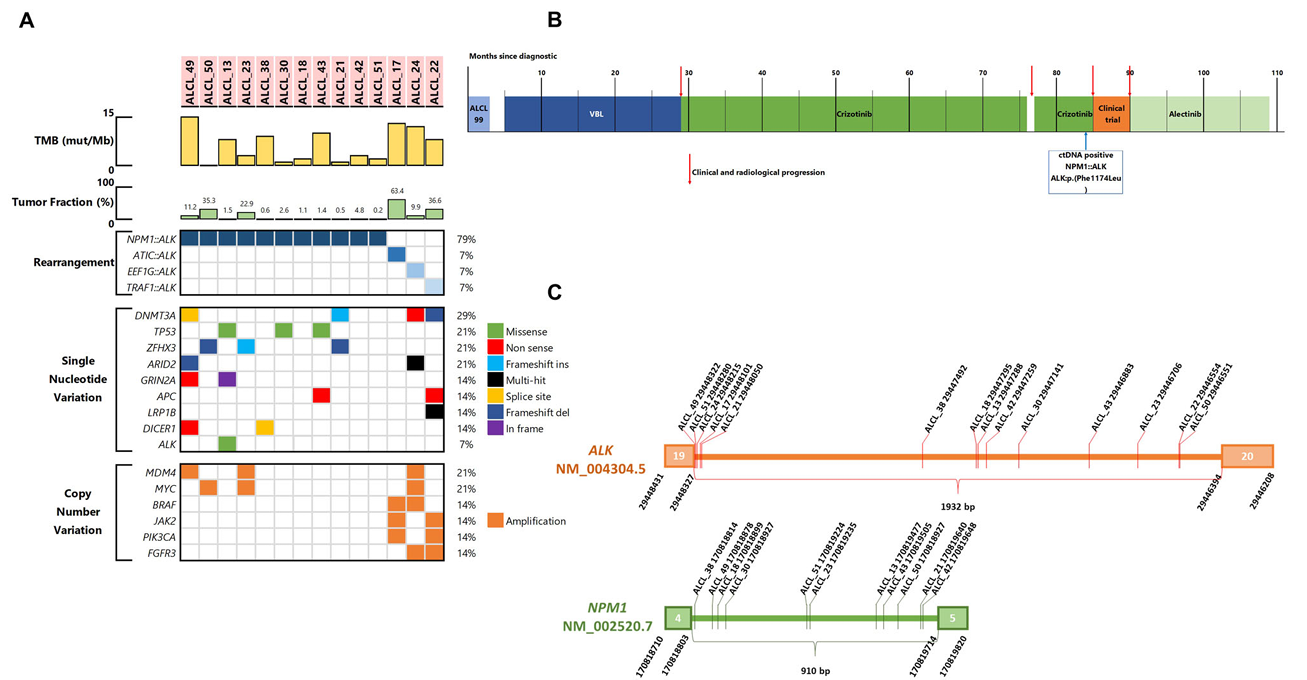
图1:血浆cfDNA panel测序分子谱及病历随访实例(ALCL_13),展现耐药突变检测及断点定位
ALK融合断点的精准定位
全部患者ALK融合体的基因组断点均定位在ALK基因第19内含子,NPM1断点集中于第4内含子。其他融合伴侣基因断点相对分散。断点的独特性支持个体化设计ddPCR探针用于MRD监测。
技术方法的比较
ddPCR表现出极高敏感度和特异性,且成本低、无需标准曲线,适于临床常规动态监测。
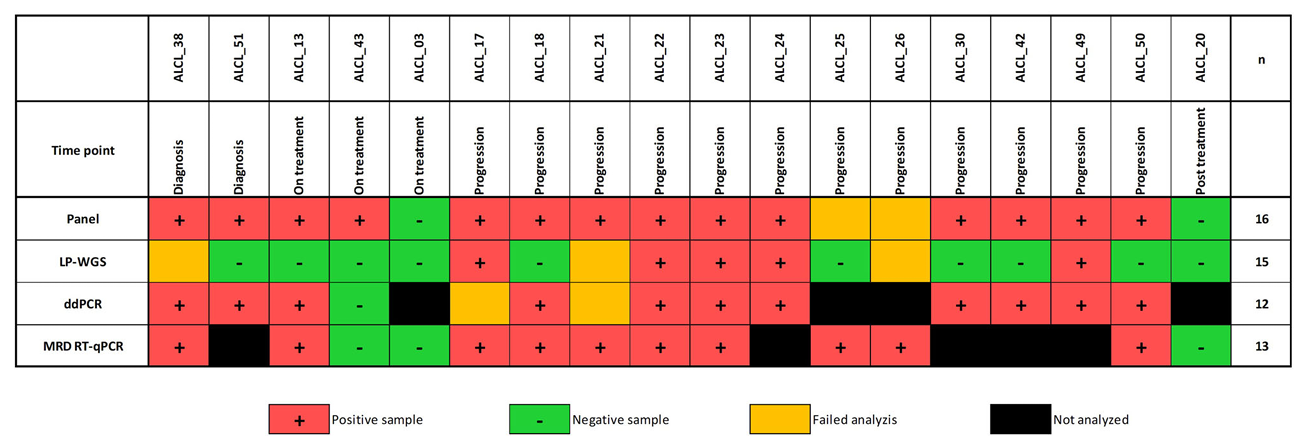
图2:各患者基于不同技术的ctDNA检测结果对比矩阵及采样时间点分布
研究意义
本研究首次系统验证了ctDNA在ALK+ ALCL中的应用潜力,证明:
- ctDNA不仅能够作为微小残留病灶(MRD)检测的新型非侵入性标志物,且其敏感性优于传统RT-qPCR。
- 通过ctDNA监测可以实时捕获耐药突变,提供了重要的个性化治疗调整信息。
- ALK融合基因断点的精准定位为量身定制的分子检测奠定基础,有助于指导下一代分子诊断技术应用。
鉴于ALK+ ALCL病情起伏多变,ctDNA的动态监控可助力临床诊断、疗效评估和早期复发预警,进一步丰富精准医疗工具箱。同时,本研究采用的多技术组合应用为血液肿瘤液体活检提供示范,推动液态活检向儿童恶性肿瘤领域的延伸。
原始出处
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言



















#ctDNA# #ALK阳性间变性大细胞淋巴瘤#
5 举报