Gastroenterology:MEK抑制剂治疗胃癌前病变的安全性与疗效探索
2025-06-27 MedSci原创 MedSci原创 发表于上海
本项研究为MEK抑制剂治疗胃癌前病变提供了临床初步证据,打破了以往胃癌前病变无药物可逆转的局限。
胃癌的发病机制复杂,Correa于1988年提出经典的“胃癌发展级联”模型,将胃癌前病变归纳为胃萎缩、肠上皮化生和异型增生三大步骤。特别是重度胃萎缩伴肠上皮化生被公认为胃癌发生的关键阶段。幽门螺杆菌感染、胃黏膜慢性炎症和腺体细胞丧失(如壁细胞萎缩)是形成肠上皮化生的前提。
目前,临床对胃癌前病变的管理多是定期内镜随访和病变切除,尚无明确药物治疗手段能够有效且安全地逆转这些癌前病理改变。动物模型研究显示,胃黏膜中RAS/MAPK信号通路异常活化,促使胃上皮细胞向肠上皮化生方向分化,MEK作为该通路关键激酶,其抑制剂可阻断这种异常分化。在小鼠和沙鼠模型中,MEK抑制剂治疗后胃腺体发生再生,预示其治疗胃癌前病变的潜力。然而,人类临床应用数据尚无报道。本研究即立足于胃癌早期切除患者,尝试用安全剂量的MEK抑制剂,验证其对胃前癌病变逆转的临床价值。

由美国Vanderbilt大学、东京大学等多中心协作完成的研究,最新发表在权威消化病学期刊Gastroenterology上,探究了MEK抑制剂在胃癌早期切除患者中对胃癌病变前的治疗效果及安全性。本研究纳入15例接受早期(I期)肠型胃癌切除且至少1年前完成幽门螺杆菌根治的患者,采用两周口服低剂量trametinib(1 mg/天)干预,随访时间最长达1年。结果显示,患者胃镜表现及组织学指标均获得不同程度的改善,特别是胃体部病变显著逆转,为临床胃癌前病变干预治疗开辟了新思路。
研究方法
本研究是一项多中心、开放标签的I期临床试验,纳入了15名既往早期肠型胃癌(I期)切除且幽门螺杆菌已成功根治至少2年的患者。患者接受两周口服低剂量trametinib(1 mg每天),治疗前、治疗后1个月及1年进行胃镜检查和系统性活检(覆盖胃体和胃窦多个部位)。
内镜图片根据京都分类法进行8分制评分,评估胃黏膜萎缩、肠上皮化生、皱襞肥厚等指标。病理学上采用辛氏分类和免疫组织化学染色(壁细胞标志物H/K-ATP酶及肠上皮化生标志物TFF3)定量分析壁细胞和肠上皮化生比例。安全性评估依据CTCAE 5.0版本标准,重点关注心脏、眼科及血液参数变化。
结果显示
1. 患者基本信息及安全性
- 15例患者中,男性11例,女性4例,年龄55-82岁不等,均曾接受胃癌I期手术或内镜切除,2-3年前完成幽门螺杆菌根治。
- 治疗期间患者整体耐受良好,唯一出现轻度血压升高,治疗终止后恢复正常。无眼科异常,心脏超声正常。
- 肝肾功能轻度波动,但无严重毒副反应,符合预期安全性要求。
2. 胃镜评估
- 初始内镜显示,11/15患者胃黏膜病变严重(京都评分>5),4例中度变化(3-4分)。
- 服用trametinib后1个月及1年复查,胃黏膜明显改善,皱襞变薄且排列较为规则,京都评分明显下降(P<0.05)。
- 同期对照组(15名仅随访患者)无明显评分变化,排除了单纯时间影响。
3. 组织学变化
| 指标 | 基线状态 | 治疗后1个月 | 治疗后1年 | 统计学意义 |
|---|---|---|---|---|
| 胃体壁细胞密度 | 11/14患者腺体萎缩 | 组织中壁细胞数量明显增加 | 壁细胞密度显著提升 | P<0.01 |
| 胃体肠上皮化生 | 12/15患者显示中重度IM | 腺体中IM数量显著减少 | IM减退趋势明显 | P<0.05 |
| 胃窦IM变化 | 14/15患者中重度IM | IM减少有限 | IM部分改善 | 趋势性改善 |
| 炎症程度 | 轻-中度 | 无显著改变 | 无显著改变 | 无统计学变化 |
- 免疫染色显示治疗后壁细胞(H/K-ATP酶阳性)数量增加,肠上皮化生标志物TFF3表达下调。
- 胃体部壁细胞再生较为明显,胃窦部改善不及胃体,且粘膜炎症程度未见明显变化。
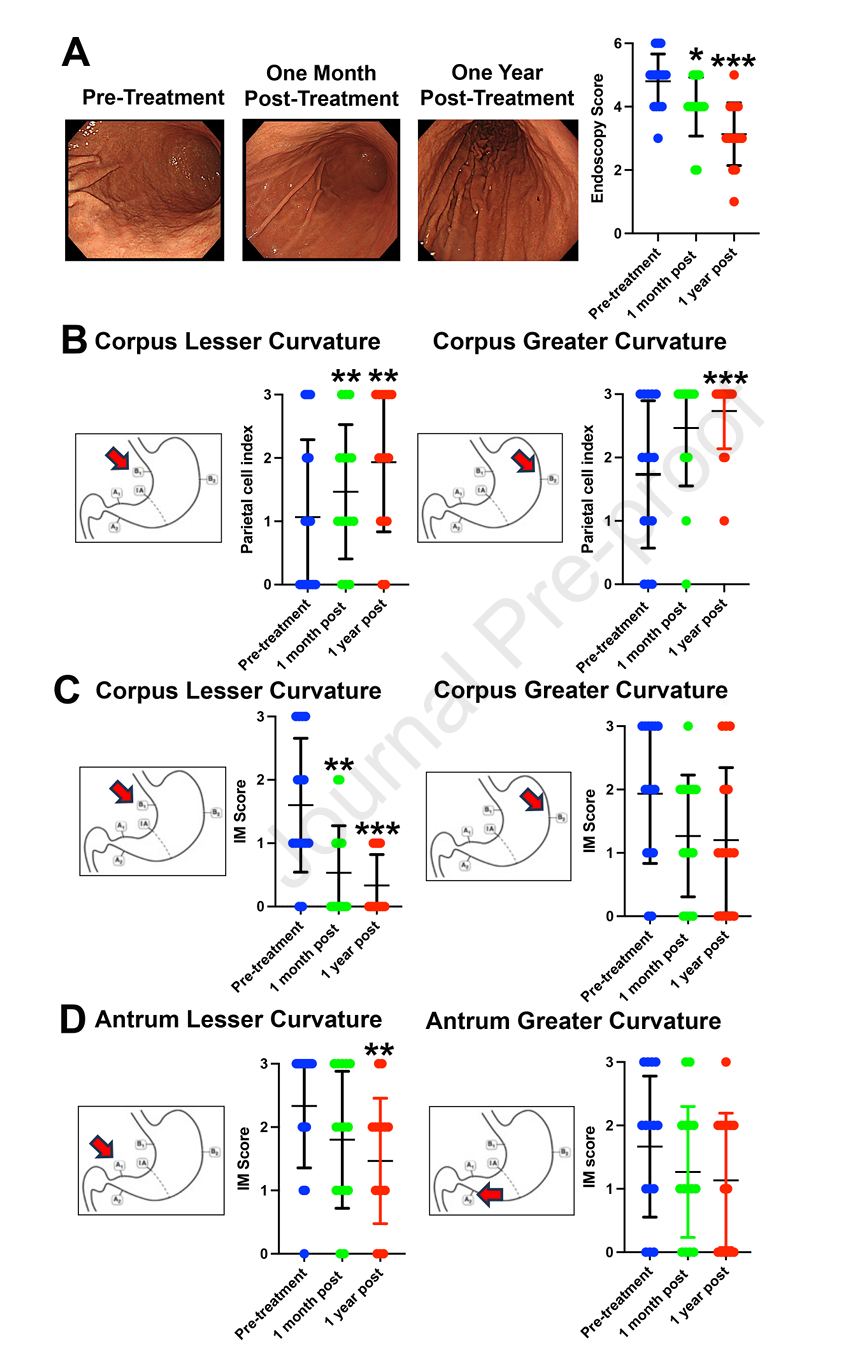
图: 内镜及组织学变化示意图(A:患者胃体部内镜图像,治疗前、治疗1个月及1年后的对比;B-D:壁细胞密度及肠上皮化生评分变化柱状图,显示治疗后显著改善)
研究意义与讨论
本项研究为MEK抑制剂治疗胃癌前病变提供了临床初步证据,打破了以往胃癌前病变无药物可逆转的局限。以往高剂量MEK抑制剂用于癌症治疗常伴严重副反应[10],本研究采用了远低于最大耐受剂量且短期口服方案,实现了良好的安全耐受性。同时,MEK抑制剂对胃黏膜病理改变的逆转作用显著,尤其在胃主体部腺体再生和肠上皮化生减少方面表现出积极效应。
这些发现揭示了RAS/MAPK通路在胃癌前病变发生中的关键作用,并提供了一条通过信号通路抑制逆转癌前病变的治疗思路。未来大规模随机对照试验仍需验证剂量、治疗时长及长期安全性,并探索对患者胃癌发病风险的真正影响。
此外,研究中胃窦部的改善相对有限,或提示不同胃部区域病理机制差异,需进一步深入分子机制研究及靶向精准给药策略。伴随生物标志物的筛选也将有助于识别最适合接受此类治疗的患者群体。
原始出处:
Goldenring JR, Jang B, Gotoda T, Yamaguchi N, Choi E, Nomura S, et al. Safety and efficacy of MEK inhibitor treatment for gastric pre-cancerous lesions. Gastroenterology. 2025. doi:10.1053/j.gastro.2025.05.023.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












MEK抑制剂治疗胃癌前病变
5 举报
#MEK抑制剂#
9 举报