论文解读|Wang L/Kouken B/Wang Q教授团队揭示IARS2在胰腺导管腺癌增殖与转移中的关键作用
2025-05-01 Genes and Diseases Genes and Diseases 发表于陕西省
该研究揭示了IARS2在PDAC中的致癌作用,发现其通过稳定β-catenin激活WNT/β-catenin信号通路,从而促进PDAC的增殖和转移。
胰腺导管腺癌(PDAC)是一种恶性程度极高的肿瘤,其五年生存率极低,严重威胁人类健康。PDAC的异质性使得治疗效果不佳,因此寻找新的治疗靶点和预后标志物至关重要。近年来,研究发现部分PDAC依赖于WNT信号通路。然而,目前针对WNT信号通路的抑制剂在临床试验中效果并不理想,提示可能存在其他内在或获得性耐药机制。
上海交通大学的Lifu Wang / Berik Kouken/ Qi Wang教授团队在本刊发表了题为“Isoleucyl-tRNA synthetase 2 promotes pancreatic ductal adenocarcinoma proliferation and metastasis by stabilizing β-catenin”的研究论文。该研究揭示了IARS2在PDAC中的致癌作用,发现其通过稳定β-catenin激活WNT/β-catenin信号通路,从而促进PDAC的增殖和转移。
01 IARS2高表达:PDAC预后不良的新指标
研究团队对GEPIA2和TCGA数据库分析,发现IARS2在PDAC组织和细胞系中高表达。更为重要的是,高表达IARS2的患者在总体生存时间和无病生存时间上均显著缩短,且IARS2的表达水平与肿瘤分级密切相关(图1)。这一发现为PDAC的预后评估提供了新的潜在标志物。
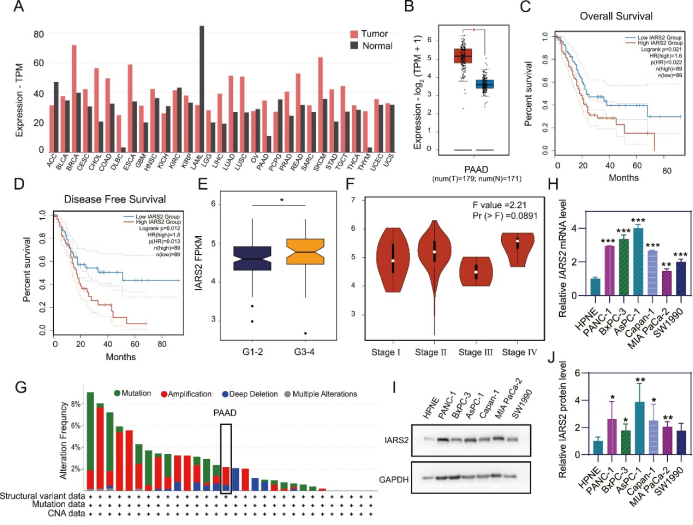
图1 IARS2在PDAC组织和细胞系中呈现上调(原文中Figure 1)
02 IARS2的致癌机制:从体外到体内的全面解析
体外实验显示,IARS2的表达水平直接影响了PDAC细胞的增殖、迁移和侵袭能力。IARS2的敲低显著抑制了这些恶性表型,而其过表达则起到了相反的作用。此外,IARS2还调控了N-cadherin、ZEB1、β-catenin和Slug等与上皮-间质转化(EMT)相关的关键蛋白。在裸鼠皮下异种移植模型中,IARS2过表达的肿瘤展现出更快的生长速度和更大的重量,Ki-67阳性细胞比例也更高,表明其强烈的增殖能力。尾静脉注射实验进一步证实,IARS2过表达的细胞更易于发生肺转移(图2)。
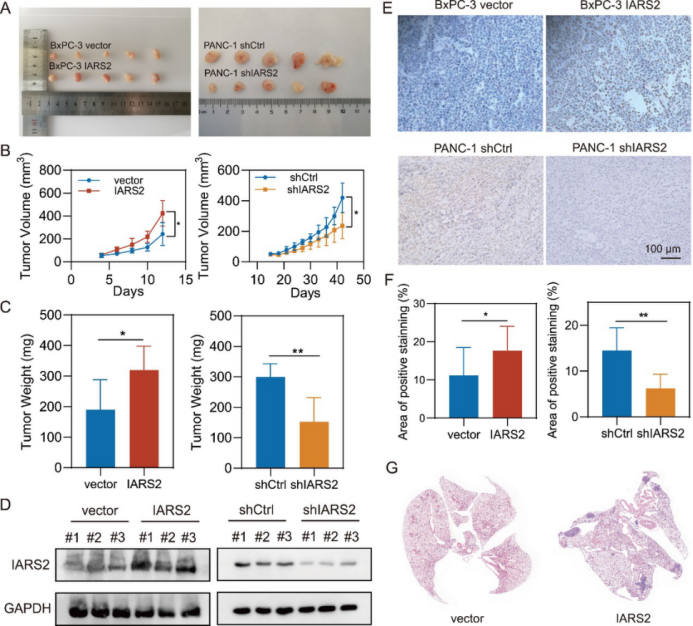
图2 IARS2在体内促进了胰腺导管腺癌的增殖和转移(原文中Figure 4)
03 转录组分析:IARS2与WNT信号通路及癌细胞干性的深度关联
通过对TCGA-PAAD队列的转录组分析,研究团队发现IARS2高表达与WNT信号通路相关基因的显著富集密切相关。同时,IARS2高表达的患者肿瘤干性特征更高,与干性标志物CD44、CD133等表达呈正相关(图3)。这些结果表明,IARS2可能通过调控WNT信号通路和癌细胞干性,在PDAC的进展中发挥重要作用。
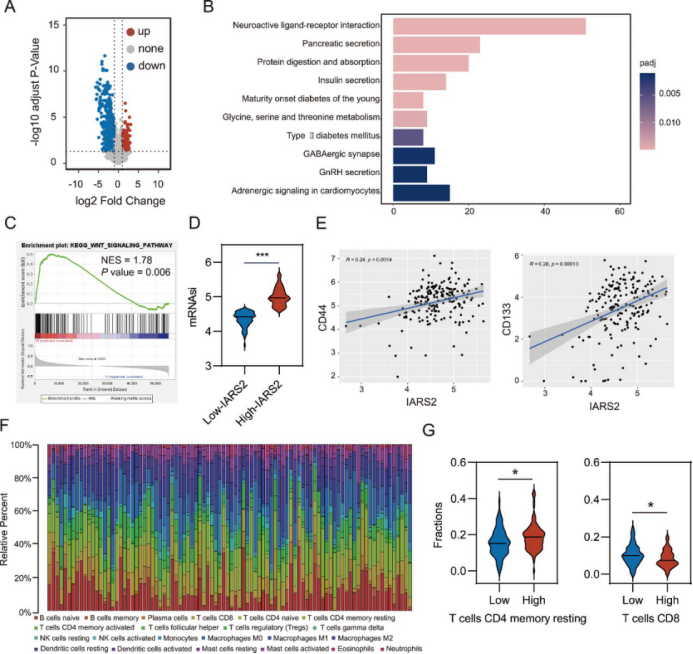
图3 转录组分析揭示了IARS2诱导的生物学过程(原文中Figure 5)
04 靶向β-catenin:抑制IARS2促肿瘤功能的新策略
研究进一步揭示了IARS2对β-catenin稳定性的调控作用。IARS2过表达减缓了β-catenin的降解速率,而其敲低则加速了这一过程。IARS2还抑制了β-catenin在Ser33/37位点的磷酸化,进而影响了WNT信号通路的下游靶点如c-MYC、c-JUN和MMP7。值得注意的是,使用β-catenin降解促进剂MSAB可以有效逆转IARS2过表达对PDAC细胞增殖、迁移、侵袭及EMT相关蛋白的促进作用(图4)。这一发现为靶向治疗PDAC提供了新的策略和思路。
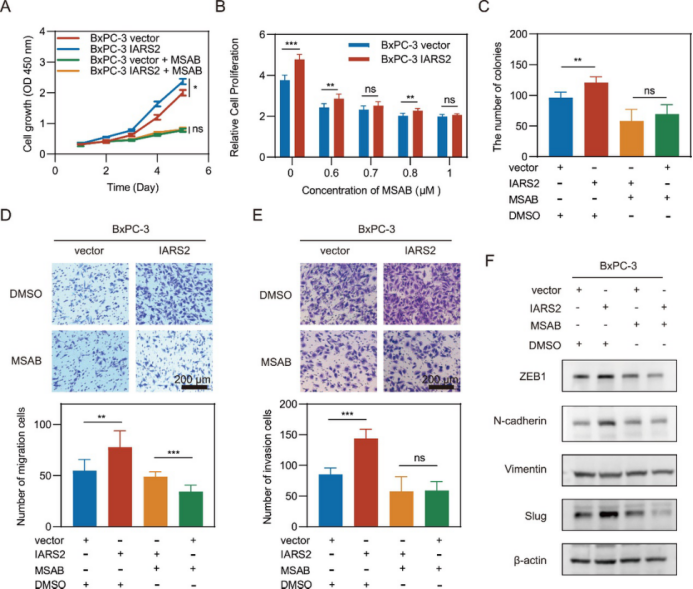
图4 促进β-catenin降解抑制了IARS2的肿瘤形成功能(原文中Figure 7)
综上所述,本研究全面揭示了IARS2在PDAC中的致癌作用及其分子机制,证实了IARS2作为PDAC潜在预后标志物和治疗靶点的重要价值。未来,随着对IARS2功能的深入研究和靶向药物的开发,有望为PDAC的治疗带来新的希望。
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S235230422400179X
引用这篇文章:
Jin Y, Huang X, Wang Z, Kouken B, Wang Q, Wang L. Isoleucyl-tRNA synthetase 2 promotes pancreatic ductal adenocarcinoma proliferation and metastasis by stabilizing β-catenin. Genes Dis. 2025;12(3):101382.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#胰腺导管腺癌# #IARS2#
23