老年认知韧性研究新突破:无需病理数据也能揭示大脑保护机制
2025-03-24 MedSci原创 MedSci原创 发表于陕西省
这项研究通过验证“银模型”的有效性,展示了其在提高统计效力和参与者多样性方面的巨大潜力。
阿尔茨海默病(AD)是老年人中最常见的神经退行性疾病,但令人惊讶的是,高达30%的老年人在尸检中符合AD的病理诊断标准,却从未表现出认知障碍。这种现象被称为“认知韧性”,即尽管存在神经病理变化,个体仍能保持优于预期的认知功能。近年来,科学家们开始关注这种韧性的遗传驱动因素,试图揭示大脑如何抵御淀粉样蛋白(amyloid)和tau蛋白沉积的负面影响。然而,传统研究依赖于神经病理学数据,这大大限制了样本量和统计效力。

最近,一项发表在顶级期刊上的研究通过创新的建模方法,成功绕过了对神经病理学数据的依赖,利用APOE等位基因状态、年龄和其他人口统计学变量作为神经病理学的替代指标,量化了认知韧性,并发现了与这种保护机制相关的新遗传驱动因素。这项研究不仅显著扩大了样本量,还提高了统计效力,为理解认知韧性提供了新的视角。
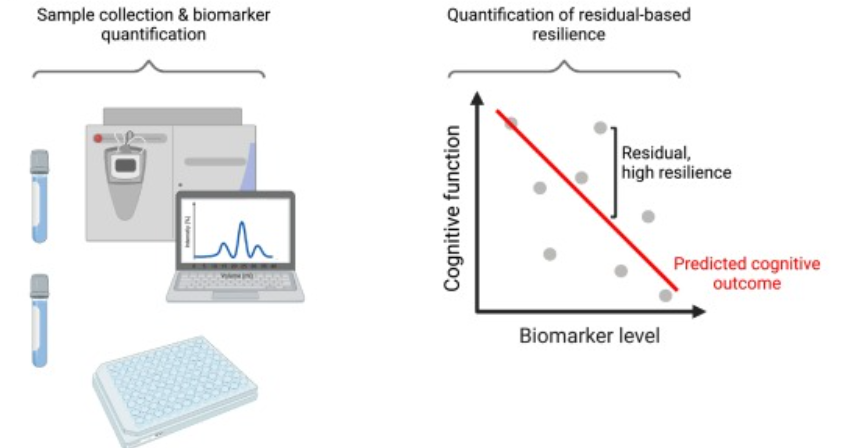
研究团队整合了来自8项老龄化队列研究的20,513名参与者的数据,采用混合效应回归模型分析了遗传变异对认知韧性的影响。研究定义了两种模型框架:“银模型”:无需神经病理学数据,基于APOE等位基因状态、年龄和其他人口统计学变量构建(n=17,241)。“金模型”:包含尸检神经病理学评估数据(n=3,272)。研究团队通过跨祖先全基因组关联分析(GWAS)、基因和通路分析以及遗传相关性分析,探索了认知韧性的遗传基础。所有分析均在全体参与者中进行,并在基线认知未受损的亚组中重复验证。
研究发现,“银模型”和“金模型”在量化认知韧性方面表现出高度相关性(R=0.77-0.88),表明无需神经病理学数据也能有效评估认知韧性。这一发现为后续大规模研究提供了重要工具。同时,认知韧性与多种神经精神和心血管特征显著相关(PFDR < 5.0x10-2),提示这些特征可能在保护大脑功能中发挥重要作用。
通路分析研究发现了三个与认知韧性显著相关的生物学通路:氨基酸及其衍生物的代谢(PFDR=4.1x10-2),转化生长因子β(TGF-β)生成的负调控(PFDR=1.9x10-2),严重急性呼吸综合征相关通路(PFDR=3.9x10-4)。在基线认知未受损的参与者中,研究团队发现了一个接近全基因组显著性的位点(rs757022,位于17号染色体),该位点与大脑中多个ATP结合盒(ATP-binding cassette, ABC)基因的表达显著相关。
这项研究通过验证“银模型”的有效性,展示了其在提高统计效力和参与者多样性方面的巨大潜力。这不仅为认知韧性的研究提供了新的工具,还为开发针对AD和其他神经退行性疾病的预防和治疗策略提供了重要线索。
原始出处:
The Alzheimer’s Disease Neuroimaging Initiative (ADNI), Alzheimer’s Disease Genetics Consortium (ADGC), The Alzheimer’s Disease Sequencing Project (ADSP), Novel modelling approaches to elucidate the genetic architecture of resilience to Alzheimer's disease, Brain, 2025;, awaf106
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






















#阿尔茨海默病# #认知韧性#
23