读书报告 | 肿瘤细胞中GPR65失活通过巨噬细胞重塑CAR-T细胞耐药性
2025-07-03 iCombo iCombo 发表于上海
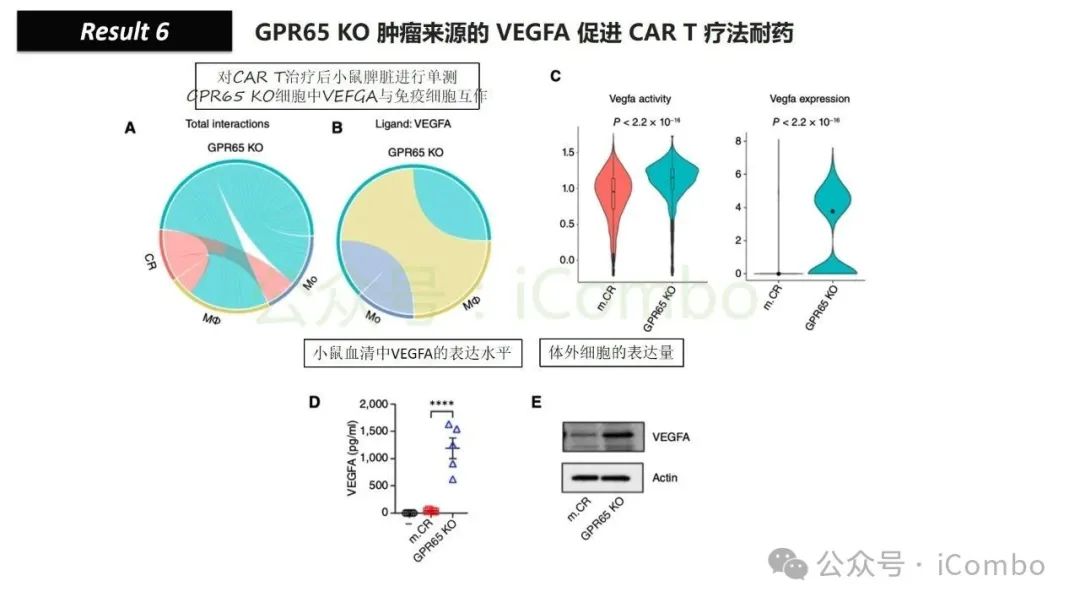
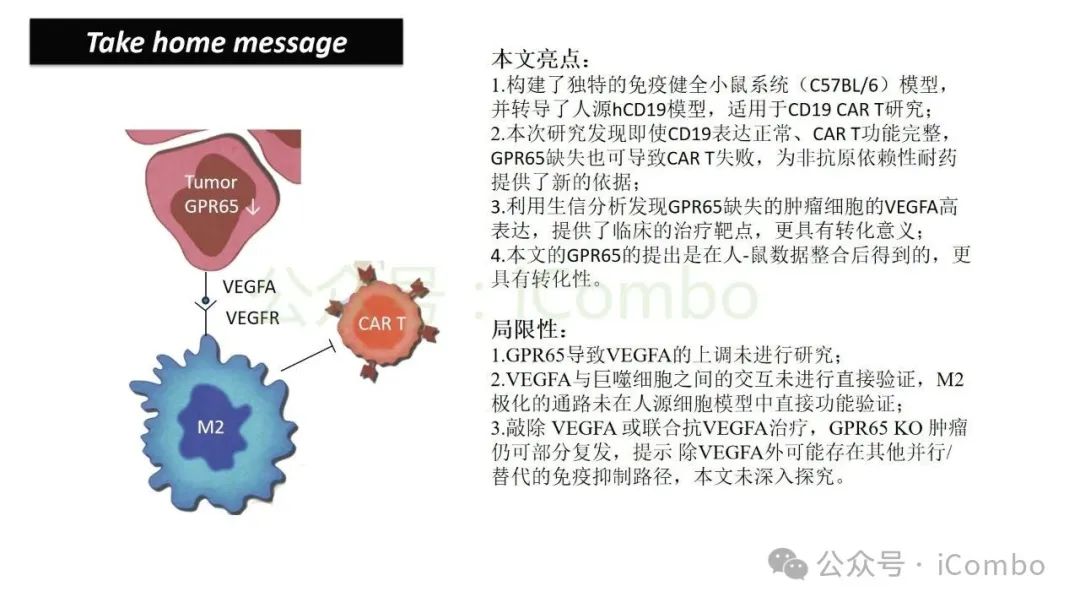
将抗VEGFA治疗与CAR T细胞联合使用,显著延长了携带GPR65缺失肿瘤小鼠的生存时间。这些发现强调了:肿瘤基因表达可显著影响肿瘤微环境(TME),从而决定CAR T细胞治疗的效果。
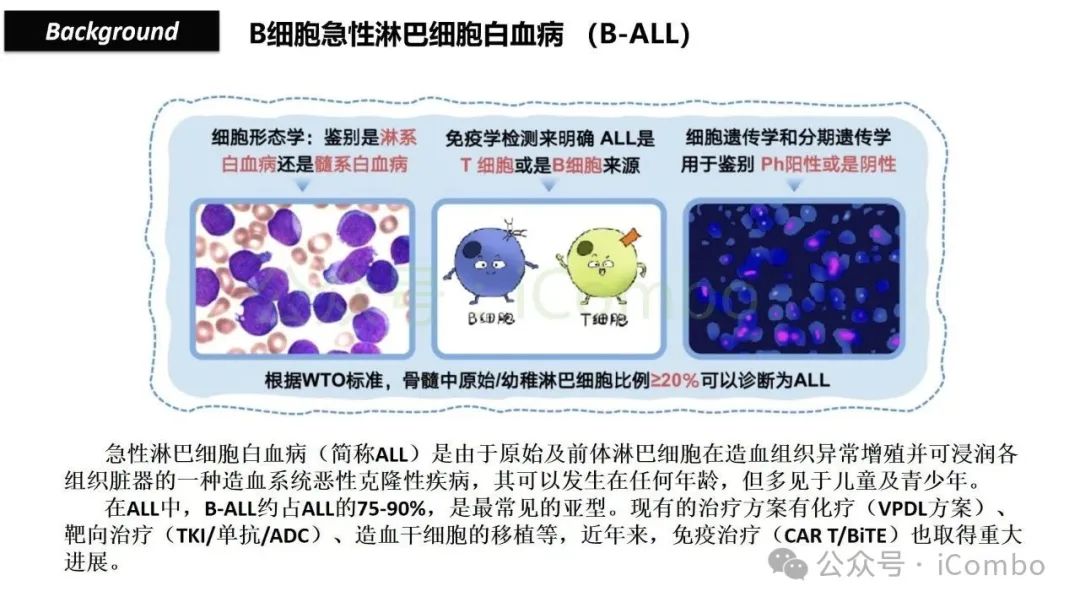
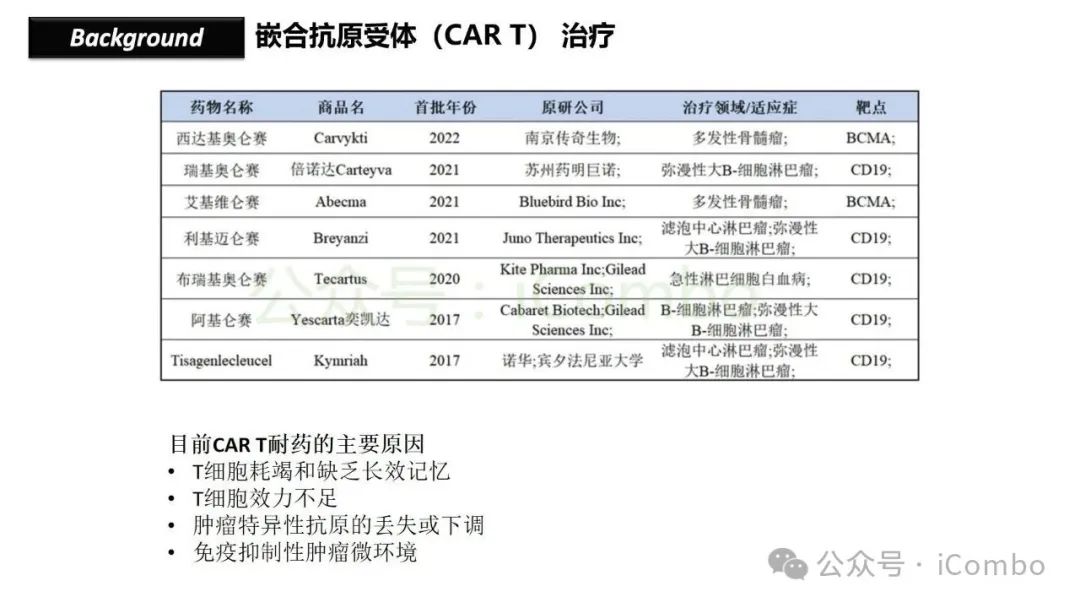
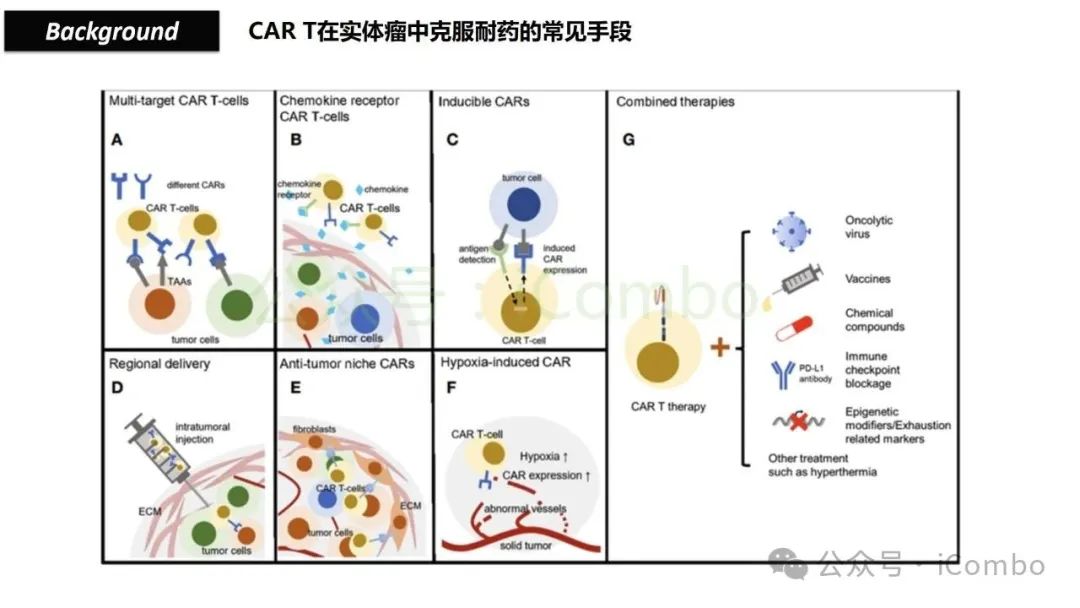
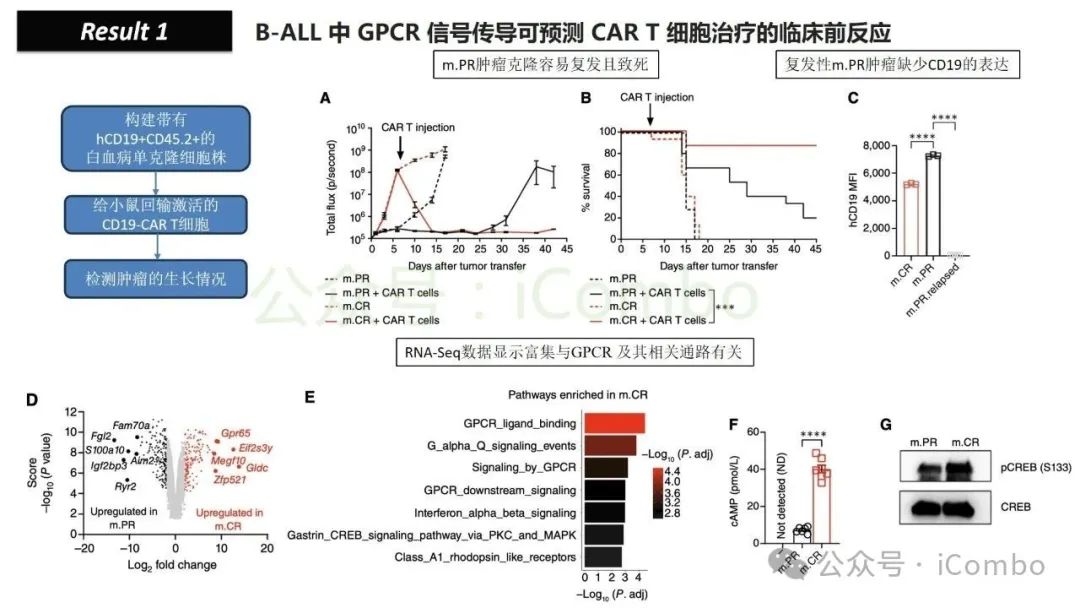
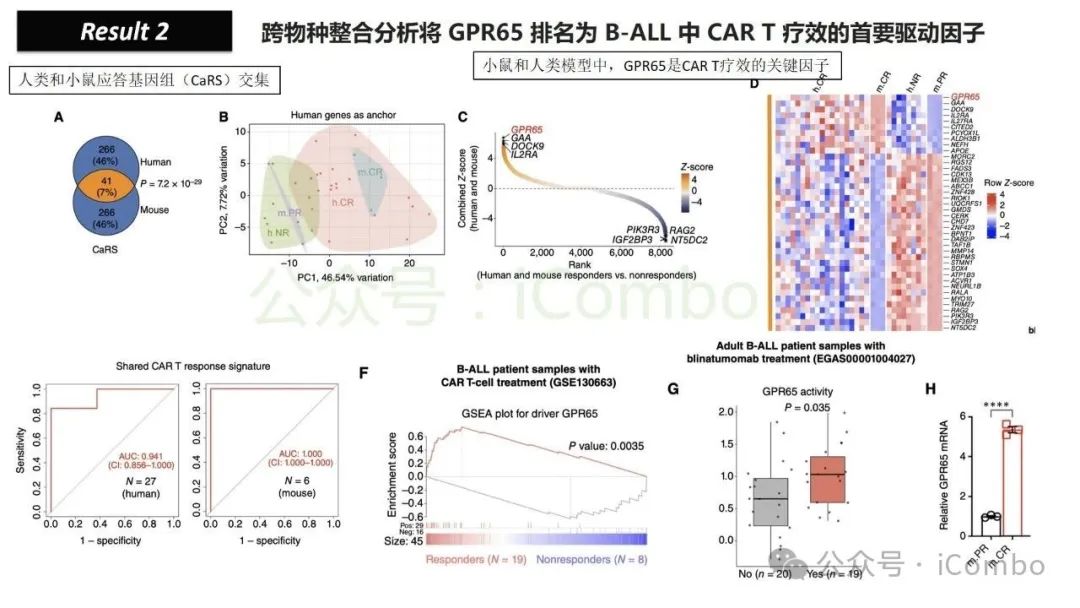
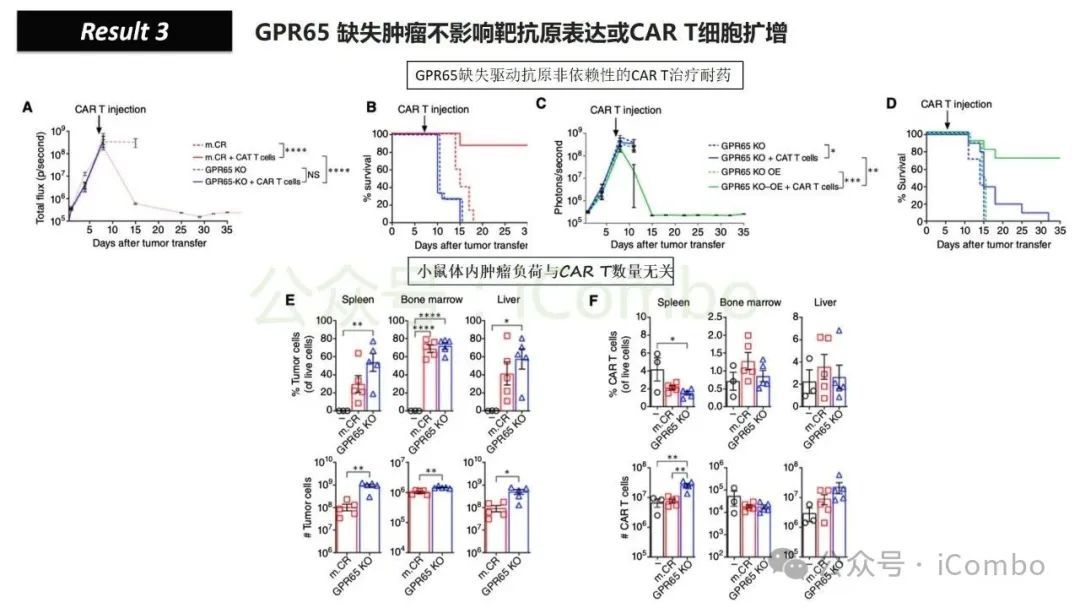
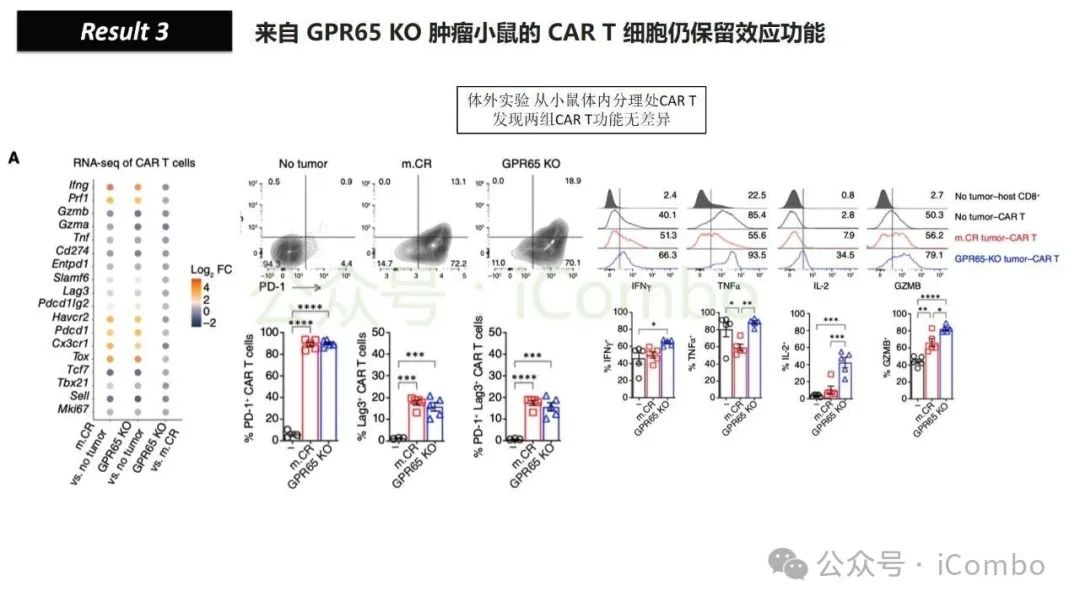
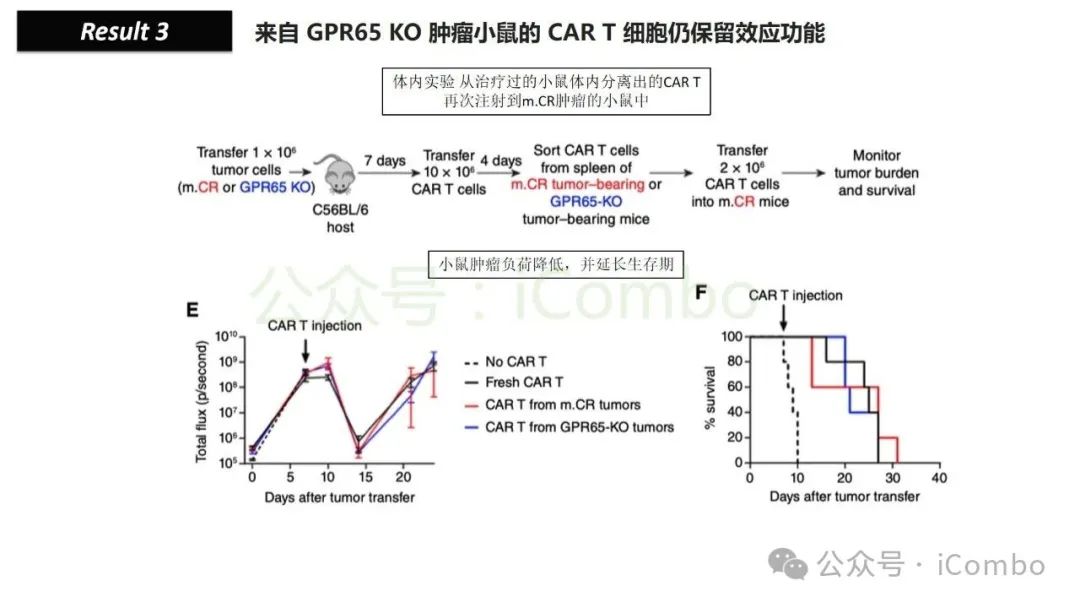
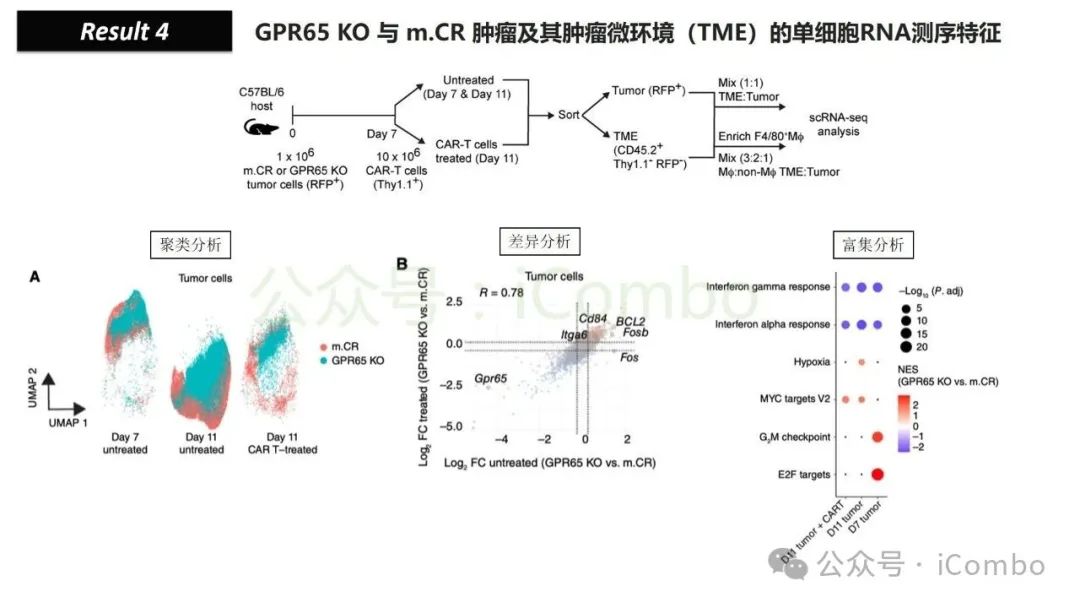
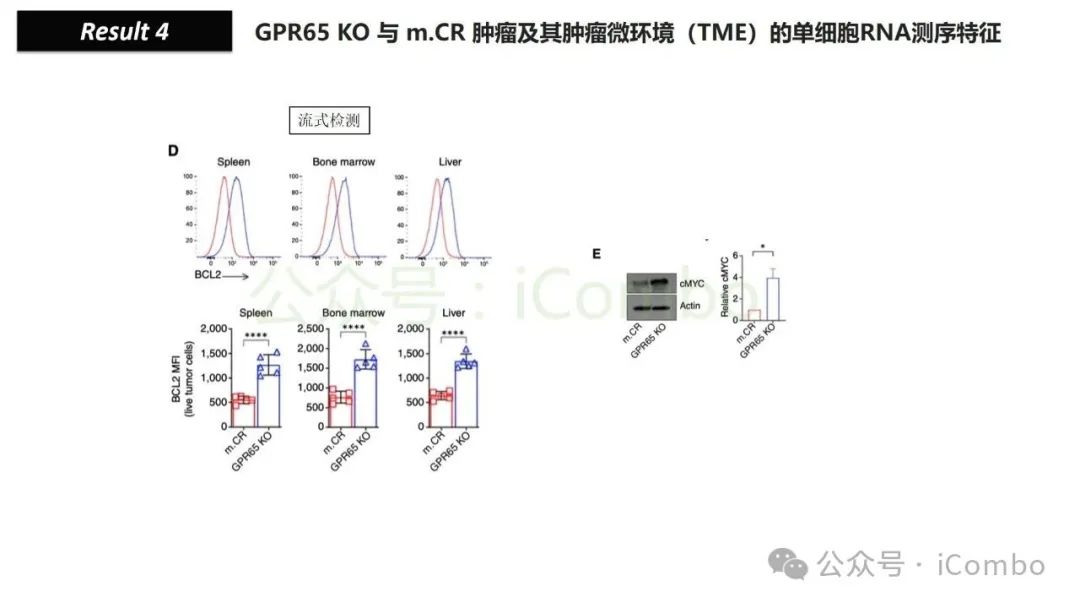
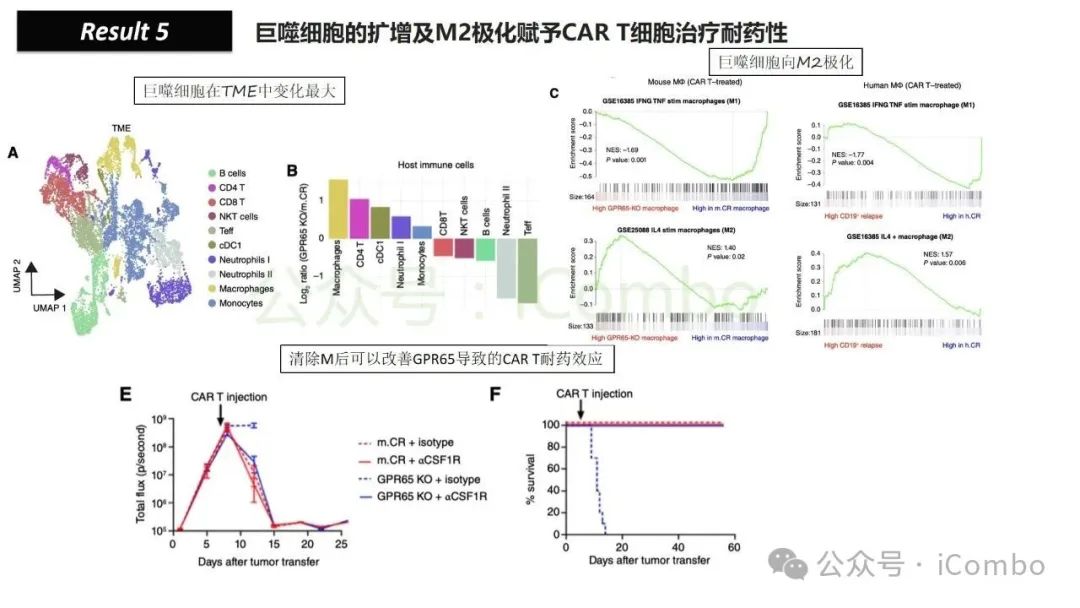
导读 靶向CD19的工程化表达嵌合抗原受体(CAR)的T细胞疗法已经在部分复发或难治性B细胞急性淋巴细胞白血病(B-ALL)患者中实现了治愈。然而,仍有大量患者在治疗后复发或无效。因此,识别CAR T细胞疗法耐药的潜在机制,是开发更有效治疗策略的前提。迄今为止,旨在增强CAR T细胞疗效的临床和前临床研究,大多集中在CAR T细胞本身的功能方面。例如,CAR T细胞的衰竭状态和缺乏长效记忆表型被认为是疗效不佳的关键原因。然而,值得注意的是,有些肿瘤即使保留了CD19表达,仍表现出耐药性,而这方面研究较少。此类耐药可能是由于肿瘤通过影响宿主免疫系统和肿瘤微环境(TME)来抑制CAR T细胞反应。在实体瘤中已有这方面的观察,但在血液系统肿瘤中,这些机制较难研究,也尚未明确。本研究中,研究者发现GPR65缺失的肿瘤会通过提高VEGFA表达,进而诱导宿主巨噬细胞扩增并偏向M2极化(免疫抑制型)。去除宿主巨噬细胞或敲除GPR65缺失肿瘤中的VEGFA,可以恢复对CAR T治疗的敏感性。此外,将抗VEGFA治疗与CAR T细胞联合使用,显著延长了携带GPR65缺失肿瘤小鼠的生存时间。这些发现强调了:肿瘤基因表达可显著影响肿瘤微环境(TME),从而决定CAR T细胞治疗的效果(Cancer Discov. 2025 May 2;15(5):1018-1036. doi: 10.1158/2159-8290.CD-24-0841)。








本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





.jpg)









#CAR T细胞# #GPR65#
1 举报